必修二第一章第二节元素周期律第3课时[下学期]
文档属性
| 名称 | 必修二第一章第二节元素周期律第3课时[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 592.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-15 16:19:00 | ||
图片预览





文档简介
课件16张PPT。第二节 元素周期律 第三课时判断金属性强弱的标准复习①单质与水或酸反应置换出氢气的难易
②元素最高价氧化物的水化物(氧化物间接或直接与水反应生成的化合物)——氢氧化物的碱性强弱
③相互置换判断元素非金属性的强弱的标准①单质与氢气化合生成气态氢化物的难易
②元素最高价氧化物对应的水化物的酸性强弱
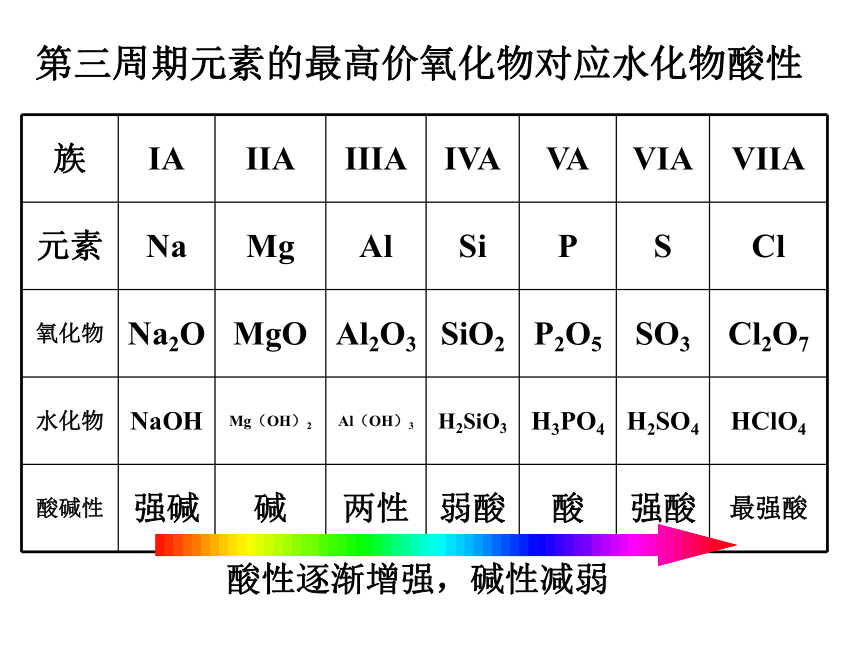
③相互置换1.元素的金属性和非金属性与元素在周期表中位置的关系(1)同周期元素 同周期,电子层数相同,质子数越多 (即原子序数越大),原子半径越小 ,核对电子的引力越 强 ,原子失电子能力越 弱 ,得电子能力越 强 ,金属性越弱 、非金属性越强 。同周期中:从左到右,金属性逐渐减弱,非金属性逐渐增强请分析11好到18号元素,金属性和非金属性的变化规律。三、元素周期表和元素周期律的应用第三周期元素的最高价氧化物对应水化物酸性酸性逐渐增强,碱性减弱(2)同主族元素同主族:从上到下,金属性逐渐增强,非金属性逐渐减弱 同主族,电子层数越多原子半径越大,核对电子引力越弱,原子失电子能力越强,得电子能力越弱,金属性越强 、非金属性越弱。元素周期表中:周期序数=电子层数 ;
主族序数=最外层电子数 ;
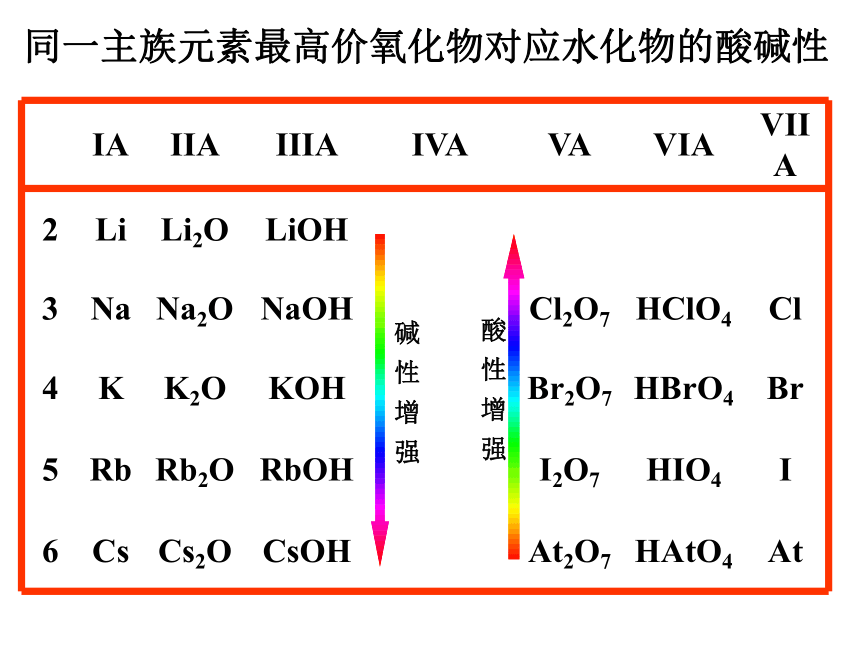
原子序数=核内质子数。同一主族元素最高价氧化物对应水化物的酸碱性酸 性 增 强碱 性 增 强元素气态氢化物的热稳定性热稳定性逐渐增强热稳定性逐渐减弱热稳定性逐渐减弱热稳定性逐渐增强元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强元素化合价与元素在周期表中位置的关系主族序数=最外层电子数=主族元素的最高正价 (价电子)主族元素中:|最高正价|+|最低负价|=8 金属只有正价,O和F只有负价学与问自然科学方面
周期表为发展物质结构理论提供了客观依据。原子的电子层结构与元素周期表有密切关系,周期表为发展过度元素结构、镧系和锕系结构理论,甚至为指导新元素的合成,预测新元素的结构和性质都提供了线索。元素周期律和周期表在自然科学的许多部门,都是重要工具。
2、元素周期表及元素周期律应用生产上某些应用
1.农药多数是含等元素的化合物,在周期表的右上角。
2.半导体材料都是周期表里金属与非金属接界处的元素,如等。
3.催化剂的选择:人们在长期的生产实践中发现过渡元素对许多化学反应有良好的催化性能。这些元素的催化性能跟它们的原子的次外层电子层电子排布的特点有密切关系。
4. ……还有很多。3、性质、结构、位置之间的关系练习:1、下列性质的递变中,正确的是( )
A.O、S、Na的原子半径依次增大
B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强
D.HCl、HBr、HI的还原性依次减弱2、某元素的原子序数为15,对它的认识错误的是( )。
A、位于元素周期表第三周期
B、该元素最高正价是+5价,最低负价是-3价
C、该元素最高价氧化物对应水化物的酸性比硝酸强
D、该元素的非金属性比硫弱
3、下列排列顺序错误的是( )。
A、原子半径:Na>Mg>Al
B、离子半径:Cl->Br->I-
C、稳定性:HI>HBr>HCl
D、酸性:HClO4>H2SO4>H3PO44、下列元素最高价氧化物对应的水化物酸性最强的是( )。
A、核电荷数为6的元素
B、质子数为8的元素
C、第三周期第ⅣA族的元素
D、核外电子数为 17的元素BCD
②元素最高价氧化物的水化物(氧化物间接或直接与水反应生成的化合物)——氢氧化物的碱性强弱
③相互置换判断元素非金属性的强弱的标准①单质与氢气化合生成气态氢化物的难易
②元素最高价氧化物对应的水化物的酸性强弱
③相互置换1.元素的金属性和非金属性与元素在周期表中位置的关系(1)同周期元素 同周期,电子层数相同,质子数越多 (即原子序数越大),原子半径越小 ,核对电子的引力越 强 ,原子失电子能力越 弱 ,得电子能力越 强 ,金属性越弱 、非金属性越强 。同周期中:从左到右,金属性逐渐减弱,非金属性逐渐增强请分析11好到18号元素,金属性和非金属性的变化规律。三、元素周期表和元素周期律的应用第三周期元素的最高价氧化物对应水化物酸性酸性逐渐增强,碱性减弱(2)同主族元素同主族:从上到下,金属性逐渐增强,非金属性逐渐减弱 同主族,电子层数越多原子半径越大,核对电子引力越弱,原子失电子能力越强,得电子能力越弱,金属性越强 、非金属性越弱。元素周期表中:周期序数=电子层数 ;
主族序数=最外层电子数 ;
原子序数=核内质子数。同一主族元素最高价氧化物对应水化物的酸碱性酸 性 增 强碱 性 增 强元素气态氢化物的热稳定性热稳定性逐渐增强热稳定性逐渐减弱热稳定性逐渐减弱热稳定性逐渐增强元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强元素化合价与元素在周期表中位置的关系主族序数=最外层电子数=主族元素的最高正价 (价电子)主族元素中:|最高正价|+|最低负价|=8 金属只有正价,O和F只有负价学与问自然科学方面
周期表为发展物质结构理论提供了客观依据。原子的电子层结构与元素周期表有密切关系,周期表为发展过度元素结构、镧系和锕系结构理论,甚至为指导新元素的合成,预测新元素的结构和性质都提供了线索。元素周期律和周期表在自然科学的许多部门,都是重要工具。
2、元素周期表及元素周期律应用生产上某些应用
1.农药多数是含等元素的化合物,在周期表的右上角。
2.半导体材料都是周期表里金属与非金属接界处的元素,如等。
3.催化剂的选择:人们在长期的生产实践中发现过渡元素对许多化学反应有良好的催化性能。这些元素的催化性能跟它们的原子的次外层电子层电子排布的特点有密切关系。
4. ……还有很多。3、性质、结构、位置之间的关系练习:1、下列性质的递变中,正确的是( )
A.O、S、Na的原子半径依次增大
B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强
D.HCl、HBr、HI的还原性依次减弱2、某元素的原子序数为15,对它的认识错误的是( )。
A、位于元素周期表第三周期
B、该元素最高正价是+5价,最低负价是-3价
C、该元素最高价氧化物对应水化物的酸性比硝酸强
D、该元素的非金属性比硫弱
3、下列排列顺序错误的是( )。
A、原子半径:Na>Mg>Al
B、离子半径:Cl->Br->I-
C、稳定性:HI>HBr>HCl
D、酸性:HClO4>H2SO4>H3PO44、下列元素最高价氧化物对应的水化物酸性最强的是( )。
A、核电荷数为6的元素
B、质子数为8的元素
C、第三周期第ⅣA族的元素
D、核外电子数为 17的元素BCD
