元素周期律[下学期]
图片预览








文档简介
课件26张PPT。元素周期表
元素周期律考 点1、根据元素原子结构的特点和在周期表中的位置关系,确定形成化合物的形式.
2、根据原子的电子层结构特点,确定元素的性质(原子序数、原子半径、最外层电子数、最高化合价等).
3、根据同周期、同主族元素性质的递变规律,对未知物质的结构与性质进行预测.一. 3种微粒 1)比较微粒 质量 相对质量 电性 意义
质子 1.6726×10-27kg 1.007 一个单位正电荷 决定元素的种类
中子 1.6743 ×10-27kg 1.008 不带电、中性 决定同位素和质量数
电子 9.1095×10-27kg 1/1836 一个单位负电荷 价电子决定元素化性原子核原子质子:Z 个
中子:A-Z 个
核外电子:Z个3)两个关系式
原子序数=核电荷数=质子数=原子核外电子数 (阴、阳离子=?)
质量数(A)=质子数(Z)+中子数(N) 1.原子的种类决定于原子的( )
A.原子量大小 B.最外层电子数
C.核电荷数 D.核内质子数和中子数DB3.某元素原子的最外层电子数为次外层电子数的3倍,则该元素原子核内质子数是( )
A.8 B.10 C.6 D.7A4. 有A和B两种原子,A原子的M层比B元素原子的M层少3个电子,B元素原子的L层电子数恰好是A元素原子L层电子数的2倍,A、B两元素分别是( )
A. C和Cl B. C和Al
C. Si 和Na D. Na 和He B二、比较微粒大小的依据(三看)
1、看电子层数:
电子层数越多半径越大 Na>Na+
2、看核电荷数:
电子层数相同时,核电荷数越大半径越小
S2->Cl->Ar>K+>Ca2+; O2->F->Ne>Na+>Mg2+>Al3+
3、看电子数:
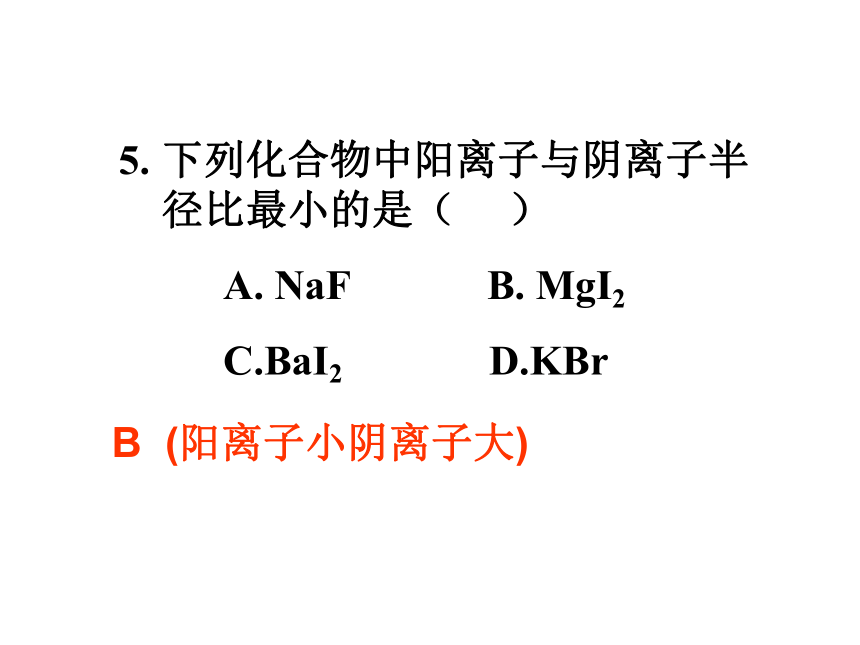
电子层和核电荷数都相同时,电子数越多半径越大 Cl->Cl;Fe2+>Fe3+下列化合物中阳离子与阴离子半径比最小的是( )
A. NaF B. MgI2
C.BaI2 D.KBrB (阳离子小阴离子大)6. A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则A B C三种离子半径大小的顺序是 ( )
A. A>B>C B. B>A>C
C. C>A>B D. C>B>AB三. 元素周期律概念: 元素的性质(原子半径、主要化合价)随着原子序数的递增而呈周期性的变化
规律:原子半径同周期从左到右渐小,同族从上到下渐大。
主要化合价:+1 +2 +3 +4 +5 +6 +7 0 -4 -3 -2 -1
原因:核外电子排布随着原子序数的递增而呈周期性的变化 (1~8) 四、元素周期表的结构
1、周期表格要牢记,变化体现周期律,七主七副七周期,VIII族零族镧锕系元素周期表编排原则1.按原子序数递增的顺序从左到右排列
2.将电子层数相同元素排成一个横行
3.把最外电子数相同的元素排成一个纵行构造周期:表中的每一横行。短(1.2.3)长(4.5.6)不完全(7)
族: 7主 (长短周期元素)、7副(仅有长周期元素)、 零(稀有气体)、VIII(8.9.10三纵行)
镧锕系:为紧凑周期表而列在外。要求能画简易 周期表(主族和前四周期)
18纵7横,I~VIII; I~0。高A低 B。
记忆:1)原子序数:记两头推中间
2)每周期所含元素(2. 8. 8. 18. 18. 32. 23)
3)稀有气体结构(内推本周期IIIA~VIIA,外推下周期 IA IIA)原子结构
变化规律同周期电子层数=周期序数
最外层电子数从左到右 1~7(8)同主族电子层数从上到下依次增大
最外层电子数=族序数=价电子数=最高正价数2、原子结构与元素周期表的关系五、同主族、同周期元素性质递变规律内容 同周期(从左到右) 同主族(从上到下)
电子层数 相同(等于周期序数) 逐渐增加
最外电子数 逐渐增加(1~8) 相同(等于族序数)
最高正价 +1~~+7 等于族序数
原子半径 逐渐减小 逐渐增大
离子半径 阴阳离子半径均渐小 阴阳离子半径均渐大
得电子能力(氧化性) 逐渐增强 逐渐减弱
失电子能力(还原性) 逐渐减弱 逐渐增强
金属性 逐渐减弱 逐渐增强
非金属性 逐渐增强 逐渐减弱
最高价氧化物水化物酸碱性 碱性渐弱酸性渐强 碱性渐强酸性渐弱
气态氢化物稳定性 逐渐增强 逐渐减弱特殊知识点找元素之最最活泼金属 、最活泼非金属
最轻的金属 、最轻的非金属
最高熔沸点是 、最低熔沸点是
最稳定的气态氢化物 ,含H%最大的是
最强酸 、最强碱
地壳中含量最多的金属和非金属找半导体:在“折线”附近 Si Ge Ga
找农药: 在磷附近 P As S Cl F
找催化剂、耐高温、耐腐蚀材料:
过渡元素 Fe Ni Pt Pd RhCsF2LiH2CHeHFCH4HClO4CsOHAl O 7.短周期元素M和N的离子M2+和N2-具有相同电子层结构,则下列说法正确的是( )
A.M2+的离子半径比N2-的小
B.M的原子序数比N小
C.M和N原子的电子层数相等
D.M和N原子最外层电子数相等A8.铍的原子序数为4,下列叙述正确的( )
A.铍的原子半径小于硼的原子半径
B.氯化铍分子中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍跟冷水反应产生氢气C比较或推断一些性质比较同族元素的 金属性 Ba>Ca>Mg
非金属性 F>Cl>Br
最高价氧化物的水化物的酸碱性 KOH>NaOH>LiOH
氢化物的稳定性 CH4>SiH4
比较同周期元素及其化合物的性质
碱性: NaOH>Mg(OH)2>Al(OH)3
稳定性: HF>H2O>NH3
比较不同周期元素的性质(先找出与其同周期元素参照)
推断一些未知元素及其化合物的性质
预测88Ra的性质9.随着卤素原子半径的增大,下列递变规律正确的是( )
A.单质的熔沸点逐渐降低
B.卤素离子的还原性逐渐增强
C.气态氢化物稳定性逐渐增强
D.单质氧化性逐渐增强B10.同一周期的三种元素,已知最高价氧化物水化物的酸性强弱:HXO4>H2YO4>H3ZO4,则下列判断不正确的是( )
A.原子半径X>Y>Z
B.非金属性X>Y>Z
C.气态氢化物的稳定性X>Y>Z
D.阴离子的还原性Z >Y > XA1. 在周期表中,第三、四、五、六周其元素的数目分别是( )
A. 8、18、32、32 B.8、18、18、32
C. 8、18、18、18 D. 8、8、18、18 2.下列各组元素的气态氢化物稳定性由弱到强的组是 ( )
A. F、Cl、Br B. N、O、F C. Cl、S、P D.As、P、N 2、元素周期表是一个化学知识宝库,它的内涵是十分丰富的。下列关于目前使用的元素周期表的结构及用途的叙述错误的是 ( )
A、元素周期表有7个周期,分为3个短周期、3个长周期、1个不完全周期
B、元素周期表有18个纵列,分为7个主族、7个副族、1个第Ⅷ族、1个零族
C、分区线左侧是非金属元素,右侧是金属元素,位于分区线附近的元素,既表现金属元素的某些性质,又表现非金属元素的某些性质
D、有“国防金属”美誉的镁位于ⅡA族,与它同一列的元素被称为碱土金属元素 3、以下比较元素原子得失电子能力强弱的方法,不恰当的是 ( )
A、元素的单质与水(或酸)反应置换出氢的反应越容易发生,该元素原子失电子的能力越强
B、元素的单质与氢气化合的反应越容易进行,生成的气态氢化物越不稳定,该元素原子得电子的能力越强
C、元素最高价氧化物对应的水化物的碱性越强,该元素原子失电子的能力越强
D、元素最高价氧化物对应的水化物的酸性越强,该元素原子得电子的能力越强 5、下列说法中,正确的是 ( )
A、K、Mg、C、S四种元素的最高正化合价逐渐升高
B、含有共价键的分子,一定是共价化合物
C、化学反应中能量的变化,都表现为热量的变化
D、原子半径随原子序数的递增而逐渐增大
6、某元素R的原子序数小于18,该元素的1个原子夺取1个电子后形成稀有气体原子电子层结构的离子,该元素可形成含氧酸HRO3。下列说法正确的是 ( )
A、R元素可形成含氧酸HRO4 B、R元素最高正价为+5价
C、R元素原子最外电子层上有7个电子 D、R元素的原子序数为7 练习 现有A和B两种原子,A原子的M层比B原子
的M层少3个电子, B原子的L层电子数恰为A原子的L
层电子数的两倍。则A和B是何种原子?对B原子,M层至少有3个电子,L层必排满 2x = 8 x = 4 2 2 x y y + 3 2x对A原子,L层未排满,不可能排M层。A原子核外电子排布为 2 , 4 , A是碳原子B原子核外电子排布为 2, 8 , 3 B是铝原子深入探讨 原子半径受哪些因素制约?为什么随原子序数
的递增,原子半径出现从大到小的周期性变化? 影响原
子半径
大小的
因素①电子层数:电子层数越多,原子半径越大②核电荷数:核电荷数增多,使原子半径有减小的趋向③核外电子数: 电子数增多,增加了相互排斥,使原子
最主要因素 当电子层数相同时,核电荷数的影响较大。半径有增大的倾向。 下列化合物中,阳离子与阴离子半径比最小的是
( )(A) NaF (B) LiI (C) CsF (D) LiF阳离子半径:Li+ < Na+ F- 试比较 O2- F- Na+ Mg2+ Al3+ 的半径大小核电荷数 8 9 11 12 13电子层数 2 2 2 2 2 ABCD电子总数 10 10 10 10 10>>>> 电子排布相同的离子,离子
半径随着核电荷数的递增而减小。 请您总结:
元素周期律考 点1、根据元素原子结构的特点和在周期表中的位置关系,确定形成化合物的形式.
2、根据原子的电子层结构特点,确定元素的性质(原子序数、原子半径、最外层电子数、最高化合价等).
3、根据同周期、同主族元素性质的递变规律,对未知物质的结构与性质进行预测.一. 3种微粒 1)比较微粒 质量 相对质量 电性 意义
质子 1.6726×10-27kg 1.007 一个单位正电荷 决定元素的种类
中子 1.6743 ×10-27kg 1.008 不带电、中性 决定同位素和质量数
电子 9.1095×10-27kg 1/1836 一个单位负电荷 价电子决定元素化性原子核原子质子:Z 个
中子:A-Z 个
核外电子:Z个3)两个关系式
原子序数=核电荷数=质子数=原子核外电子数 (阴、阳离子=?)
质量数(A)=质子数(Z)+中子数(N) 1.原子的种类决定于原子的( )
A.原子量大小 B.最外层电子数
C.核电荷数 D.核内质子数和中子数DB3.某元素原子的最外层电子数为次外层电子数的3倍,则该元素原子核内质子数是( )
A.8 B.10 C.6 D.7A4. 有A和B两种原子,A原子的M层比B元素原子的M层少3个电子,B元素原子的L层电子数恰好是A元素原子L层电子数的2倍,A、B两元素分别是( )
A. C和Cl B. C和Al
C. Si 和Na D. Na 和He B二、比较微粒大小的依据(三看)
1、看电子层数:
电子层数越多半径越大 Na>Na+
2、看核电荷数:
电子层数相同时,核电荷数越大半径越小
S2->Cl->Ar>K+>Ca2+; O2->F->Ne>Na+>Mg2+>Al3+
3、看电子数:
电子层和核电荷数都相同时,电子数越多半径越大 Cl->Cl;Fe2+>Fe3+下列化合物中阳离子与阴离子半径比最小的是( )
A. NaF B. MgI2
C.BaI2 D.KBrB (阳离子小阴离子大)6. A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则A B C三种离子半径大小的顺序是 ( )
A. A>B>C B. B>A>C
C. C>A>B D. C>B>AB三. 元素周期律概念: 元素的性质(原子半径、主要化合价)随着原子序数的递增而呈周期性的变化
规律:原子半径同周期从左到右渐小,同族从上到下渐大。
主要化合价:+1 +2 +3 +4 +5 +6 +7 0 -4 -3 -2 -1
原因:核外电子排布随着原子序数的递增而呈周期性的变化 (1~8) 四、元素周期表的结构
1、周期表格要牢记,变化体现周期律,七主七副七周期,VIII族零族镧锕系元素周期表编排原则1.按原子序数递增的顺序从左到右排列
2.将电子层数相同元素排成一个横行
3.把最外电子数相同的元素排成一个纵行构造周期:表中的每一横行。短(1.2.3)长(4.5.6)不完全(7)
族: 7主 (长短周期元素)、7副(仅有长周期元素)、 零(稀有气体)、VIII(8.9.10三纵行)
镧锕系:为紧凑周期表而列在外。要求能画简易 周期表(主族和前四周期)
18纵7横,I~VIII; I~0。高A低 B。
记忆:1)原子序数:记两头推中间
2)每周期所含元素(2. 8. 8. 18. 18. 32. 23)
3)稀有气体结构(内推本周期IIIA~VIIA,外推下周期 IA IIA)原子结构
变化规律同周期电子层数=周期序数
最外层电子数从左到右 1~7(8)同主族电子层数从上到下依次增大
最外层电子数=族序数=价电子数=最高正价数2、原子结构与元素周期表的关系五、同主族、同周期元素性质递变规律内容 同周期(从左到右) 同主族(从上到下)
电子层数 相同(等于周期序数) 逐渐增加
最外电子数 逐渐增加(1~8) 相同(等于族序数)
最高正价 +1~~+7 等于族序数
原子半径 逐渐减小 逐渐增大
离子半径 阴阳离子半径均渐小 阴阳离子半径均渐大
得电子能力(氧化性) 逐渐增强 逐渐减弱
失电子能力(还原性) 逐渐减弱 逐渐增强
金属性 逐渐减弱 逐渐增强
非金属性 逐渐增强 逐渐减弱
最高价氧化物水化物酸碱性 碱性渐弱酸性渐强 碱性渐强酸性渐弱
气态氢化物稳定性 逐渐增强 逐渐减弱特殊知识点找元素之最最活泼金属 、最活泼非金属
最轻的金属 、最轻的非金属
最高熔沸点是 、最低熔沸点是
最稳定的气态氢化物 ,含H%最大的是
最强酸 、最强碱
地壳中含量最多的金属和非金属找半导体:在“折线”附近 Si Ge Ga
找农药: 在磷附近 P As S Cl F
找催化剂、耐高温、耐腐蚀材料:
过渡元素 Fe Ni Pt Pd RhCsF2LiH2CHeHFCH4HClO4CsOHAl O 7.短周期元素M和N的离子M2+和N2-具有相同电子层结构,则下列说法正确的是( )
A.M2+的离子半径比N2-的小
B.M的原子序数比N小
C.M和N原子的电子层数相等
D.M和N原子最外层电子数相等A8.铍的原子序数为4,下列叙述正确的( )
A.铍的原子半径小于硼的原子半径
B.氯化铍分子中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍跟冷水反应产生氢气C比较或推断一些性质比较同族元素的 金属性 Ba>Ca>Mg
非金属性 F>Cl>Br
最高价氧化物的水化物的酸碱性 KOH>NaOH>LiOH
氢化物的稳定性 CH4>SiH4
比较同周期元素及其化合物的性质
碱性: NaOH>Mg(OH)2>Al(OH)3
稳定性: HF>H2O>NH3
比较不同周期元素的性质(先找出与其同周期元素参照)
推断一些未知元素及其化合物的性质
预测88Ra的性质9.随着卤素原子半径的增大,下列递变规律正确的是( )
A.单质的熔沸点逐渐降低
B.卤素离子的还原性逐渐增强
C.气态氢化物稳定性逐渐增强
D.单质氧化性逐渐增强B10.同一周期的三种元素,已知最高价氧化物水化物的酸性强弱:HXO4>H2YO4>H3ZO4,则下列判断不正确的是( )
A.原子半径X>Y>Z
B.非金属性X>Y>Z
C.气态氢化物的稳定性X>Y>Z
D.阴离子的还原性Z >Y > XA1. 在周期表中,第三、四、五、六周其元素的数目分别是( )
A. 8、18、32、32 B.8、18、18、32
C. 8、18、18、18 D. 8、8、18、18 2.下列各组元素的气态氢化物稳定性由弱到强的组是 ( )
A. F、Cl、Br B. N、O、F C. Cl、S、P D.As、P、N 2、元素周期表是一个化学知识宝库,它的内涵是十分丰富的。下列关于目前使用的元素周期表的结构及用途的叙述错误的是 ( )
A、元素周期表有7个周期,分为3个短周期、3个长周期、1个不完全周期
B、元素周期表有18个纵列,分为7个主族、7个副族、1个第Ⅷ族、1个零族
C、分区线左侧是非金属元素,右侧是金属元素,位于分区线附近的元素,既表现金属元素的某些性质,又表现非金属元素的某些性质
D、有“国防金属”美誉的镁位于ⅡA族,与它同一列的元素被称为碱土金属元素 3、以下比较元素原子得失电子能力强弱的方法,不恰当的是 ( )
A、元素的单质与水(或酸)反应置换出氢的反应越容易发生,该元素原子失电子的能力越强
B、元素的单质与氢气化合的反应越容易进行,生成的气态氢化物越不稳定,该元素原子得电子的能力越强
C、元素最高价氧化物对应的水化物的碱性越强,该元素原子失电子的能力越强
D、元素最高价氧化物对应的水化物的酸性越强,该元素原子得电子的能力越强 5、下列说法中,正确的是 ( )
A、K、Mg、C、S四种元素的最高正化合价逐渐升高
B、含有共价键的分子,一定是共价化合物
C、化学反应中能量的变化,都表现为热量的变化
D、原子半径随原子序数的递增而逐渐增大
6、某元素R的原子序数小于18,该元素的1个原子夺取1个电子后形成稀有气体原子电子层结构的离子,该元素可形成含氧酸HRO3。下列说法正确的是 ( )
A、R元素可形成含氧酸HRO4 B、R元素最高正价为+5价
C、R元素原子最外电子层上有7个电子 D、R元素的原子序数为7 练习 现有A和B两种原子,A原子的M层比B原子
的M层少3个电子, B原子的L层电子数恰为A原子的L
层电子数的两倍。则A和B是何种原子?对B原子,M层至少有3个电子,L层必排满 2x = 8 x = 4 2 2 x y y + 3 2x对A原子,L层未排满,不可能排M层。A原子核外电子排布为 2 , 4 , A是碳原子B原子核外电子排布为 2, 8 , 3 B是铝原子深入探讨 原子半径受哪些因素制约?为什么随原子序数
的递增,原子半径出现从大到小的周期性变化? 影响原
子半径
大小的
因素①电子层数:电子层数越多,原子半径越大②核电荷数:核电荷数增多,使原子半径有减小的趋向③核外电子数: 电子数增多,增加了相互排斥,使原子
最主要因素 当电子层数相同时,核电荷数的影响较大。半径有增大的倾向。 下列化合物中,阳离子与阴离子半径比最小的是
( )(A) NaF (B) LiI (C) CsF (D) LiF阳离子半径:Li+ < Na+
半径随着核电荷数的递增而减小。 请您总结:
