元素周期律[下学期]
图片预览



文档简介
课件21张PPT。元 素 周 期 律
第 二 节按核电荷数由小到大的顺序给元素
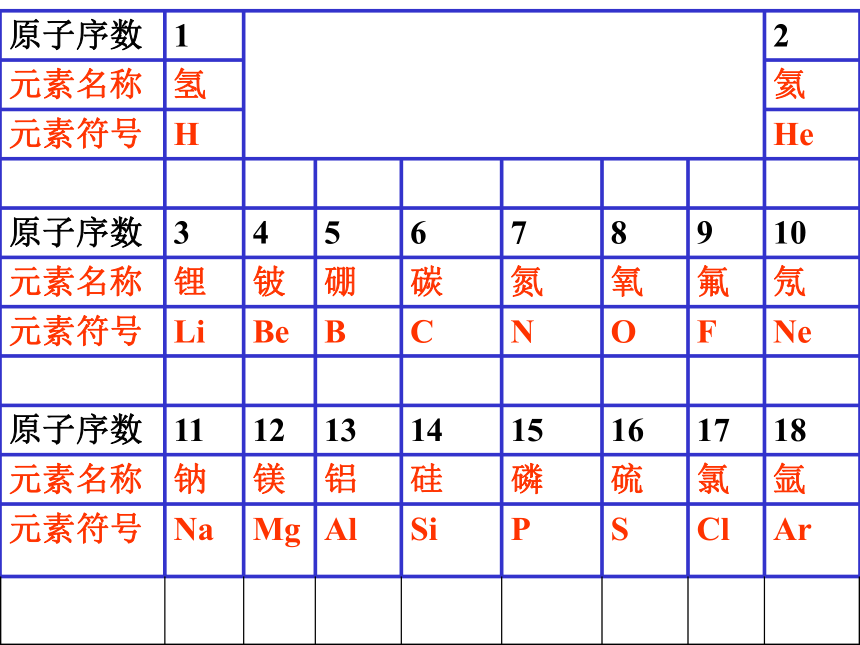
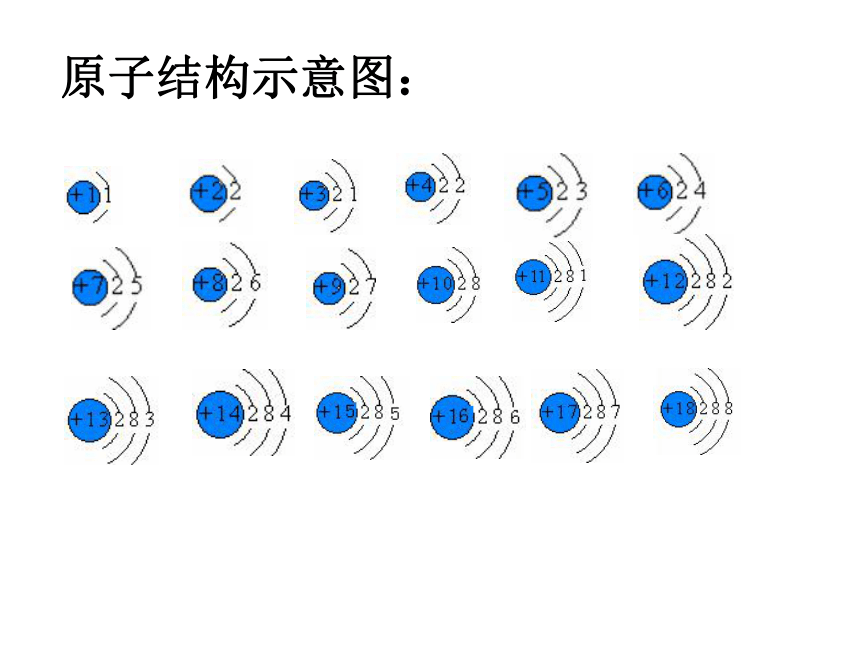
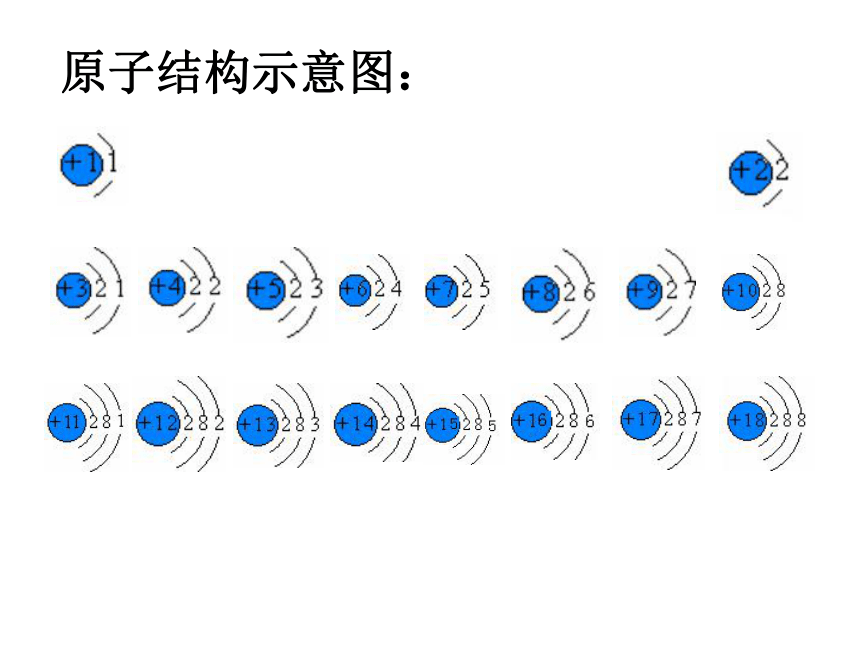
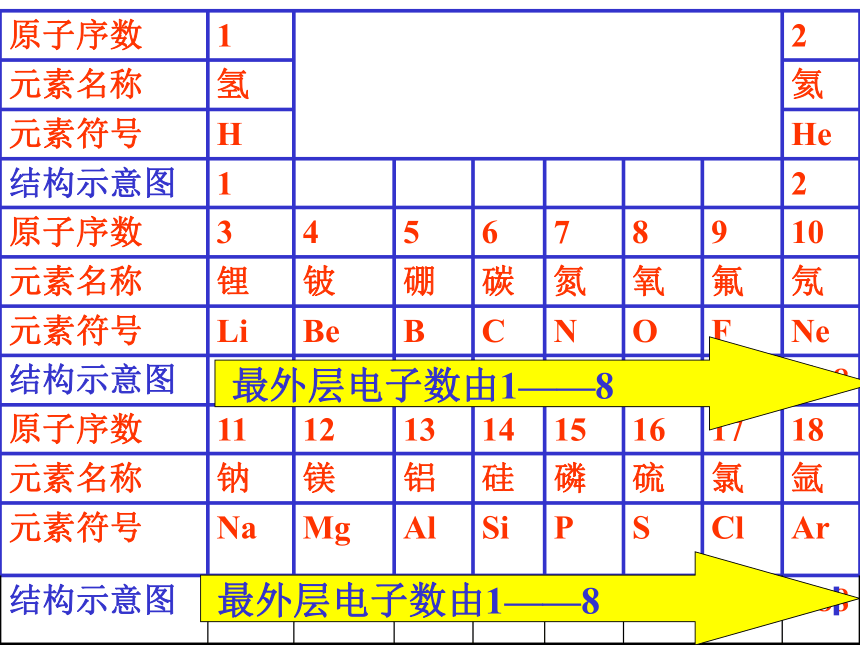
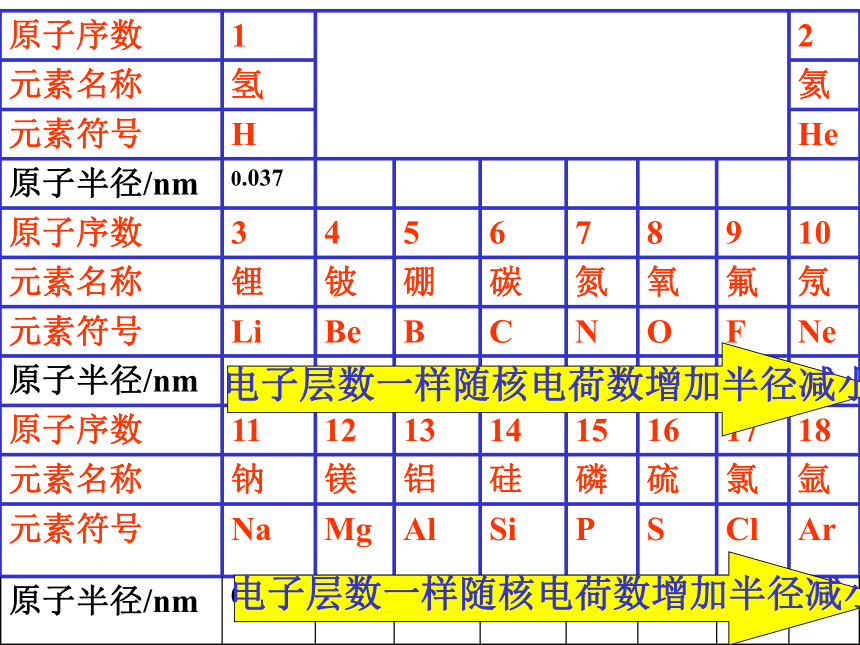
编号,这种编号,叫做原子序数。原子序数 = 核电荷数 = 质子数原子结构示意图:原子结构示意图:结论:
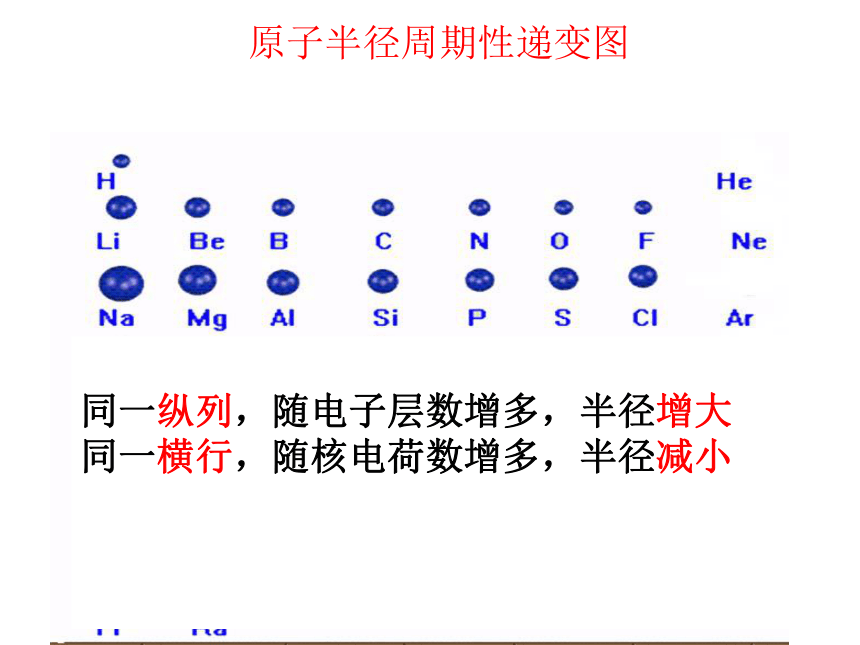
随着原子序数的递增,元素原子的核外电子排布呈现周期性的变化原子半径周期性递变图
同一纵列,随电子层数增多,半径增大
同一横行,随核电荷数增多,半径减小
结论:
随着原子序数的递增,元素原子半径呈现周期性的变化①电子层数:电子层数越多,原子半径
越大②核电荷数:核电荷数越大,使原子半径
有减小的倾向③核外电子数:电子数越多,增加了相互
排斥,使原子半径有增大
的倾向。(主要因素)(当电子层数相同时,核电荷数是
主导因素。)A、金属阳离子半径小于其原子半径:如r Na+rClC、电子层结构相同的微粒,核电荷数越多半径越小: 如 rO2->rF- > r Na+>rMg2+>rAl3+;
rS2-> rCl->rK+>rCa2+2、下列化合物中,阳离子与阴离子半径比最小
的是( )
A、NaF B、LiI C、CsF D、LiFB练习:1、比较下列微粒半径的大小
①Na、Mg、K ②O2_、Na+、Mg2+
③Li+、K+、Cs+3、1~18号元素中,除稀有气体外,原子半径
最大的是( )Na H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar元素化合价周期性递变图1、金属只有正价,非金属既有正价,也有负价最高正价=最外层电子数(O、F除外)2、非金属的负价一般只有一个,数值一般可以从氢化物中判定3、非金属最高正价和负价的绝对值之和为8注意:氟无正价,氧最高正价为+2价(OF2)结论:
随着原子序数的递增,元素化合价呈现周期性的变化练习:1、某元素R的气态氢化物分子式为H2R,
最高价 氧化物中含氧60%,求R的原子量?2、某元素原子L层电子数比K层电子数多5个,
该元素的最高正化合价为 ( )
A、+5 B、+6
C、+7 D、无最高正化合价3、某元素最高正价与负价的代数和为4,则该
元素原子的最外层电子数为 ( )
A、4 B、5 C、6 D、7DCS 32元素周期性变化:
1、核外电子排布周期性变化
2、原子半径的周期性变化
3、元素化合价的周期性变化元素周期性变化的本质???1、核外电子排布周期性变化元素的性质是否也会呈现出周期性的变化呢?巩固练习:
1、下列各组离子半径比较,错误的是
A Cl-<Br-<I- B Al3+>Mg2+>Na+
C Rb>K>Na D P>S>O2、X、Y两元素的阳离子具有相同的电子层结构,
X元素的阳离子半径大于Y元素的阳离子半径,
Z和Y两元素的原子核外电子层数相同,Z元素的
原子半径小于Y元素的原子半径,X、Y、Z三种
元素原子序数的关系是
A X>Y>Z B Y>X>Z
C Z>X>Y D Z>Y>XBD3、1-18号元素中A、B、C 3种元素原子序数递增,原子核外具有不同的电子层数,原子序数之和为21。A、C 、 2种元素化合价相同,B离子和C离子的核外电子排布相同,试回答:
⑴A是————元素,B是————元素,
C是————元素。
⑵A的氧化物的化学式为————;B离子的符号
为————;C原子的结构示意图为————————HNaFH2OF-Na
第 二 节按核电荷数由小到大的顺序给元素
编号,这种编号,叫做原子序数。原子序数 = 核电荷数 = 质子数原子结构示意图:原子结构示意图:结论:
随着原子序数的递增,元素原子的核外电子排布呈现周期性的变化原子半径周期性递变图
同一纵列,随电子层数增多,半径增大
同一横行,随核电荷数增多,半径减小
结论:
随着原子序数的递增,元素原子半径呈现周期性的变化①电子层数:电子层数越多,原子半径
越大②核电荷数:核电荷数越大,使原子半径
有减小的倾向③核外电子数:电子数越多,增加了相互
排斥,使原子半径有增大
的倾向。(主要因素)(当电子层数相同时,核电荷数是
主导因素。)A、金属阳离子半径小于其原子半径:如r Na+
rS2-> rCl->rK+>rCa2+2、下列化合物中,阳离子与阴离子半径比最小
的是( )
A、NaF B、LiI C、CsF D、LiFB练习:1、比较下列微粒半径的大小
①Na、Mg、K ②O2_、Na+、Mg2+
③Li+、K+、Cs+3、1~18号元素中,除稀有气体外,原子半径
最大的是( )Na H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar元素化合价周期性递变图1、金属只有正价,非金属既有正价,也有负价最高正价=最外层电子数(O、F除外)2、非金属的负价一般只有一个,数值一般可以从氢化物中判定3、非金属最高正价和负价的绝对值之和为8注意:氟无正价,氧最高正价为+2价(OF2)结论:
随着原子序数的递增,元素化合价呈现周期性的变化练习:1、某元素R的气态氢化物分子式为H2R,
最高价 氧化物中含氧60%,求R的原子量?2、某元素原子L层电子数比K层电子数多5个,
该元素的最高正化合价为 ( )
A、+5 B、+6
C、+7 D、无最高正化合价3、某元素最高正价与负价的代数和为4,则该
元素原子的最外层电子数为 ( )
A、4 B、5 C、6 D、7DCS 32元素周期性变化:
1、核外电子排布周期性变化
2、原子半径的周期性变化
3、元素化合价的周期性变化元素周期性变化的本质???1、核外电子排布周期性变化元素的性质是否也会呈现出周期性的变化呢?巩固练习:
1、下列各组离子半径比较,错误的是
A Cl-<Br-<I- B Al3+>Mg2+>Na+
C Rb>K>Na D P>S>O2、X、Y两元素的阳离子具有相同的电子层结构,
X元素的阳离子半径大于Y元素的阳离子半径,
Z和Y两元素的原子核外电子层数相同,Z元素的
原子半径小于Y元素的原子半径,X、Y、Z三种
元素原子序数的关系是
A X>Y>Z B Y>X>Z
C Z>X>Y D Z>Y>XBD3、1-18号元素中A、B、C 3种元素原子序数递增,原子核外具有不同的电子层数,原子序数之和为21。A、C 、 2种元素化合价相同,B离子和C离子的核外电子排布相同,试回答:
⑴A是————元素,B是————元素,
C是————元素。
⑵A的氧化物的化学式为————;B离子的符号
为————;C原子的结构示意图为————————HNaFH2OF-Na
