元素周期律[下学期]
图片预览






文档简介
课件16张PPT。元素周期律
1、核外电子排布显周期性变化
2、原子半径的显周期性变化
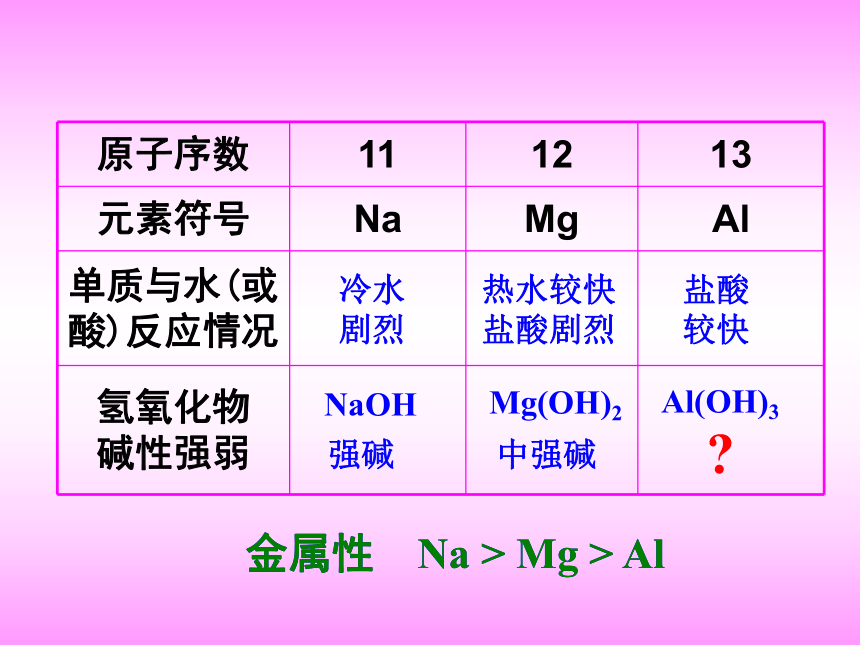
3、元素化合价显周期性变化推论:元素的化学性质主要受最外层电子数及其原子半径影响元素的化学性质也会出现周期性变化4、元素化学性质显周期性变化随原子序数的递增:元素的性质用金属性和非金属性来描述金属性:元素失电子的能力非金属性:元素得电子的能力2.把Na和Cu分别加到水中。谁反应激烈?活泼性NaCu>1.在金属活泼性顺序表中,钠排在Zn的前面.NaZn>NaFe>KNa>3.把Na投入到熔融态FeSO4中,可置换出Fe4.相同浓度的KOH和NaOH,谁碱性强?金属性强弱的判断:1.与水或酸反应的难易程度2.互相之间的置换反应3.根据金属活泼性顺序表4.最高价氧化物的水化物----氢氧化物的碱性强弱金属性 Na > Mg > Al金属性 Na > Mg > Al强碱中强碱 ?两性氢氧化物Al(OH)3 + 3HCl = AlCl3 + 3H2OAl(OH)3 + NaOH = NaAlO2 + 2H2O像Al(OH)3这种既能跟酸反应,又能跟碱反应的氢氧化物,叫作两性氢氧化物。酸碱HAlO2 + NaOH = NaAlO2 + H2O两性氧化物像Al2O3这样,既能与酸反应生成盐和水,又能与碱反应只能生成盐和水的氧化物,叫做两性氧化物。碱酸NaOH 强碱Mg(OH)2中强碱Al(OH)3
金属性 Na > Mg > Al两性氢氧化物?金属4、最高价氧化物的水化物的酸性强弱1、单质与氢气生成气态氢化物的难易程度2、氢化物的稳定性3、活泼的非金属单质能够置换出不活泼的 非金属单质非金属性强弱的判断:高温光照或点燃爆炸化合磷蒸气加热极弱酸 中强酸 强酸 超强酸稀有气体元素金属性逐渐减弱,非金属性逐渐增强练习: 下列递变情况 的是:
A. Na、Mg、Al最外层电子数依次增多,其单
质的还原性依次减弱
B. P、S、Cl最高正价依次升高,对应气态氢化
物稳定性增强
C. C、N、O原子半径依次增大
D. Na、K、Rb氧化物的水化物碱性依次增强不正确 C同一行X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断 的是
A. 阴离子半径 X > Y > Z
B. 气态氢化物稳定性 HX > H2Y > ZH3
C. 元素的非金属性 X > Y > Z
D. 单质的氧化性 X > Y > Z错误 A作 业1.常规训练2.做好复习
1、核外电子排布显周期性变化
2、原子半径的显周期性变化
3、元素化合价显周期性变化推论:元素的化学性质主要受最外层电子数及其原子半径影响元素的化学性质也会出现周期性变化4、元素化学性质显周期性变化随原子序数的递增:元素的性质用金属性和非金属性来描述金属性:元素失电子的能力非金属性:元素得电子的能力2.把Na和Cu分别加到水中。谁反应激烈?活泼性NaCu>1.在金属活泼性顺序表中,钠排在Zn的前面.NaZn>NaFe>KNa>3.把Na投入到熔融态FeSO4中,可置换出Fe4.相同浓度的KOH和NaOH,谁碱性强?金属性强弱的判断:1.与水或酸反应的难易程度2.互相之间的置换反应3.根据金属活泼性顺序表4.最高价氧化物的水化物----氢氧化物的碱性强弱金属性 Na > Mg > Al金属性 Na > Mg > Al强碱中强碱 ?两性氢氧化物Al(OH)3 + 3HCl = AlCl3 + 3H2OAl(OH)3 + NaOH = NaAlO2 + 2H2O像Al(OH)3这种既能跟酸反应,又能跟碱反应的氢氧化物,叫作两性氢氧化物。酸碱HAlO2 + NaOH = NaAlO2 + H2O两性氧化物像Al2O3这样,既能与酸反应生成盐和水,又能与碱反应只能生成盐和水的氧化物,叫做两性氧化物。碱酸NaOH 强碱Mg(OH)2中强碱Al(OH)3
金属性 Na > Mg > Al两性氢氧化物?金属4、最高价氧化物的水化物的酸性强弱1、单质与氢气生成气态氢化物的难易程度2、氢化物的稳定性3、活泼的非金属单质能够置换出不活泼的 非金属单质非金属性强弱的判断:高温光照或点燃爆炸化合磷蒸气加热极弱酸 中强酸 强酸 超强酸稀有气体元素金属性逐渐减弱,非金属性逐渐增强练习: 下列递变情况 的是:
A. Na、Mg、Al最外层电子数依次增多,其单
质的还原性依次减弱
B. P、S、Cl最高正价依次升高,对应气态氢化
物稳定性增强
C. C、N、O原子半径依次增大
D. Na、K、Rb氧化物的水化物碱性依次增强不正确 C同一行X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断 的是
A. 阴离子半径 X > Y > Z
B. 气态氢化物稳定性 HX > H2Y > ZH3
C. 元素的非金属性 X > Y > Z
D. 单质的氧化性 X > Y > Z错误 A作 业1.常规训练2.做好复习
