元素周期表[下学期]
图片预览








文档简介
课件21张PPT。第五章 物质结构 元素周期律
第一节 元素周期表第一课时1.原子序数:?排列原则 :人们按核电荷数由小到大的顺序给元素编号,这种序号叫做原子序数.?原子序数与组成原子的各种微粒间的关系:核电荷数=核内质子数=核外电子数=原子序数2.元素周期表的编排原则把具有相同电子层数的元素按照原子序数递增的顺序排列成一个横行;
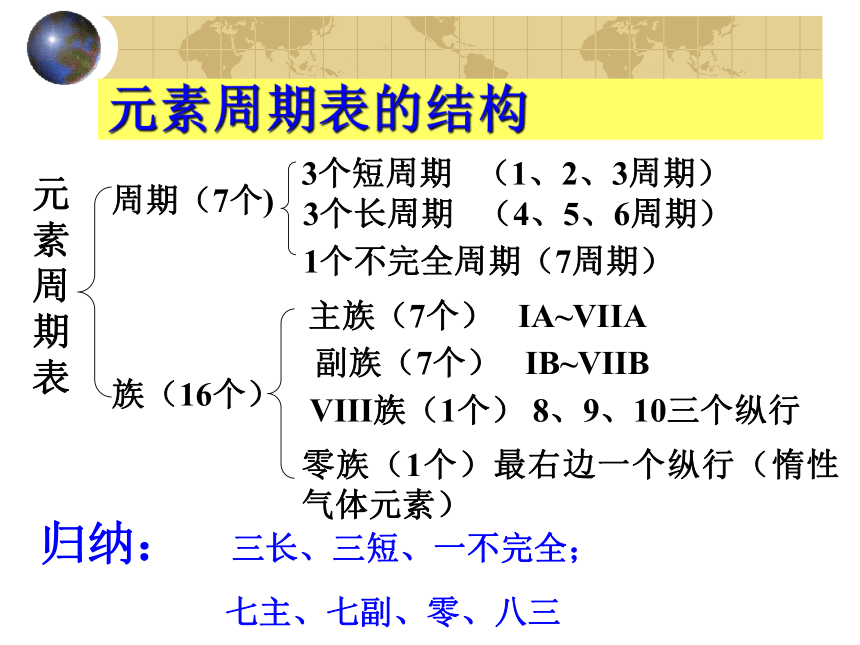
把最外层电子数相同的元素按照核电荷数递增的顺序排成一个纵行.元素周期表的结构 3个短周期 (1、2、3周期) 3个长周期 (4、5、6周期) 周期(7个) 族(16个) 元素周期表 主族(7个) IA~VIIA
1个不完全周期(7周期) 副族(7个) IB~VIIB VIII族(1个) 8、9、10三个纵行 零族(1个)最右边一个纵行(惰性气体元素) 归纳: 三长、三短、一不完全;
七主、七副、零、八三周期的特点同周期元素的原子结构的特点:原子半径:原子序数:电子层数:最外层电子数:相同,且等于周期序数;从左到右由1个递增到8个;不同,从左到右依次增多;不同,从左到右依次减小。每周期元素的种数分别是:2;8;8;18;18;32;……1、定义:2、表示方法:3、原子结构特点:它们是由短周期和长周期元素共同构成的族所构成的。在族序数数字后加A表示。族序数的表示:用罗马数字(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ)
表示族序数;表示符号:原子半径:不同,从上到下依次增大。电子层数:不同,且从上到下电子层数依次增多;核电荷数:不同,从上到下依次增大;最外层电子数:相同,且主族序数等于最外层电子数;主族例题分析:<<指导书>>P2例1,例2,例3;P3第9题作业:<<指导书>>第一课时书面作业:教材P11:第四题
二.元素的性质与原子结构1.碱金属元素:
科学探究化学性质:4Li+O2==Li2O
2Na+O2==Na2O2
2K+2H2O==2KOH+H2加热加热↑2.卤族元素:原子结构示意图原子结构示意图 氟 氯 溴 碘 F Cl Br I 9 17 35 531.331.140.990.71原子半径
(10-10米)5432电子层数7777最外层电子数原子结构示意图卤素原子的半径比较:
光
500℃
光500℃卤素单质与氢气的反应 一、元素周期律 (1)定义:_________________随着原子_________________________的规律叫做元素周期律。元素的性质原子序数的递增而呈现周期性的变化原子核外电子排布的周期性变化元素的原子核外电子排布的周期性变化原子半径的周期性变化元素主要化合价的周期性变化
(2)内容:元素性质周期性变化主要体现在______、______、 ____________________等的周期性变化方面。(3)实质:元素性质周期性变化是由于__________________________周期性变化的必然结果。 例1:下列各组元素性质递变情况错误的是
A.Li、B、Be原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
例2 :某元素的气态氢化物化学式为H2R,此元素最
高价氧化物对应水化物的化学式可能为
A.H2RO3 B.H2RO4 C.HRO3 D.H3RO4
例题1:周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1∶2。写出这些化合物的化学式 。 例题2:已知A为ⅡA族元素,B为ⅢA族元素,它们的原子序数分别为m和n,且A、B为同一周期元素。下列关系式错误的是
A.n = m+1 B.n = m + 11
C.n = m + 25 D.n = m + 10 【知识总结】 各周期元素的种类及稀有气体的原子序数 181832321018365486118 例题1:
X、Y两元素处于同一主族相邻周期,则X、Y两元素的原子序数相差不可能为下列哪一数值
A.2 B.8 C.10 D.18
例题2:第114号元素是化学家和物理学家很感兴趣的尚未发现的元素,试推测此元素在周期表中的位置
A.第八周期ⅢA族 B.第六周期ⅤA族 C.第七周期ⅣB族 D.第七周期ⅣA族 谢谢保持快乐的心境,抬起自信的头颅,珍惜每一寸光阴。学习目标:知道原子序数的含义、明确原子序数与构成原子的粒子之间的关系.
明确元素周期表的结构.
把最外层电子数相同的元素按照核电荷数递增的顺序排成一个纵行.元素周期表的结构 3个短周期 (1、2、3周期) 3个长周期 (4、5、6周期) 周期(7个) 族(16个) 元素周期表 主族(7个) IA~VIIA
1个不完全周期(7周期) 副族(7个) IB~VIIB VIII族(1个) 8、9、10三个纵行 零族(1个)最右边一个纵行(惰性气体元素) 归纳: 三长、三短、一不完全;
七主、七副、零、八三周期的特点同周期元素的原子结构的特点:原子半径:原子序数:电子层数:最外层电子数:相同,且等于周期序数;从左到右由1个递增到8个;不同,从左到右依次增多;不同,从左到右依次减小。每周期元素的种数分别是:2;8;8;18;18;32;……1、定义:2、表示方法:3、原子结构特点:它们是由短周期和长周期元素共同构成的族所构成的。在族序数数字后加A表示。族序数的表示:用罗马数字(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ)
表示族序数;表示符号:原子半径:不同,从上到下依次增大。电子层数:不同,且从上到下电子层数依次增多;核电荷数:不同,从上到下依次增大;最外层电子数:相同,且主族序数等于最外层电子数;主族例题分析:<<指导书>>P2例1,例2,例3;P3第9题作业:<<指导书>>第一课时书面作业:教材P11:第四题
二.元素的性质与原子结构1.碱金属元素:
科学探究化学性质:4Li+O2==Li2O
2Na+O2==Na2O2
2K+2H2O==2KOH+H2加热加热↑2.卤族元素:原子结构示意图原子结构示意图 氟 氯 溴 碘 F Cl Br I 9 17 35 531.331.140.990.71原子半径
(10-10米)5432电子层数7777最外层电子数原子结构示意图卤素原子的半径比较:
光
500℃
光500℃卤素单质与氢气的反应 一、元素周期律 (1)定义:_________________随着原子_________________________的规律叫做元素周期律。元素的性质原子序数的递增而呈现周期性的变化原子核外电子排布的周期性变化元素的原子核外电子排布的周期性变化原子半径的周期性变化元素主要化合价的周期性变化
(2)内容:元素性质周期性变化主要体现在______、______、 ____________________等的周期性变化方面。(3)实质:元素性质周期性变化是由于__________________________周期性变化的必然结果。 例1:下列各组元素性质递变情况错误的是
A.Li、B、Be原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
例2 :某元素的气态氢化物化学式为H2R,此元素最
高价氧化物对应水化物的化学式可能为
A.H2RO3 B.H2RO4 C.HRO3 D.H3RO4
例题1:周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1∶2。写出这些化合物的化学式 。 例题2:已知A为ⅡA族元素,B为ⅢA族元素,它们的原子序数分别为m和n,且A、B为同一周期元素。下列关系式错误的是
A.n = m+1 B.n = m + 11
C.n = m + 25 D.n = m + 10 【知识总结】 各周期元素的种类及稀有气体的原子序数 181832321018365486118 例题1:
X、Y两元素处于同一主族相邻周期,则X、Y两元素的原子序数相差不可能为下列哪一数值
A.2 B.8 C.10 D.18
例题2:第114号元素是化学家和物理学家很感兴趣的尚未发现的元素,试推测此元素在周期表中的位置
A.第八周期ⅢA族 B.第六周期ⅤA族 C.第七周期ⅣB族 D.第七周期ⅣA族 谢谢保持快乐的心境,抬起自信的头颅,珍惜每一寸光阴。学习目标:知道原子序数的含义、明确原子序数与构成原子的粒子之间的关系.
明确元素周期表的结构.
