元素周期律[下学期]
图片预览








文档简介
课件31张PPT。元素周期律1870年门捷列夫预言了31号元素镓,门捷列夫把它称作亚铝,指出:“亚铝是一种容易挥发的物质,将来一定有人利用光谱分析发现它”
1875年法国人布瓦德朗果然用光谱分析法发现新元素,并命名为镓。除比重有差异外,一切都应验了。
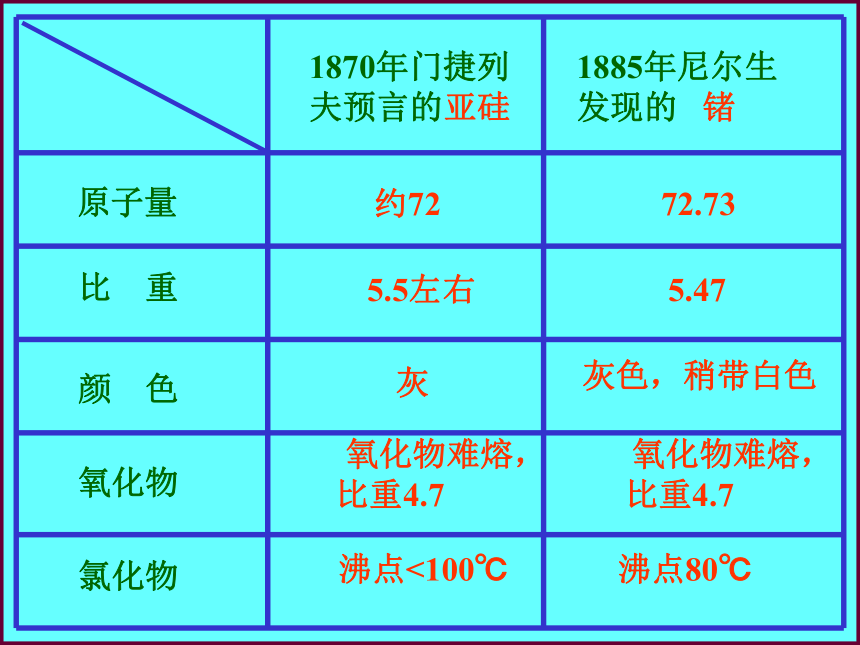
门捷列夫写信给巴黎科学院,“ 镓就是
我预言的亚铝,它的原子量接近68,比
重应该是5.9上下,不是4.7,请再试验
一下,也许您那块物质还不纯……”
布瓦德朗重新测定镓的比重,果然
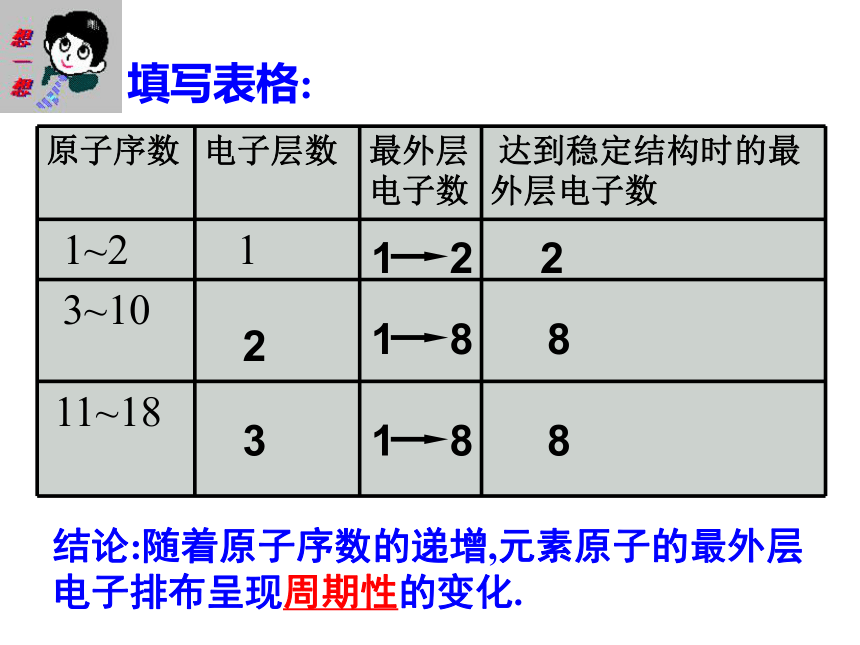
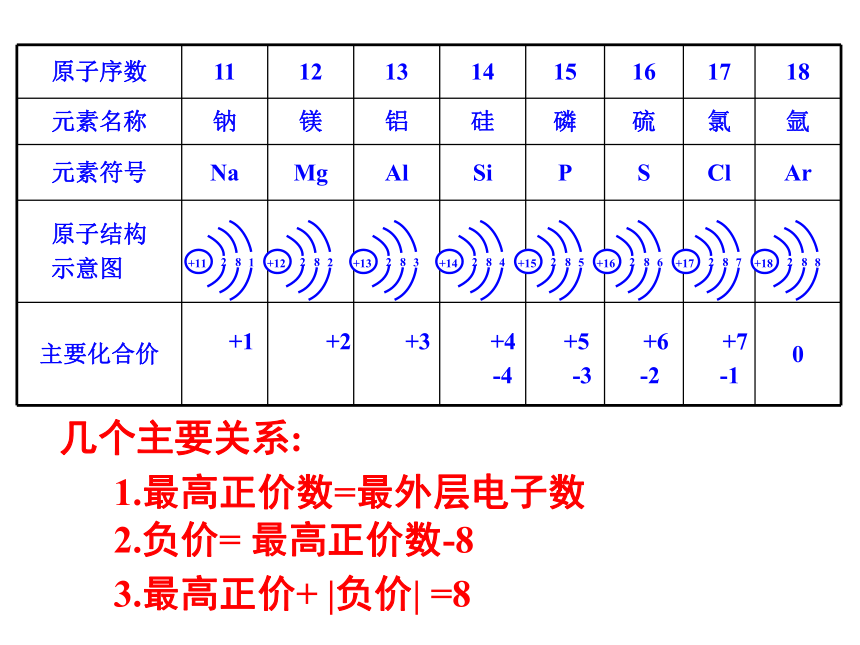
是5.9。 约72 72.73 5.5左右 5.47 灰 灰色,稍带白色 氧化物难熔,比重4.7 氧化物难熔,比重4.7沸点<100℃沸点80℃ 核电荷数为1-18元素的原子结构示意图讨论:随着原子序数的递增,原子的核外电子排布呈现什么规律?练习:填写表5-6相关内容23828填写表格:结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性的变化.+1 +2 +3 +4 +5 +6 +7-4 -3 -2 -1几个主要关系:1.最高正价数=最外层电子数2.负价= 最高正价数-83.最高正价+ |负价| =8主要化合价主要化合价主要化合价1~18号元素 0 +1 +2 +3 +4 +5 +6 +7 0
-4 -3 -2 -1 [练习]填写表5-8相关内容结论:随着原子序数的递增,元素化合价呈现周期性的变化原因:元素主要化合价的周期性变化,是
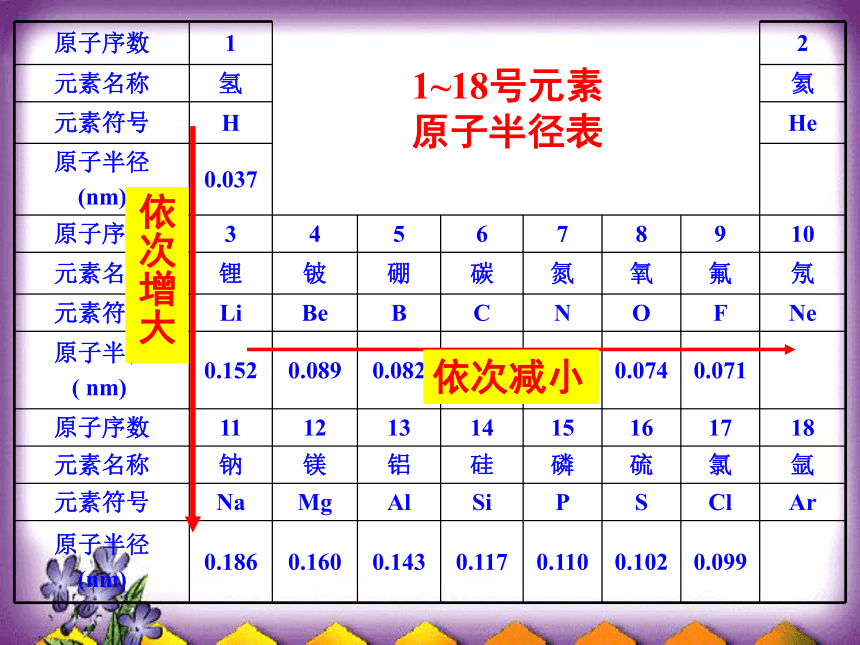
原子核外电子排布呈周期性变化的结果。1~18号元素原子半径表2.具有相同电子层的原子为什么核电荷数越大,其原子的半径越小?讨论:1. 原子的半径有哪些影响因素?3.具有相同最外层电子数的原子为什么核电荷数越大,其原子的半径越大?4. 原子发生电子得失后,其原子的半径如何变化?1.决定原子半径大小的因素电子层数核对电子的吸引作用电子间的排斥作用原因:原子半径的周期性变化,是核外电子排布周期性变化的结果讨论:比较Na原子与Mg原子的原子半径大小半径:Na > Mg讨论:比较Na原子与Li原子的原子半径大小答案: 半径:Na > Li讨论:比较Na与Na+的半径大小 答案:半径 Na > Na+讨论:比较Cl-与Cl的半径大小答案:半径 Cl- > Cl比较Fe、Fe2+与Fe3+的半径大小思考:答案:半径 Fe > Fe2+ > Fe3+讨论:1. 比较Na+与Mg2+半径大小答案:半径 Na+ > Mg2+讨论:2. 比较O2-与F-半径大小答案:半径 O2- > F-写出下列微粒的半径由大到小的顺序:
F-、O2-、Na+、Mg2+练习:答案:半径: O2- > F- > Na+ > Mg2+归纳总结:1.相同电子层的原子,随着原子序数的递增,原子半径减小;
2.最外层电子数相同的原子,随着原子序数的递增,原子半径增大;
3.原子失电子以后,半径变小;原子得电子以后,半径变大;
4.相同电子层结构的不同微粒,核电荷数越大,半径越小.练习:1、写出碱金属元素、卤素的最高价氧化物和对应水化物的化学式(用R表示元素符号)2、写出C、N、S、Cl的气态氢化物的化学式R2O ------ ROHR2O7 ---- HRO4CH4 --- NH3 --- H2S --- HCl本节小结:随着原子序数的递增,元素性质呈周期性的变化。元素周期律的实质元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。一句话概括:思考题:某元素的气态氢化物的符合通式RH4,
且氢的质量分数为25%则R的最高价氧化物
的化学式是 ( )
A. CO B. CO2 C. MgO D. SO2B2. 比较下列微粒的半径大小
Cl- 、 S2- 、 Na+ 、Mg2+ 、F-答案:半径 S2- > Cl- > F- >Na+ >Mg2+3.下列各组元素中,按最高正价递增顺序排列的是( )。
A.F、Cl、Br、I
B.K、Mg、C、S
C.C、N、O、F
D.Li、Na、K、RbB4.元素性质呈周期性变化的原因是( )。
A.相对原子质量逐渐增大
B.核电荷数逐渐增大
C.核外电子排布呈周期性变化
D.元素的化合价呈周期性变化C5.元素R的最高价含氧酸分子式为,则在其最低价气态氢化物中R元素的化合价为( )。
A.3n-10 B.3n-6
C.3n-12 D.3n-4C6.下列化合物中阳离子半径与阴离子半径比值最小的是( )。
A.NaF B.MgI2C.NaID.KBrB1、X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径;Z和Y两元素的原子核外电子层次相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z
三种元素原子序数的关系是(??? )
(A)X>Y>Z?????????? (B)Y>X>Z
(C)Z>X>Y?????????? (D)Z>Y>X2、A、B、C、D四种元素,它们最外层电子数依次为
1、2、3、7,它们的原子序数按A、B、C、D递增,
A和B的次外层电子数是2,C和D的次外层电子数是8,
试判断:A、B、C、D各为何种元素,写出它们的
元素符号。练习:(答案:ALi,BBe,CAl,DCl )D课后思考 根据原子最外层电子排布的周期性,将原子序数为1~18的元素排列成表格。
1875年法国人布瓦德朗果然用光谱分析法发现新元素,并命名为镓。除比重有差异外,一切都应验了。
门捷列夫写信给巴黎科学院,“ 镓就是
我预言的亚铝,它的原子量接近68,比
重应该是5.9上下,不是4.7,请再试验
一下,也许您那块物质还不纯……”
布瓦德朗重新测定镓的比重,果然
是5.9。 约72 72.73 5.5左右 5.47 灰 灰色,稍带白色 氧化物难熔,比重4.7 氧化物难熔,比重4.7沸点<100℃沸点80℃ 核电荷数为1-18元素的原子结构示意图讨论:随着原子序数的递增,原子的核外电子排布呈现什么规律?练习:填写表5-6相关内容23828填写表格:结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性的变化.+1 +2 +3 +4 +5 +6 +7-4 -3 -2 -1几个主要关系:1.最高正价数=最外层电子数2.负价= 最高正价数-83.最高正价+ |负价| =8主要化合价主要化合价主要化合价1~18号元素 0 +1 +2 +3 +4 +5 +6 +7 0
-4 -3 -2 -1 [练习]填写表5-8相关内容结论:随着原子序数的递增,元素化合价呈现周期性的变化原因:元素主要化合价的周期性变化,是
原子核外电子排布呈周期性变化的结果。1~18号元素原子半径表2.具有相同电子层的原子为什么核电荷数越大,其原子的半径越小?讨论:1. 原子的半径有哪些影响因素?3.具有相同最外层电子数的原子为什么核电荷数越大,其原子的半径越大?4. 原子发生电子得失后,其原子的半径如何变化?1.决定原子半径大小的因素电子层数核对电子的吸引作用电子间的排斥作用原因:原子半径的周期性变化,是核外电子排布周期性变化的结果讨论:比较Na原子与Mg原子的原子半径大小半径:Na > Mg讨论:比较Na原子与Li原子的原子半径大小答案: 半径:Na > Li讨论:比较Na与Na+的半径大小 答案:半径 Na > Na+讨论:比较Cl-与Cl的半径大小答案:半径 Cl- > Cl比较Fe、Fe2+与Fe3+的半径大小思考:答案:半径 Fe > Fe2+ > Fe3+讨论:1. 比较Na+与Mg2+半径大小答案:半径 Na+ > Mg2+讨论:2. 比较O2-与F-半径大小答案:半径 O2- > F-写出下列微粒的半径由大到小的顺序:
F-、O2-、Na+、Mg2+练习:答案:半径: O2- > F- > Na+ > Mg2+归纳总结:1.相同电子层的原子,随着原子序数的递增,原子半径减小;
2.最外层电子数相同的原子,随着原子序数的递增,原子半径增大;
3.原子失电子以后,半径变小;原子得电子以后,半径变大;
4.相同电子层结构的不同微粒,核电荷数越大,半径越小.练习:1、写出碱金属元素、卤素的最高价氧化物和对应水化物的化学式(用R表示元素符号)2、写出C、N、S、Cl的气态氢化物的化学式R2O ------ ROHR2O7 ---- HRO4CH4 --- NH3 --- H2S --- HCl本节小结:随着原子序数的递增,元素性质呈周期性的变化。元素周期律的实质元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。一句话概括:思考题:某元素的气态氢化物的符合通式RH4,
且氢的质量分数为25%则R的最高价氧化物
的化学式是 ( )
A. CO B. CO2 C. MgO D. SO2B2. 比较下列微粒的半径大小
Cl- 、 S2- 、 Na+ 、Mg2+ 、F-答案:半径 S2- > Cl- > F- >Na+ >Mg2+3.下列各组元素中,按最高正价递增顺序排列的是( )。
A.F、Cl、Br、I
B.K、Mg、C、S
C.C、N、O、F
D.Li、Na、K、RbB4.元素性质呈周期性变化的原因是( )。
A.相对原子质量逐渐增大
B.核电荷数逐渐增大
C.核外电子排布呈周期性变化
D.元素的化合价呈周期性变化C5.元素R的最高价含氧酸分子式为,则在其最低价气态氢化物中R元素的化合价为( )。
A.3n-10 B.3n-6
C.3n-12 D.3n-4C6.下列化合物中阳离子半径与阴离子半径比值最小的是( )。
A.NaF B.MgI2C.NaID.KBrB1、X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径;Z和Y两元素的原子核外电子层次相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z
三种元素原子序数的关系是(??? )
(A)X>Y>Z?????????? (B)Y>X>Z
(C)Z>X>Y?????????? (D)Z>Y>X2、A、B、C、D四种元素,它们最外层电子数依次为
1、2、3、7,它们的原子序数按A、B、C、D递增,
A和B的次外层电子数是2,C和D的次外层电子数是8,
试判断:A、B、C、D各为何种元素,写出它们的
元素符号。练习:(答案:ALi,BBe,CAl,DCl )D课后思考 根据原子最外层电子排布的周期性,将原子序数为1~18的元素排列成表格。
