元素周期律[下学期]
图片预览






文档简介
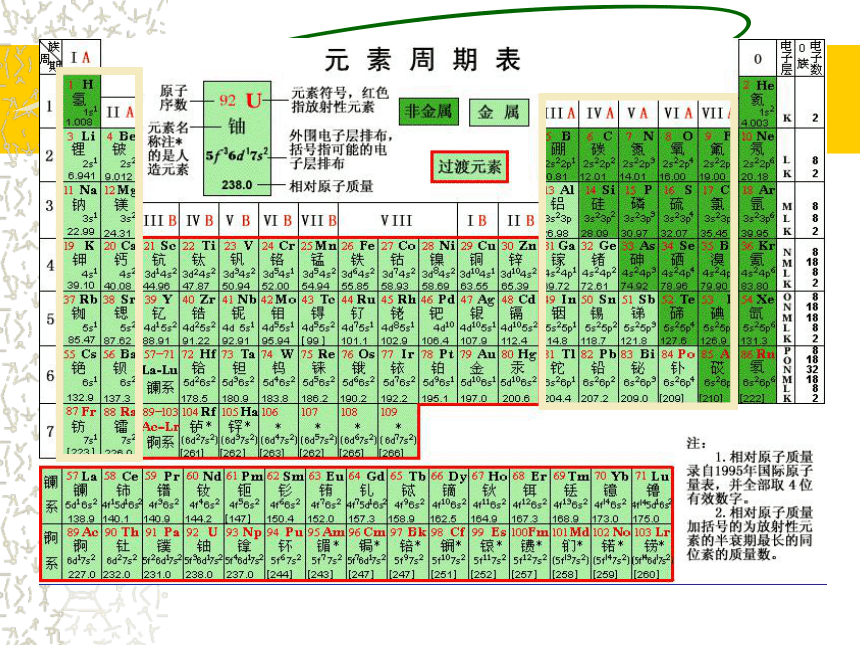
课件50张PPT。1、元素周期表阅读课文回答:现在周期表编排的依据是什么?1、根据原子的核电荷数由小到大对元素进行排序。原子序数=核电荷数=质子数=核外电子数2、把电子层数目相同的元素,按原子序数递增的顺序从 左到右排成横行。
3、最外层电子数相同的元素按电子层数递增的顺序由上到下排列。 观察周期表的结构,有多少横行,多少纵行?
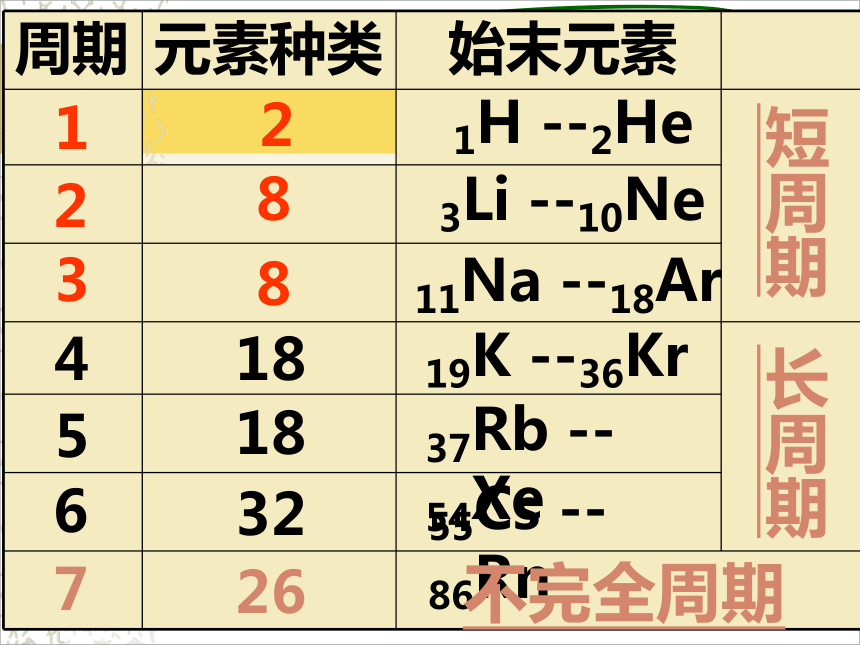
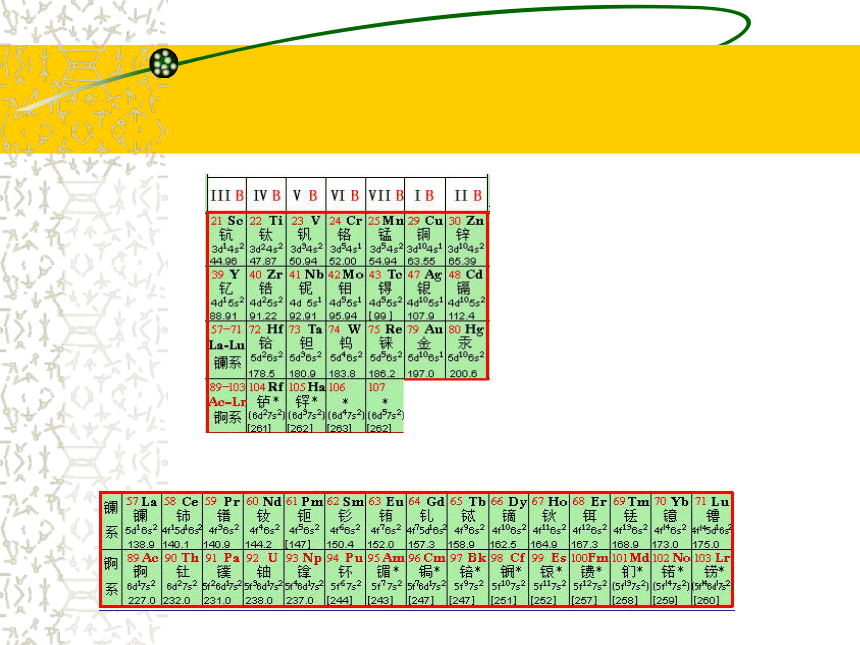
什么叫周期?什么叫族?一、元素周期表的结构:1、周期:具有相同电子层数而又
按照原子序数递增顺序
由左往右排列的一系列
元素。周期数 = 电子层数周期元素种类始末元素121H --2He283Li --10Ne11Na --18Ar83短周期41818325619K --36Kr37Rb --54Xe55Cs --86Rn长周期726不完全周期2、族:①主族:(7个)
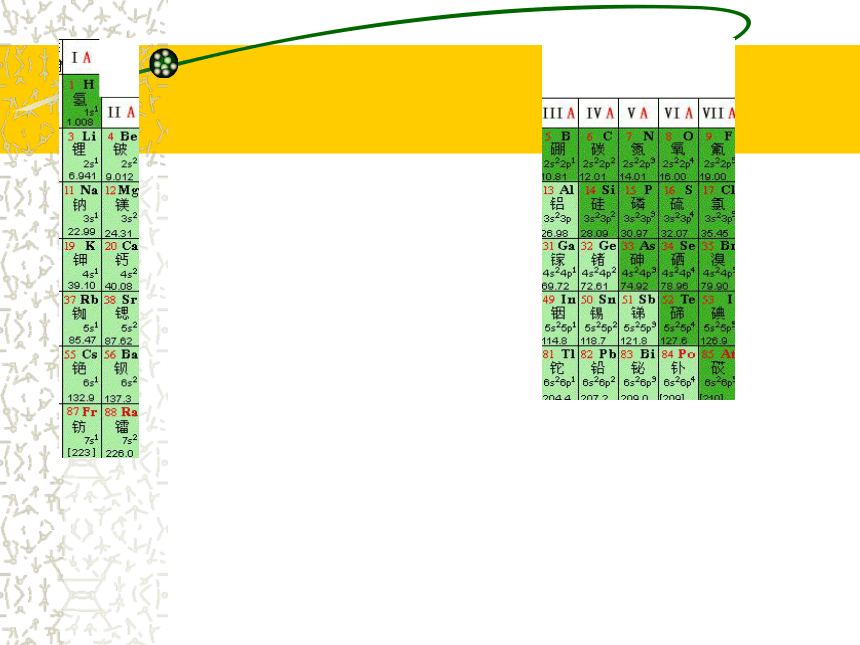
18个纵行,16个族 1-2纵行 13-17纵行:
依次为 ⅠA ⅡA ⅢA ⅣA ⅤA
ⅥA ⅦA
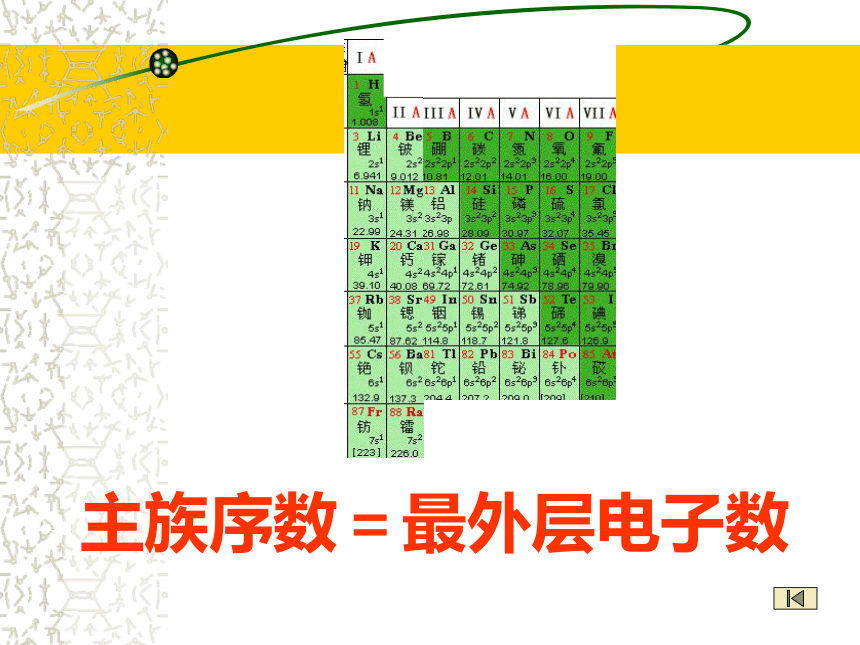
主族序数=最外层电子数②副族:(7个) 3 - 7纵行 11 - 12纵行:
依次为 ⅢB ⅣB ⅤB ⅥB ⅦB
ⅠB ⅡB
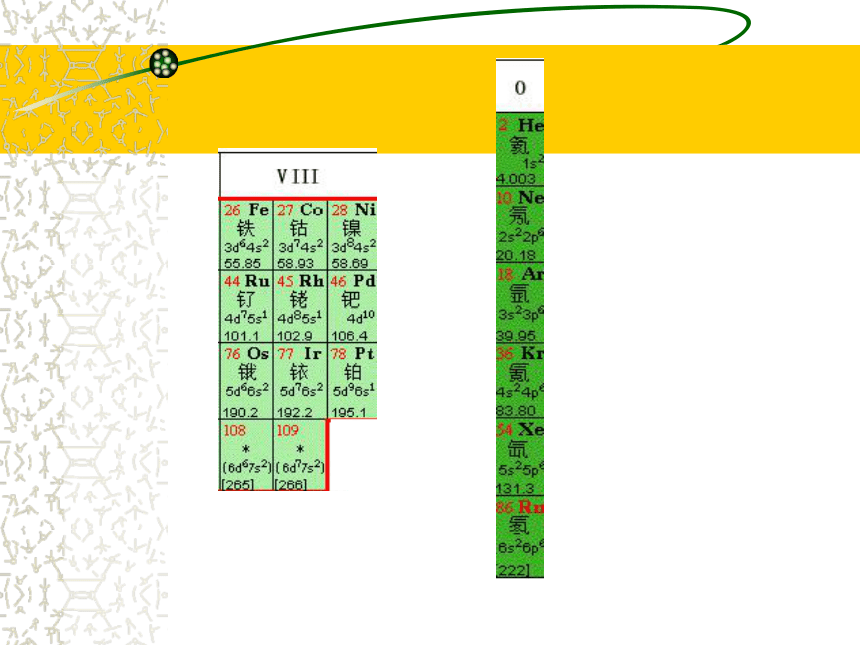
④ 0族:即稀有气体。(1个)18纵行③第Ⅷ族:(1个)8、9、10三个纵行指出金、银、铜、铁、锌、钛在周期表的位置 X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的核内质子数之和为31,而且依次递增
则X、Y、Z是
A.Mg、Al、Si
B.Li、Be、Mg
C.N、O、S D.P、S、OC<基础训练>P2 例3二、元素的性质与原子结构1、碱金属元素:锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)
请同学回忆钠的化学性质,并由此推测钾化学性质。
请你设计一个实验方案来证明你的推测是否正确?相似性:1、均能与氧气剧烈反应
2、均能与水反应生成碱和氢气2Na+2H2O==2NaOH+H22K+2H2O==2KOH+H2差异性:钾与氧气反应比钠与氧气反应剧烈、钾与水反应比钠与水反应剧烈。 从原子结构角度分析钠、钾在化学性质上的相似性与递变规律。 并从原子结构角度分析推导锂、铷、铯化学性质。(超氧化钾)最外层电子数都是1都能与氧气等非金属反应;都能与水反应生成碱和氢气。核电核数电子层数原子半径原子核对外层电子的引力失电子能力元素的金属性单质的还原性与氧气反应剧烈程度与水反应剧烈程度 递变规律:
锂(Li)钠(Na)钾(K)铷(Rb)铯(Cs) 逐渐增大逐渐增多逐渐增大逐渐减弱逐渐增强逐渐增强逐渐增强逐渐增强逐渐增强碱金属的化学性质?
五、从钠、钾的对比中,你认为锂、钠、钾、铷、铯有哪些共同的物理性质?在物理性质上有怎样的递变规律?银白色,铯略带金色光泽都比较柔软,有延展性较小,其中锂、钠、钾的密度比水的小很强随电荷数增加,密度增大,钾反常随电荷数增加,熔点降低随电荷数增加,沸点降低七、练习:
1、下列碱金属中不能放在煤油中保存的是………( )
A.Li B. Na C. K D. Rb
2、下列关于钾、钠、铷、铯的叙述不正确的是…( )
A. 和H2O反应最剧烈的是Cs
B. 氧化能力最强的是钠原子
C. 原子半径随核电荷数的增大而增大
D. 单质的密度均小于1g.cm-3AD3、对碱金属单质叙述不正确的是……………………( )
A. 在空气燃烧生成的都是过氧化物
B. 都能与水反应生成碱和氢气
C. 熔、沸点随核电荷数的增加而降低
D. 还原性随原子电子层数的增加而增强
4、下列关于铷的叙述中,不正确的是………………( )
A.金属铷投入水中会引起爆炸
B.铷是一种强还原剂,铷离子很稳定
C. 铷受热后,能在空气中燃烧,生成比过氧化物更
复杂的氧化物
D. 铷原子的核电荷数的比钾原子的核电荷数多,因
此铷原子失去电子的能力小于钾原子AD一、卤素的原子结构** 不同点:
原子的最外层均为7个电子,易得到1个电子1.核电荷数依次增多;3.原子半径依次增大
* 共同点:2.电子层数递增;2、卤族元素F Cl Br I原子半径
原子得电子能力
单质氧化性
元素非金属性增大减弱减弱减弱基础训练P7卤素单质的物理性质状 态气 体气 体液 体固 体失电子能力逐渐增强金属性增强得电子能力逐渐减弱非金属性增强同主族元素,从上到下,失电子能力逐渐增强,得电子能力逐渐减弱,元素金属性逐渐增强,非金属性逐渐减弱。Z 个N=(A-Z)个Z 个质量数 将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。 质量数(A)= 质子数(Z)+ 中子数(N)1、决定粒子是否为同一种元素的是( )
A、粒子内所具有的质量数 B、原子核内的质子数
C、原子或单核离子的质量数 D、原子核外的电子数
2、决定不同的粒子是否为同位素是( )
A、原子或单核离子的质量数
B、原子或单核离子的中子数
C、核素的化学性质 D、原子核内的质子数和中子数3、用A、质子数 B、中子数 C、核外电子数 D、最外层电子数
E、电子层数
(1)、同位素种类由 决定;
(2)、元素种类由 决定;
(3)、某元素有无同位素由 决定;
(4)、核素相对原子质量由 决定;
(5)、核电荷数由 决定
(6)、原子得失能力相对强弱由 决定;BDABABABAE作业:根据1~18号元素完成
1、以元素的原子序数为横坐标,原子的最外层电子数为纵坐标,绘出直方图.
2 、以元素的原子序数为横坐标,元素的最高价和最低价为纵坐标,用不同颜色的笔绘出折线图多电子原子核外排布规律:
1、按能量由低到高排布
2 、最外层不超过8个(第一层为2个),次外层不超过18个,倒数三层不超过32个
3 、每个电子层最多容纳2n2元素的最高最低化合价随原子序数的变化规律主族元素最高正化合价=主族序数=最外层电子数=价电子数
(不适用于副族�族Ⅷ族)最高正化合价+?最低负化合价?=8等于使原子达到8电子稳定结构所需得到的电子数1、写出下列元素的最高价氧化物及水化物
S P N Na Mg
2 、写出下列各元素的氢化物并标明它们的化合价
O S Cl C F N对于非金属元素形成的氢化物中,它们的化合价一般等于最低负化合价1、金属性强弱的判断依据:金属单质与水反应快慢 金属单质与酸反应快慢 最高价氧化物的水化物的碱性强弱 <基础训练>P1镁带与水反应:
加热沸腾后,镁带表面有小气泡生成,且镁带表面有红色出现
Mg+2H2O==Mg(OH)2+H2(中强碱)2、非金属性强弱判断依据: 非金属 单质与氢气反应的难易 气态氢化物的稳定性强弱 最高化氧化物的水化物的酸性强弱 微观性质— 原子半径、化合价宏观性质— 金属性、非金属性元素原子结构:原子序数最外层电子数元素周期律 (一)原子结构知识
一、??原子结构和构成粒子数量间的关系
1、原子(AzX)中,质子有 个,中子有 个,核外电子有 个。
2、相互关系
(1)??质量数=
(2)??原子中:质子数=
(3)??离子中:质子数=
ZA-ZZ质子数+中子数核电荷数=核外电子数核电荷数=离子的核外
电子数+离子电荷数 二、核外电子排布的一般规律
归纳为:一低四不超。
即核外电子总是尽先排布在 的电子层里,每层电子不能超过 个,最外层电子不能超过 个,次外层电子不能超过 个,倒数第三层电子不能超
过 个。 能最最低2n2 8 1832五、粒子半径大小比较的规律1、同种元素的粒子半径比较(三个方面)
a阳离子的半径 相应的原子半径
b阴离子的半径 相应的原子半径
c 同种元素不同价态的离子 ,价态越高,
离子半径越 。小于大于小2、不同元素的粒子半径比较(三个方面)
A、电子层数相同,原子序数不同,原子序数越
大,原子半径越 。
B、最外层电子数相同,则电子层数越多,原子
半径越 ,
C、电子层结构相同的不同粒子,则核电荷数越
大,半径越 。 小大小周期表原子半径示意图二、元素周期表中元素性质递变规律 大→小小→ 大电子层数相同、最外层电子增多逐渐减小
逐渐增大逐渐增大
逐渐减小金属性减、非金属性增金属性增、非金属性减最高正价+1→+7最高正价=主族序数 碱性逐渐减弱
酸性逐渐增强碱性逐渐增强
酸性逐渐减弱形成:难→易
稳定性:弱→强 形成:易→难
稳定性:强→弱电子层增多最外层电子数相同总结:非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强稀有气体元素二、金属性、非金属性和氧化性、还原性的 关系
一般说来,元素的金属性强,元素的失电子能力 ,单质的还原性 ,其阳离子的氧化性 ,如钠和镁。 元素的非金属性强,元素的原子得电子能力 ,单质的氧化性 ,其阴离子的还原性 。如硫和氯。 强强弱强强弱推测具有下列结构的主族元素在周期表的位置:第四周期
第ⅡA族第六周期
第ⅠA族写出它们最高价氧化物对应的水化物并比较酸性或碱性的强弱 “位、构、性”的关系 结构位置性质周期 族判断元素推出位置通过位置运用递变规律 硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se) 的保健品已经进入市场, 已知它与氧元素同族, 与 K 同周期, 关于硒的说法中不正确的是:( )
A.?? 原子序数为 34????????????????
B. 最高价氧化物的水化物的分子式为: H2SeO4
C.???Se 的非金属性比 Br 弱????????
D.??气态氢化物的稳定性比硫化氢气体强D三、元素周期表与原子结构的关系
周期序数= 。
主族序数= = =价电
子数
主族元素的最低负化合价=8— 。
电子层数 最外层电子数 最高正化价 主族序数
3、最外层电子数相同的元素按电子层数递增的顺序由上到下排列。 观察周期表的结构,有多少横行,多少纵行?
什么叫周期?什么叫族?一、元素周期表的结构:1、周期:具有相同电子层数而又
按照原子序数递增顺序
由左往右排列的一系列
元素。周期数 = 电子层数周期元素种类始末元素121H --2He283Li --10Ne11Na --18Ar83短周期41818325619K --36Kr37Rb --54Xe55Cs --86Rn长周期726不完全周期2、族:①主族:(7个)
18个纵行,16个族 1-2纵行 13-17纵行:
依次为 ⅠA ⅡA ⅢA ⅣA ⅤA
ⅥA ⅦA
主族序数=最外层电子数②副族:(7个) 3 - 7纵行 11 - 12纵行:
依次为 ⅢB ⅣB ⅤB ⅥB ⅦB
ⅠB ⅡB
④ 0族:即稀有气体。(1个)18纵行③第Ⅷ族:(1个)8、9、10三个纵行指出金、银、铜、铁、锌、钛在周期表的位置 X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的核内质子数之和为31,而且依次递增
则X、Y、Z是
A.Mg、Al、Si
B.Li、Be、Mg
C.N、O、S D.P、S、OC<基础训练>P2 例3二、元素的性质与原子结构1、碱金属元素:锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)
请同学回忆钠的化学性质,并由此推测钾化学性质。
请你设计一个实验方案来证明你的推测是否正确?相似性:1、均能与氧气剧烈反应
2、均能与水反应生成碱和氢气2Na+2H2O==2NaOH+H22K+2H2O==2KOH+H2差异性:钾与氧气反应比钠与氧气反应剧烈、钾与水反应比钠与水反应剧烈。 从原子结构角度分析钠、钾在化学性质上的相似性与递变规律。 并从原子结构角度分析推导锂、铷、铯化学性质。(超氧化钾)最外层电子数都是1都能与氧气等非金属反应;都能与水反应生成碱和氢气。核电核数电子层数原子半径原子核对外层电子的引力失电子能力元素的金属性单质的还原性与氧气反应剧烈程度与水反应剧烈程度 递变规律:
锂(Li)钠(Na)钾(K)铷(Rb)铯(Cs) 逐渐增大逐渐增多逐渐增大逐渐减弱逐渐增强逐渐增强逐渐增强逐渐增强逐渐增强碱金属的化学性质?
五、从钠、钾的对比中,你认为锂、钠、钾、铷、铯有哪些共同的物理性质?在物理性质上有怎样的递变规律?银白色,铯略带金色光泽都比较柔软,有延展性较小,其中锂、钠、钾的密度比水的小很强随电荷数增加,密度增大,钾反常随电荷数增加,熔点降低随电荷数增加,沸点降低七、练习:
1、下列碱金属中不能放在煤油中保存的是………( )
A.Li B. Na C. K D. Rb
2、下列关于钾、钠、铷、铯的叙述不正确的是…( )
A. 和H2O反应最剧烈的是Cs
B. 氧化能力最强的是钠原子
C. 原子半径随核电荷数的增大而增大
D. 单质的密度均小于1g.cm-3AD3、对碱金属单质叙述不正确的是……………………( )
A. 在空气燃烧生成的都是过氧化物
B. 都能与水反应生成碱和氢气
C. 熔、沸点随核电荷数的增加而降低
D. 还原性随原子电子层数的增加而增强
4、下列关于铷的叙述中,不正确的是………………( )
A.金属铷投入水中会引起爆炸
B.铷是一种强还原剂,铷离子很稳定
C. 铷受热后,能在空气中燃烧,生成比过氧化物更
复杂的氧化物
D. 铷原子的核电荷数的比钾原子的核电荷数多,因
此铷原子失去电子的能力小于钾原子AD一、卤素的原子结构** 不同点:
原子的最外层均为7个电子,易得到1个电子1.核电荷数依次增多;3.原子半径依次增大
* 共同点:2.电子层数递增;2、卤族元素F Cl Br I原子半径
原子得电子能力
单质氧化性
元素非金属性增大减弱减弱减弱基础训练P7卤素单质的物理性质状 态气 体气 体液 体固 体失电子能力逐渐增强金属性增强得电子能力逐渐减弱非金属性增强同主族元素,从上到下,失电子能力逐渐增强,得电子能力逐渐减弱,元素金属性逐渐增强,非金属性逐渐减弱。Z 个N=(A-Z)个Z 个质量数 将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。 质量数(A)= 质子数(Z)+ 中子数(N)1、决定粒子是否为同一种元素的是( )
A、粒子内所具有的质量数 B、原子核内的质子数
C、原子或单核离子的质量数 D、原子核外的电子数
2、决定不同的粒子是否为同位素是( )
A、原子或单核离子的质量数
B、原子或单核离子的中子数
C、核素的化学性质 D、原子核内的质子数和中子数3、用A、质子数 B、中子数 C、核外电子数 D、最外层电子数
E、电子层数
(1)、同位素种类由 决定;
(2)、元素种类由 决定;
(3)、某元素有无同位素由 决定;
(4)、核素相对原子质量由 决定;
(5)、核电荷数由 决定
(6)、原子得失能力相对强弱由 决定;BDABABABAE作业:根据1~18号元素完成
1、以元素的原子序数为横坐标,原子的最外层电子数为纵坐标,绘出直方图.
2 、以元素的原子序数为横坐标,元素的最高价和最低价为纵坐标,用不同颜色的笔绘出折线图多电子原子核外排布规律:
1、按能量由低到高排布
2 、最外层不超过8个(第一层为2个),次外层不超过18个,倒数三层不超过32个
3 、每个电子层最多容纳2n2元素的最高最低化合价随原子序数的变化规律主族元素最高正化合价=主族序数=最外层电子数=价电子数
(不适用于副族�族Ⅷ族)最高正化合价+?最低负化合价?=8等于使原子达到8电子稳定结构所需得到的电子数1、写出下列元素的最高价氧化物及水化物
S P N Na Mg
2 、写出下列各元素的氢化物并标明它们的化合价
O S Cl C F N对于非金属元素形成的氢化物中,它们的化合价一般等于最低负化合价1、金属性强弱的判断依据:金属单质与水反应快慢 金属单质与酸反应快慢 最高价氧化物的水化物的碱性强弱 <基础训练>P1镁带与水反应:
加热沸腾后,镁带表面有小气泡生成,且镁带表面有红色出现
Mg+2H2O==Mg(OH)2+H2(中强碱)2、非金属性强弱判断依据: 非金属 单质与氢气反应的难易 气态氢化物的稳定性强弱 最高化氧化物的水化物的酸性强弱 微观性质— 原子半径、化合价宏观性质— 金属性、非金属性元素原子结构:原子序数最外层电子数元素周期律 (一)原子结构知识
一、??原子结构和构成粒子数量间的关系
1、原子(AzX)中,质子有 个,中子有 个,核外电子有 个。
2、相互关系
(1)??质量数=
(2)??原子中:质子数=
(3)??离子中:质子数=
ZA-ZZ质子数+中子数核电荷数=核外电子数核电荷数=离子的核外
电子数+离子电荷数 二、核外电子排布的一般规律
归纳为:一低四不超。
即核外电子总是尽先排布在 的电子层里,每层电子不能超过 个,最外层电子不能超过 个,次外层电子不能超过 个,倒数第三层电子不能超
过 个。 能最最低2n2 8 1832五、粒子半径大小比较的规律1、同种元素的粒子半径比较(三个方面)
a阳离子的半径 相应的原子半径
b阴离子的半径 相应的原子半径
c 同种元素不同价态的离子 ,价态越高,
离子半径越 。小于大于小2、不同元素的粒子半径比较(三个方面)
A、电子层数相同,原子序数不同,原子序数越
大,原子半径越 。
B、最外层电子数相同,则电子层数越多,原子
半径越 ,
C、电子层结构相同的不同粒子,则核电荷数越
大,半径越 。 小大小周期表原子半径示意图二、元素周期表中元素性质递变规律 大→小小→ 大电子层数相同、最外层电子增多逐渐减小
逐渐增大逐渐增大
逐渐减小金属性减、非金属性增金属性增、非金属性减最高正价+1→+7最高正价=主族序数 碱性逐渐减弱
酸性逐渐增强碱性逐渐增强
酸性逐渐减弱形成:难→易
稳定性:弱→强 形成:易→难
稳定性:强→弱电子层增多最外层电子数相同总结:非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强稀有气体元素二、金属性、非金属性和氧化性、还原性的 关系
一般说来,元素的金属性强,元素的失电子能力 ,单质的还原性 ,其阳离子的氧化性 ,如钠和镁。 元素的非金属性强,元素的原子得电子能力 ,单质的氧化性 ,其阴离子的还原性 。如硫和氯。 强强弱强强弱推测具有下列结构的主族元素在周期表的位置:第四周期
第ⅡA族第六周期
第ⅠA族写出它们最高价氧化物对应的水化物并比较酸性或碱性的强弱 “位、构、性”的关系 结构位置性质周期 族判断元素推出位置通过位置运用递变规律 硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se) 的保健品已经进入市场, 已知它与氧元素同族, 与 K 同周期, 关于硒的说法中不正确的是:( )
A.?? 原子序数为 34????????????????
B. 最高价氧化物的水化物的分子式为: H2SeO4
C.???Se 的非金属性比 Br 弱????????
D.??气态氢化物的稳定性比硫化氢气体强D三、元素周期表与原子结构的关系
周期序数= 。
主族序数= = =价电
子数
主族元素的最低负化合价=8— 。
电子层数 最外层电子数 最高正化价 主族序数
