元素周期表[下学期]
图片预览





文档简介
课件12张PPT。一、元素周期表阅读课文第一、二自然段,思考以下问题:1、门捷列夫是按照什么原则来排列元素的?
2、现代周期表编排的依据是什么?
3、哪种编排更科学?1、门捷列夫对元素排列的原则是元素的相
对原子质量。2、现代编排的依据是核电荷数。一、元素周期表Na22.99
11观察下面钠原子的示意图,思考各数字表示的含义:原子序数与元素的原子结构之间存在的关系:原子序数=核电荷数=质子数=核外电子数原子序数:按照元素在周期表中的顺序给元素编号;表示元素在周期表中的位置。一、元素周期表请同学们认真分析、研究周期表,思考以下问题:1、周期表有多少横行,多少纵行?
2、横行与纵行各有什么特点?
3、每横行,每纵行所含元素种类是否相同? 1、周期表有七个横行,十八个纵行。2、每一横行的元素的电子层数相同,从左到右元素的
原子序数递增;
每一纵横的元素的最外层电子数相同,从上到下元
素的原子序数递增。3、有的相同,有的不相同。一、元素周期表阅读课本思考:什么是周期?什么是族?A、B、0的
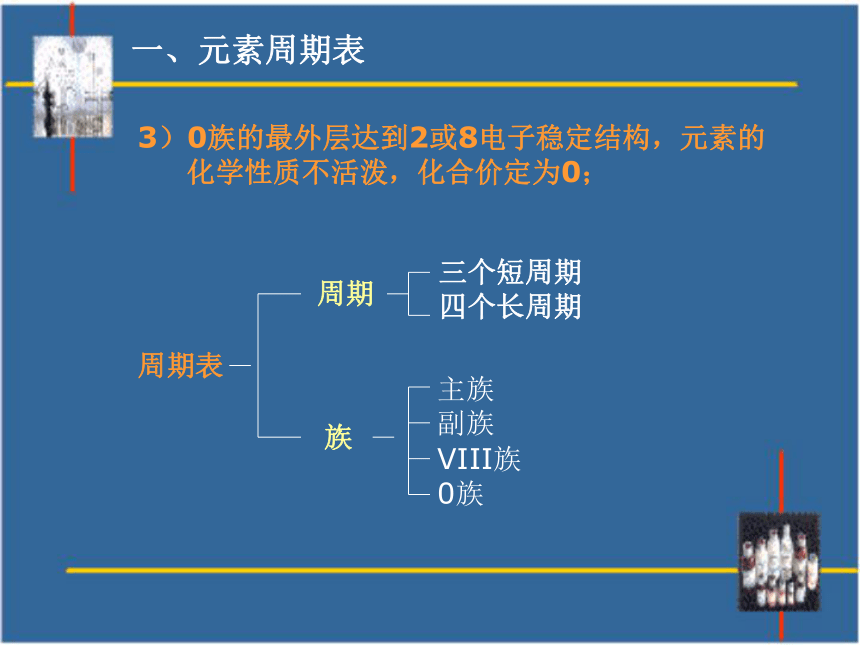
含义是什么?1、周期表的七个横行叫周期。特点:1)每一周期的电子层数相同;2)从左到右原子序数递增;3)周期的序数就是该周期元素所具有的电
子层数。2、周期表的十八个纵行叫族。特点:1)有主族,副族,0族,VIII族;2)每一主族,或副族的最外层电子数相同;
主族或副族的族序数等于该族的最外层电子数。周期表周期族三个短周期
四个长周期主族
副族
VIII族
0族3)0族的最外层达到2或8电子稳定结构,元素的
化学性质不活泼,化合价定为0;一、元素周期表一、元素周期表[练习]1、国际无机化学命名委员会在1989年作出决定,把
长式周期表原先的主、副族及族号取消:从左至右
改为第1~18列,碱金属族为第1列,稀有气体为
第18列。按照这个规定下列说法不正确的是( )A.第15列元素的最高价氧化物R2O5
B.第2列元素中肯定没有非金属元素
C.第17列元素的第一种元素无含氧酸
D.第16、17列元素都是非金属元素D一、元素周期表2、有人认为在元素周期表中,位于IA族的氢元素,
也可以放在 VIIA族,下列物质能支持这种观点
的是( ) HF B. H3O
C. NaH D. H2O2+C二、元素的性质与原子结构(碱金属元素) 完成课本P5科学探究中的表格,由此可以得出什么
结论?1、核电荷数由Li~Cs逐渐增多;
2、最外层电子数都为1;
3、电子层数从2层增加到6层。[实验]Na、K与O2反应易燃烧,火焰
呈黄色易燃烧,透过蓝色钴玻璃
观察火焰呈紫色Na、K都易与O2反应,K 先燃烧二、元素的性质与原子结构(碱金属元素)Na、K与H2O反应(1)钠浮在水面上
(2)熔化成银白色小球
(3)在水面四处游动
(4)溶液呈红色(1)熔化成银白色小球
(2)在水面四处游动
(3)溶液呈红色
(4)有较微爆炸2Na+2H2O==
2NaOH+H22K+2H2O==
2KOH+H2Na、K都易与H2O反应,但K比Na反应更剧烈二、元素的性质与原子结构(碱金属元素)元素金属性强弱判断的依据:1、根据金属单质与水或酸反应置换出氢的难易程度。
置换出氢越容易,则金属性越强。2、根据金属元素最高价氧化物对应水化物碱性强弱。
碱性越强,则原金属元素的金属性越强。3、可以根据对应阳离子氧化性强弱判断。金属阳离
子氧化性越弱,则元素金属性越强二、元素的性质与原子结构(碱金属元素)[练习]1、周期表中16号元素和4号元素的原子相比较,
前者的下列数据是后者4倍的是( ) 电子数 B. 最外层电子数
C. 电子层数 D. 次外层电子数AD2、填写下面空白:(1)写出表示含有8个质子、10个中子的原子的
化学符号_____。(2)周期表中位于第8纵行的铁元素属于第______族。(3)周期表中最活泼的非金属元素位于第______纵行。(4)所含元素超过18种的周期是第____、____周期。O18
8VIII17六 七
2、现代周期表编排的依据是什么?
3、哪种编排更科学?1、门捷列夫对元素排列的原则是元素的相
对原子质量。2、现代编排的依据是核电荷数。一、元素周期表Na22.99
11观察下面钠原子的示意图,思考各数字表示的含义:原子序数与元素的原子结构之间存在的关系:原子序数=核电荷数=质子数=核外电子数原子序数:按照元素在周期表中的顺序给元素编号;表示元素在周期表中的位置。一、元素周期表请同学们认真分析、研究周期表,思考以下问题:1、周期表有多少横行,多少纵行?
2、横行与纵行各有什么特点?
3、每横行,每纵行所含元素种类是否相同? 1、周期表有七个横行,十八个纵行。2、每一横行的元素的电子层数相同,从左到右元素的
原子序数递增;
每一纵横的元素的最外层电子数相同,从上到下元
素的原子序数递增。3、有的相同,有的不相同。一、元素周期表阅读课本思考:什么是周期?什么是族?A、B、0的
含义是什么?1、周期表的七个横行叫周期。特点:1)每一周期的电子层数相同;2)从左到右原子序数递增;3)周期的序数就是该周期元素所具有的电
子层数。2、周期表的十八个纵行叫族。特点:1)有主族,副族,0族,VIII族;2)每一主族,或副族的最外层电子数相同;
主族或副族的族序数等于该族的最外层电子数。周期表周期族三个短周期
四个长周期主族
副族
VIII族
0族3)0族的最外层达到2或8电子稳定结构,元素的
化学性质不活泼,化合价定为0;一、元素周期表一、元素周期表[练习]1、国际无机化学命名委员会在1989年作出决定,把
长式周期表原先的主、副族及族号取消:从左至右
改为第1~18列,碱金属族为第1列,稀有气体为
第18列。按照这个规定下列说法不正确的是( )A.第15列元素的最高价氧化物R2O5
B.第2列元素中肯定没有非金属元素
C.第17列元素的第一种元素无含氧酸
D.第16、17列元素都是非金属元素D一、元素周期表2、有人认为在元素周期表中,位于IA族的氢元素,
也可以放在 VIIA族,下列物质能支持这种观点
的是( ) HF B. H3O
C. NaH D. H2O2+C二、元素的性质与原子结构(碱金属元素) 完成课本P5科学探究中的表格,由此可以得出什么
结论?1、核电荷数由Li~Cs逐渐增多;
2、最外层电子数都为1;
3、电子层数从2层增加到6层。[实验]Na、K与O2反应易燃烧,火焰
呈黄色易燃烧,透过蓝色钴玻璃
观察火焰呈紫色Na、K都易与O2反应,K 先燃烧二、元素的性质与原子结构(碱金属元素)Na、K与H2O反应(1)钠浮在水面上
(2)熔化成银白色小球
(3)在水面四处游动
(4)溶液呈红色(1)熔化成银白色小球
(2)在水面四处游动
(3)溶液呈红色
(4)有较微爆炸2Na+2H2O==
2NaOH+H22K+2H2O==
2KOH+H2Na、K都易与H2O反应,但K比Na反应更剧烈二、元素的性质与原子结构(碱金属元素)元素金属性强弱判断的依据:1、根据金属单质与水或酸反应置换出氢的难易程度。
置换出氢越容易,则金属性越强。2、根据金属元素最高价氧化物对应水化物碱性强弱。
碱性越强,则原金属元素的金属性越强。3、可以根据对应阳离子氧化性强弱判断。金属阳离
子氧化性越弱,则元素金属性越强二、元素的性质与原子结构(碱金属元素)[练习]1、周期表中16号元素和4号元素的原子相比较,
前者的下列数据是后者4倍的是( ) 电子数 B. 最外层电子数
C. 电子层数 D. 次外层电子数AD2、填写下面空白:(1)写出表示含有8个质子、10个中子的原子的
化学符号_____。(2)周期表中位于第8纵行的铁元素属于第______族。(3)周期表中最活泼的非金属元素位于第______纵行。(4)所含元素超过18种的周期是第____、____周期。O18
8VIII17六 七
