专题复习:元素周期律[下学期]
文档属性
| 名称 | 专题复习:元素周期律[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 144.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-06-20 00:00:00 | ||
图片预览






文档简介
课件14张PPT。专题复习四元素周期律元素周期律1、原子核外电子排布的周期性变化
2、原子半径的周期性变化
3、元素化合价的周期性变化
4、元素性质的周期性变化本质:原子核外电子排布的周期性变化比较微粒半径大小的规律 ⑴ 同周期元素的原子或离子半径从左到右渐小 ⑵ 同主族元素的原子或离子半径从上到下渐大 ⑷ 同种元素的微粒:阳离子<中性原子<阴离子
价态越高,微粒半径越小。⑶ 核外电子排布相同的离子半径随电荷数的增加而减小 Na >Mg >Al >Si Na+ >Mg2+ >Al3+ Li < Na < K F- < Cl- < Br- O2- > F- > Na+ > Mg2+ > Al3+ (第二周期阴离子)(第三周期阳离子) Fe+3 < Fe2+ < Fe H+ < H < H-化合价变化的规律1) +1→+7的化合价变化仅适用于非金属元素或形成原子团有金属元素,
2)金属阳离子的化合价最高不超过+3价;
3)熟悉常见非金属元素的变价:如N:+1+2+3+4+5 P:+3+5; S:+4+6;C+2+4;Cl:+1+3+5+7等2. 同主族: 最外层电子数= 最高正价数
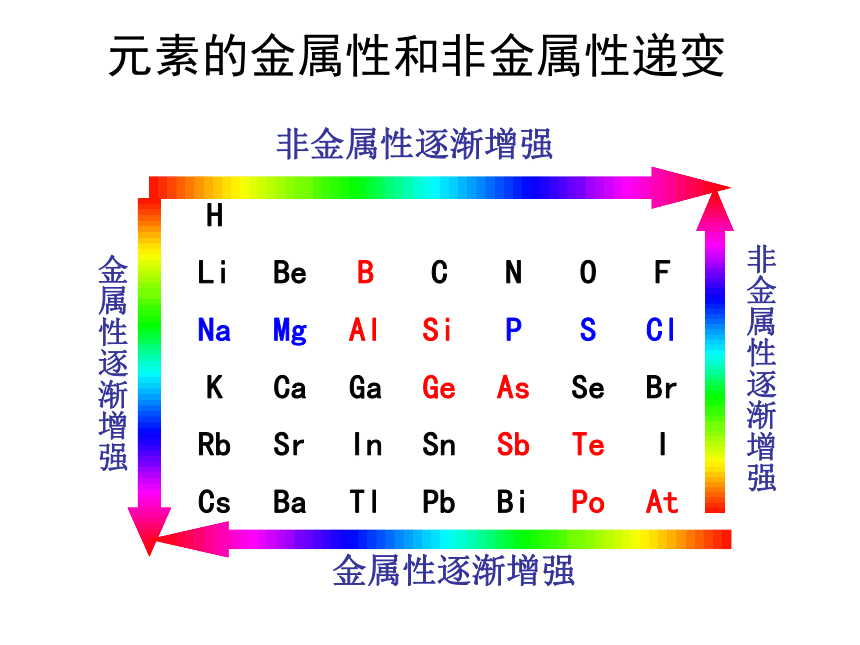
负价= 最高正价-8说明:元素的金属性和非金属性递变非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强1 金属性强弱的判断方法
(1)单质跟水或酸置换出氢的难易程度
(2)M(OH)n的碱性强弱。
(3)金属间的置换反应
(4)其它2 非金属性强弱的判断
(1)单质和氢气化合的难易程度。
(2)HnR的稳定性。
(3)HnROm的酸性强弱(R为最高价)。
(4)非金属单质间的置换。
(5)其它
1. 已知硒和氧同主族,与钾同周期,下列有关硒元素的性质描述错误的是( )
A. 单质硒是一种半导体材料
B. 硒的最高价氧化物的化学式为SeO2
C. 硒的非金属性比溴弱
D. 硒的气态氢化物的化学式为H2Se,它在空气中燃烧时有二氧化硒或单质硒生成常见题型:B2. (04江苏)X,Y是元素周期表VIIA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是( )
A. X原子的电子层数比Y原子的电子层数多
B. X的氢化物的沸点比Y的氢化物的沸点低
C. X的气态氢化物比Y的气态氢化物稳定
D. Y的单质能将X从NaX溶液中置换出来C3. 有关叙述:(1)非金属单质M能从N的化合物中置换出非金属单质N。
2)M原子比N原子容易得到电子。
3)单质M跟H2反应比N跟H2反应容易得多。
4)气态氢化物水溶液的酸性HmM>HnN。
5)氧化物水化物的酸性HmMOx>HnNOy。
6)熔点M>N。
能说明M比N的非金属性强的叙述是 ( )
A.①②③ B. ①②③④?
C.①②③④⑤ D.全部 A4. A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D. D和A形成简单离子后,它们电子层相差两层.已知A处于第n族,D处于第m族,且A单质为双原子分子,B气体氢化物的分子式为H2B,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等.C和A可形成CA3型化合物.C和A、B在同一周期,B与A左右相邻.试回答:
1)若n-m=6,则A、D形成的化合物的化学式为:______
2)D的原子序数为(用含m式子表示)___________
3)C离子的结构示意图为________
4)向B的氢化物溶液中投入A单质,化学方程式____
5)向A的氢化物溶液中投入C单质, 离子方程式____LiCl2+m5. A元素的原子有3个电子层,可形成AO2型氧化物,B元素的原子序数比A元素的原子序数小5,下列说法正确的是( )
A. A,B两元素一定都是非金属元素
B. A的最高价氧化物的水化物一定属于酸
C. A的最高价氧化物在常温下一定都是气体
D. A,B两元素一定都是金属元素B6.A、B、C、D、E、F为原子序数依次增大的同周期主族元素,已知A、C、F三原子的最外层共有10个电子,且这三种元素最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,回答: ①写出下列元素的符号:B?????? 、D???????? 、E????????? ②用电子式写出A、F形成化合物的电子式???????? 。 ③A、C两种元素最高价氧化物的水化物反应的离子方程式????????????????????。 ④D的固态氧化物自然界广泛存在的物质,也是工业上应用常见的原料,试写出它的用途两例:__________.MgSiP7. A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4。1mol A的单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答:
(1)写出A、B、C的元素符号:A ___,B ____, C _______
(2)A元素形成稳定氧化物的化学式为_______,该化合物中含有____________键.
(3)A离子的氧化性比B离子的氧化性_______, 这是由于__________________。NaAlClNa2O2离子键非极性弱钠的还原性比铝强
2、原子半径的周期性变化
3、元素化合价的周期性变化
4、元素性质的周期性变化本质:原子核外电子排布的周期性变化比较微粒半径大小的规律 ⑴ 同周期元素的原子或离子半径从左到右渐小 ⑵ 同主族元素的原子或离子半径从上到下渐大 ⑷ 同种元素的微粒:阳离子<中性原子<阴离子
价态越高,微粒半径越小。⑶ 核外电子排布相同的离子半径随电荷数的增加而减小 Na >Mg >Al >Si Na+ >Mg2+ >Al3+ Li < Na < K F- < Cl- < Br- O2- > F- > Na+ > Mg2+ > Al3+ (第二周期阴离子)(第三周期阳离子) Fe+3 < Fe2+ < Fe H+ < H < H-化合价变化的规律1) +1→+7的化合价变化仅适用于非金属元素或形成原子团有金属元素,
2)金属阳离子的化合价最高不超过+3价;
3)熟悉常见非金属元素的变价:如N:+1+2+3+4+5 P:+3+5; S:+4+6;C+2+4;Cl:+1+3+5+7等2. 同主族: 最外层电子数= 最高正价数
负价= 最高正价-8说明:元素的金属性和非金属性递变非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强1 金属性强弱的判断方法
(1)单质跟水或酸置换出氢的难易程度
(2)M(OH)n的碱性强弱。
(3)金属间的置换反应
(4)其它2 非金属性强弱的判断
(1)单质和氢气化合的难易程度。
(2)HnR的稳定性。
(3)HnROm的酸性强弱(R为最高价)。
(4)非金属单质间的置换。
(5)其它
1. 已知硒和氧同主族,与钾同周期,下列有关硒元素的性质描述错误的是( )
A. 单质硒是一种半导体材料
B. 硒的最高价氧化物的化学式为SeO2
C. 硒的非金属性比溴弱
D. 硒的气态氢化物的化学式为H2Se,它在空气中燃烧时有二氧化硒或单质硒生成常见题型:B2. (04江苏)X,Y是元素周期表VIIA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是( )
A. X原子的电子层数比Y原子的电子层数多
B. X的氢化物的沸点比Y的氢化物的沸点低
C. X的气态氢化物比Y的气态氢化物稳定
D. Y的单质能将X从NaX溶液中置换出来C3. 有关叙述:(1)非金属单质M能从N的化合物中置换出非金属单质N。
2)M原子比N原子容易得到电子。
3)单质M跟H2反应比N跟H2反应容易得多。
4)气态氢化物水溶液的酸性HmM>HnN。
5)氧化物水化物的酸性HmMOx>HnNOy。
6)熔点M>N。
能说明M比N的非金属性强的叙述是 ( )
A.①②③ B. ①②③④?
C.①②③④⑤ D.全部 A4. A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D. D和A形成简单离子后,它们电子层相差两层.已知A处于第n族,D处于第m族,且A单质为双原子分子,B气体氢化物的分子式为H2B,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等.C和A可形成CA3型化合物.C和A、B在同一周期,B与A左右相邻.试回答:
1)若n-m=6,则A、D形成的化合物的化学式为:______
2)D的原子序数为(用含m式子表示)___________
3)C离子的结构示意图为________
4)向B的氢化物溶液中投入A单质,化学方程式____
5)向A的氢化物溶液中投入C单质, 离子方程式____LiCl2+m5. A元素的原子有3个电子层,可形成AO2型氧化物,B元素的原子序数比A元素的原子序数小5,下列说法正确的是( )
A. A,B两元素一定都是非金属元素
B. A的最高价氧化物的水化物一定属于酸
C. A的最高价氧化物在常温下一定都是气体
D. A,B两元素一定都是金属元素B6.A、B、C、D、E、F为原子序数依次增大的同周期主族元素,已知A、C、F三原子的最外层共有10个电子,且这三种元素最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,回答: ①写出下列元素的符号:B?????? 、D???????? 、E????????? ②用电子式写出A、F形成化合物的电子式???????? 。 ③A、C两种元素最高价氧化物的水化物反应的离子方程式????????????????????。 ④D的固态氧化物自然界广泛存在的物质,也是工业上应用常见的原料,试写出它的用途两例:__________.MgSiP7. A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4。1mol A的单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答:
(1)写出A、B、C的元素符号:A ___,B ____, C _______
(2)A元素形成稳定氧化物的化学式为_______,该化合物中含有____________键.
(3)A离子的氧化性比B离子的氧化性_______, 这是由于__________________。NaAlClNa2O2离子键非极性弱钠的还原性比铝强
