元素周期表[下学期]
图片预览









文档简介
课件85张PPT。上节课主要内容:1、元素性质与原子结构的关系
同周期的元素,随着原子序数的递增,原子半径减小,金属性减弱非金属性增强。
2、金属性的判断依据:单质与水或酸反应置换出H2的难易;金属氧化物对应水化物碱性强弱
非金属性的判断依据:单质与H2化合的难易及氢化物的稳定性;最高价氧化物的水化物酸性的强弱
3、两性氧化物:既能与酸反应生成盐和水,又能与碱反应 生成盐和水的氧化物.
两性氢氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物.
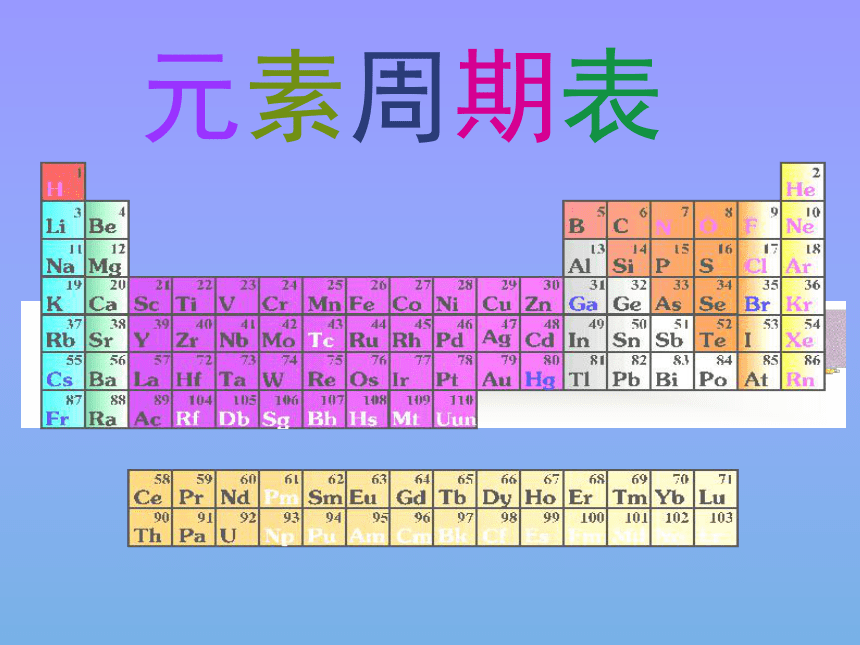
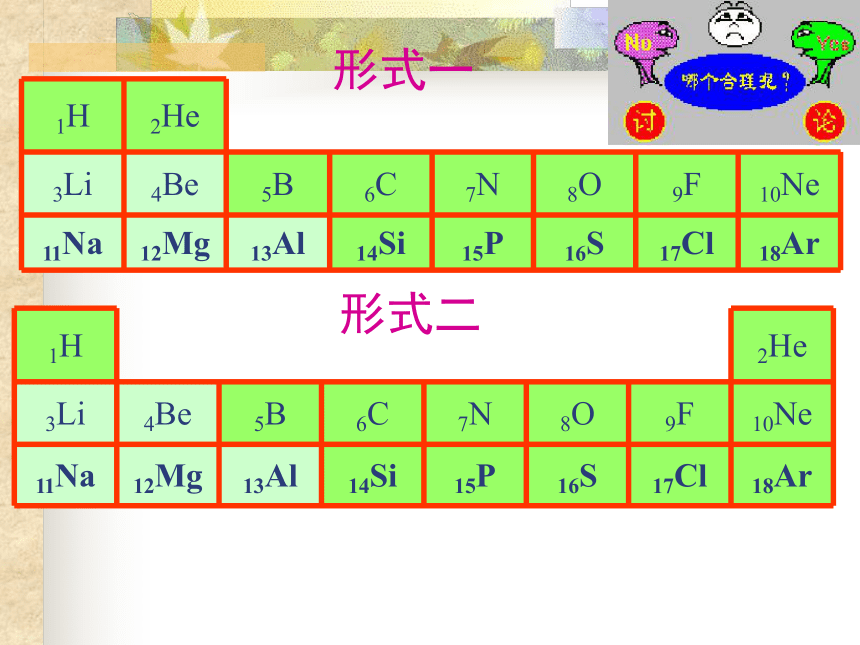
▲Al2O3:Al2O3+6HCl=2AlCl3+3H2OAl2O3+6H+=2Al3++3H2OAl2O3+2NaOH=2NaAlO2+H2OAl2O3+2OH-=2AlO2-+H2O(难点)▲Al(OH)32Al(OH)3+3H2SO4=Al2(SO4)3+6H2OAl(OH)3+3H+=Al3++3H2OAl(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH-=AlO2-+2H2O(难点)重要的反应方程式:元素周期表你能否: 将前18号元素编一个周期表?原则:
能体现原子序数递增;
相同电子层数的原子在表中能进行归类;
原子最外层电子数相同的元素能进行归类。 形式一形式二元素周期表的结构周期族元素周期表的结构(周期)
周期(横行)
具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,称为一个周期。周期数为其电子层数。周期短周期:
长周期:
不完全周期:第一、二、三周期第四、五、六周期第七周期三长三短一不全元素周期表的结构(族)
族(纵行)
主族:
副族:
第VⅢ族:
0族:(“八、九、十” 三个纵行)稀有气体元素表示方法:在族序数后面标一“A”字。ⅠA、ⅡAⅢA、… 最外层电子数=族序数表示方法:在族序数后标“B”字。如ⅠB、ⅡB、ⅢB、…完全由长周期元素构成的族。由短周期元素和长周期元素共同构成的族课堂练习:2、 原子序数为 X 的元素位于周期表的第ⅡA族,则原子序数为 X+1 的元素可能在( ) A. ⅢA 族 B. ⅠA 族 C. ⅠB 族 D. ⅢB 族3、有某元素 X 的核外电子数等于核内中子数。取该元素的单质 2.8 g 与氧气充分反应后,得到 6 g 的化合物XO2 ,该元素在周期表中的位置是 ( )
A.第三周期 B.第二周期 C.第Ⅳ A 族 D.第ⅤA 族ADAC课堂小结元素周期表周 期
(横向)族
(纵向)短周期长周期不完全周期:第 1 周期:2 种元素第 2 周期:8 种元素第 3 周期:8 种元素第 4 周期:18 种元素第 5 周期:18 种元素第 6 周期:32 种元素第 7 周期( 28 种元素)主族:副族:第 Ⅷ 族:零族:ⅠA ~ ⅦA族(第1~2、13~17纵行)ⅢB 族~Ⅶ B族、ⅠB族~ⅡB族(第3~7、11~12纵行)第8、9、10 三个纵行,位于 Ⅶ B ~ ⅠB 之间稀有气体元素(第 18 纵行)二、元素的性质与元素在周期表中位置的关系已知元素在周期表中的
位置推断原子结构和元素性质根据元素的原子结构或性质
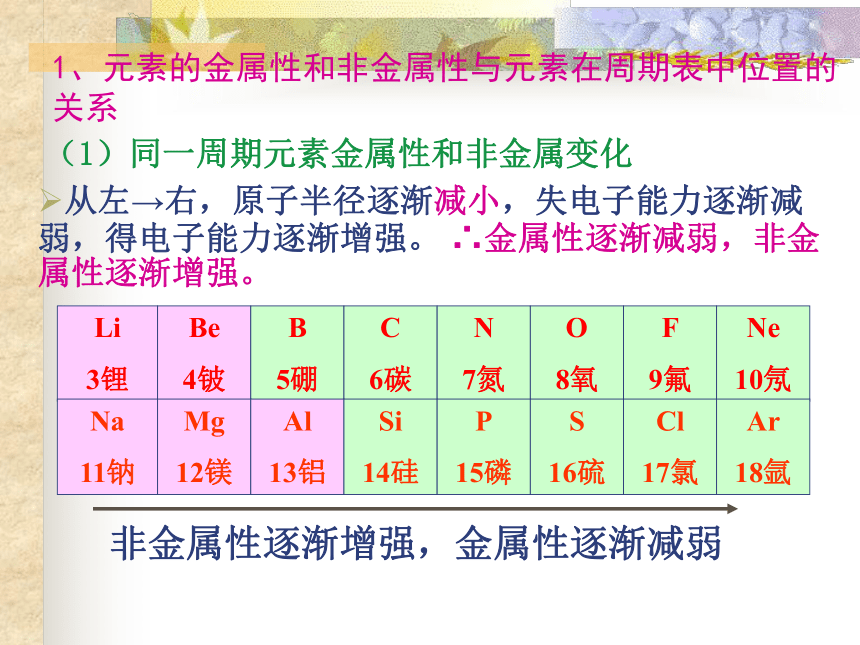
推测它在周期表中的位置1、元素的金属性和非金属性与元素在周期表中位置的关系(1)同一周期元素金属性和非金属变化从左→右,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强。 ∴金属性逐渐减弱,非金属性逐渐增强。
非金属性逐渐增强,金属性逐渐减弱(2)同一主族元素金属性和非金属变化从上到下,电子层数增加,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱。∴元素金属性逐渐增强,非金属性逐渐减弱。
以碱金属和卤族元素为例:
碱金属:从上到下,金属性逐渐增强
卤素:从上到下,非金属性逐渐减弱,金属性逐渐增强。Na
11钠Li
3锂K
19钾Rb
37铷Cs
55铯F
9氟Cl
17氯Br
35溴I
53碘At
85砹金 属 性 逐 渐 增 强金属性逐渐减弱,非金属性逐渐增强同一主族元素最高价氧化物对应水化物的酸碱性碱 性 增 强酸 性 增 强同一主族元素金属性和非金属变化元素最高价氧化物对应水化物的酸碱性酸性逐渐增强碱性逐渐增强碱性逐渐增强酸性逐渐增强元素气态氢化物的热稳定性热稳定性逐渐增强热稳定性逐渐减弱热稳定性逐渐减弱热稳定性逐渐增强元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强价电子——元素原子的最外层电子或某些元素的原子的次外层或倒数第三层的部分电子。
主族元素的最高正化合价等于它所在族的序数。 非金属最高正价+|负化合价|=8
副族和第VⅢ族化合价较复杂2、原子结构与化合价的关系元素的化合价+1+2+3+4
-4+5
-3+6
-2+7
-1RH4RH3H2RHRR2OROR2O3RO2R2O5RO3R2O7元素“位”、“构”、“性”三者关系结构原子序数=质子数=核电荷数
周期序数=电子层数
主族序数=最外层电子数金属原子半径大、最外层电子数少 易失电子 金属性强
非金属原子半径小、最外层电子数接近8 易得电子 非金属性强
最外层4个电子 不易得失电子 易形成共价化合物位置从左到右,原子半径减小,
金属性减弱,非金属性增强;
从上到下,原子半径增大,
金属性增强,非金属性减弱。性质元素位、构、性三者关系(举例)SeCsArB元素位、构、性三者关系(举例)金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。CsFClCs元素位、构、性三者关系(举例)处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有2个电子,则A最外层有 个电子。
处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的酸性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有3个电子,则A最外层有 个电子。右大3左小2在周期表中一定的区域内
寻找特定性质的物质根据周期表预言新元素的存在氟里昂的发现与元素周期表元素周期表的实际应用在周期表中一定的 区域内寻找特定性质的物质寻找用于制取农药的元素寻找半导体材料寻找催化剂、耐高温、耐腐蚀的合金材料寻找用于制取农药的元素寻找半导体材料寻找催化剂、耐高温、耐腐蚀的合金材料寻找用于制取农药的元素寻找半导体材料寻找催化剂、耐高温、耐腐蚀的合金材料根据元素周期表预言新元素的存在类铝(镓)的发现:
1875年,法国化学家布瓦博德朗在分析比里牛斯山的闪锌矿时发现一种新元素,命名为镓,测得镓的比重为4.7,不久收到门捷列夫的来信指出镓的比重不应是4 .7,而是5.9~6.0,布瓦博德朗是唯一手里掌握金属镓的人,门捷列夫是怎样知道镓的比重的呢?经重新测定镓的比重确实是5.94,这结果使他大为惊奇,认真阅读门捷列夫的周期论文后,感慨地说“我没有什么可说的了,事实证明了门捷列夫理论的巨大意义”。根据元素周期表预言新元素的存在根据元素周期表预言新元素的存在类硅(锗)的发现 1886年由德国的温克勒在分析硫银锗矿中发现的,把它命名为Germanium以纪念他的祖国——德国(German)。元素符号为Ge。元素锗就是在1870年门捷列夫预言的基础上发现的。根据元素周期表预言新元素的存在氟里昂的发现与元素周期表1930年美国化学家托马斯·米奇利成功地获得了一种新型的致冷剂——CCl2F2(即氟里昂,简称F12)。这完全得益于元素周期表的指导。在1930年前,一些气体如氨,二氧化硫,氯乙烷和氯甲烷等,被相继用作致冷剂。但是,这些致冷剂不是有毒就是易燃,很不安全。为了寻找无毒不易燃烧的致冷剂,米奇利根据元素周期表研究,分析单质及化合物易燃性和毒性的递变规律。氟里昂的发现与元素周期表在第三周期中,单质的易燃性是Na>Mg>Al,在第二周期中,CH4比NH3易燃,NH3双比H2O易燃,再比较氢化物的毒性:AsH3>PH3>NH3 H2S>H2O,根据这样的变化趋势,元素周期表中右上角的氟元素的化合物可能是理想的元素,不易燃的致冷剂。氟里昂的发现与元素周期表米奇利还分析了其它的一些规律,最终,一种全新的致冷剂CCl2F2终于应运而生了。
80年代,科学家们发现氟里昂会破坏大气的臭氧层,危害人类的健康的气候,逐步将被淘汰。人们又将在元素周期表的指导下去寻找新一代的致冷剂。三、同位素1、核素:
2、同位素:具有一定数目的质子和一定数目的中子的
一种原子。具有相同质子数而不同中子数的同种元素
的不同原子互称为同位数。3、原子的相对原子质量
原子的近似相对原子质量4、元素的相对原子质量
元素的近似相对原子质量M=M1×a%+M2 × b%
同周期的元素,随着原子序数的递增,原子半径减小,金属性减弱非金属性增强。
2、金属性的判断依据:单质与水或酸反应置换出H2的难易;金属氧化物对应水化物碱性强弱
非金属性的判断依据:单质与H2化合的难易及氢化物的稳定性;最高价氧化物的水化物酸性的强弱
3、两性氧化物:既能与酸反应生成盐和水,又能与碱反应 生成盐和水的氧化物.
两性氢氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物.
▲Al2O3:Al2O3+6HCl=2AlCl3+3H2OAl2O3+6H+=2Al3++3H2OAl2O3+2NaOH=2NaAlO2+H2OAl2O3+2OH-=2AlO2-+H2O(难点)▲Al(OH)32Al(OH)3+3H2SO4=Al2(SO4)3+6H2OAl(OH)3+3H+=Al3++3H2OAl(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH-=AlO2-+2H2O(难点)重要的反应方程式:元素周期表你能否: 将前18号元素编一个周期表?原则:
能体现原子序数递增;
相同电子层数的原子在表中能进行归类;
原子最外层电子数相同的元素能进行归类。 形式一形式二元素周期表的结构周期族元素周期表的结构(周期)
周期(横行)
具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,称为一个周期。周期数为其电子层数。周期短周期:
长周期:
不完全周期:第一、二、三周期第四、五、六周期第七周期三长三短一不全元素周期表的结构(族)
族(纵行)
主族:
副族:
第VⅢ族:
0族:(“八、九、十” 三个纵行)稀有气体元素表示方法:在族序数后面标一“A”字。ⅠA、ⅡAⅢA、… 最外层电子数=族序数表示方法:在族序数后标“B”字。如ⅠB、ⅡB、ⅢB、…完全由长周期元素构成的族。由短周期元素和长周期元素共同构成的族课堂练习:2、 原子序数为 X 的元素位于周期表的第ⅡA族,则原子序数为 X+1 的元素可能在( ) A. ⅢA 族 B. ⅠA 族 C. ⅠB 族 D. ⅢB 族3、有某元素 X 的核外电子数等于核内中子数。取该元素的单质 2.8 g 与氧气充分反应后,得到 6 g 的化合物XO2 ,该元素在周期表中的位置是 ( )
A.第三周期 B.第二周期 C.第Ⅳ A 族 D.第ⅤA 族ADAC课堂小结元素周期表周 期
(横向)族
(纵向)短周期长周期不完全周期:第 1 周期:2 种元素第 2 周期:8 种元素第 3 周期:8 种元素第 4 周期:18 种元素第 5 周期:18 种元素第 6 周期:32 种元素第 7 周期( 28 种元素)主族:副族:第 Ⅷ 族:零族:ⅠA ~ ⅦA族(第1~2、13~17纵行)ⅢB 族~Ⅶ B族、ⅠB族~ⅡB族(第3~7、11~12纵行)第8、9、10 三个纵行,位于 Ⅶ B ~ ⅠB 之间稀有气体元素(第 18 纵行)二、元素的性质与元素在周期表中位置的关系已知元素在周期表中的
位置推断原子结构和元素性质根据元素的原子结构或性质
推测它在周期表中的位置1、元素的金属性和非金属性与元素在周期表中位置的关系(1)同一周期元素金属性和非金属变化从左→右,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强。 ∴金属性逐渐减弱,非金属性逐渐增强。
非金属性逐渐增强,金属性逐渐减弱(2)同一主族元素金属性和非金属变化从上到下,电子层数增加,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱。∴元素金属性逐渐增强,非金属性逐渐减弱。
以碱金属和卤族元素为例:
碱金属:从上到下,金属性逐渐增强
卤素:从上到下,非金属性逐渐减弱,金属性逐渐增强。Na
11钠Li
3锂K
19钾Rb
37铷Cs
55铯F
9氟Cl
17氯Br
35溴I
53碘At
85砹金 属 性 逐 渐 增 强金属性逐渐减弱,非金属性逐渐增强同一主族元素最高价氧化物对应水化物的酸碱性碱 性 增 强酸 性 增 强同一主族元素金属性和非金属变化元素最高价氧化物对应水化物的酸碱性酸性逐渐增强碱性逐渐增强碱性逐渐增强酸性逐渐增强元素气态氢化物的热稳定性热稳定性逐渐增强热稳定性逐渐减弱热稳定性逐渐减弱热稳定性逐渐增强元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强价电子——元素原子的最外层电子或某些元素的原子的次外层或倒数第三层的部分电子。
主族元素的最高正化合价等于它所在族的序数。 非金属最高正价+|负化合价|=8
副族和第VⅢ族化合价较复杂2、原子结构与化合价的关系元素的化合价+1+2+3+4
-4+5
-3+6
-2+7
-1RH4RH3H2RHRR2OROR2O3RO2R2O5RO3R2O7元素“位”、“构”、“性”三者关系结构原子序数=质子数=核电荷数
周期序数=电子层数
主族序数=最外层电子数金属原子半径大、最外层电子数少 易失电子 金属性强
非金属原子半径小、最外层电子数接近8 易得电子 非金属性强
最外层4个电子 不易得失电子 易形成共价化合物位置从左到右,原子半径减小,
金属性减弱,非金属性增强;
从上到下,原子半径增大,
金属性增强,非金属性减弱。性质元素位、构、性三者关系(举例)SeCsArB元素位、构、性三者关系(举例)金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。CsFClCs元素位、构、性三者关系(举例)处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有2个电子,则A最外层有 个电子。
处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的酸性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有3个电子,则A最外层有 个电子。右大3左小2在周期表中一定的区域内
寻找特定性质的物质根据周期表预言新元素的存在氟里昂的发现与元素周期表元素周期表的实际应用在周期表中一定的 区域内寻找特定性质的物质寻找用于制取农药的元素寻找半导体材料寻找催化剂、耐高温、耐腐蚀的合金材料寻找用于制取农药的元素寻找半导体材料寻找催化剂、耐高温、耐腐蚀的合金材料寻找用于制取农药的元素寻找半导体材料寻找催化剂、耐高温、耐腐蚀的合金材料根据元素周期表预言新元素的存在类铝(镓)的发现:
1875年,法国化学家布瓦博德朗在分析比里牛斯山的闪锌矿时发现一种新元素,命名为镓,测得镓的比重为4.7,不久收到门捷列夫的来信指出镓的比重不应是4 .7,而是5.9~6.0,布瓦博德朗是唯一手里掌握金属镓的人,门捷列夫是怎样知道镓的比重的呢?经重新测定镓的比重确实是5.94,这结果使他大为惊奇,认真阅读门捷列夫的周期论文后,感慨地说“我没有什么可说的了,事实证明了门捷列夫理论的巨大意义”。根据元素周期表预言新元素的存在根据元素周期表预言新元素的存在类硅(锗)的发现 1886年由德国的温克勒在分析硫银锗矿中发现的,把它命名为Germanium以纪念他的祖国——德国(German)。元素符号为Ge。元素锗就是在1870年门捷列夫预言的基础上发现的。根据元素周期表预言新元素的存在氟里昂的发现与元素周期表1930年美国化学家托马斯·米奇利成功地获得了一种新型的致冷剂——CCl2F2(即氟里昂,简称F12)。这完全得益于元素周期表的指导。在1930年前,一些气体如氨,二氧化硫,氯乙烷和氯甲烷等,被相继用作致冷剂。但是,这些致冷剂不是有毒就是易燃,很不安全。为了寻找无毒不易燃烧的致冷剂,米奇利根据元素周期表研究,分析单质及化合物易燃性和毒性的递变规律。氟里昂的发现与元素周期表在第三周期中,单质的易燃性是Na>Mg>Al,在第二周期中,CH4比NH3易燃,NH3双比H2O易燃,再比较氢化物的毒性:AsH3>PH3>NH3 H2S>H2O,根据这样的变化趋势,元素周期表中右上角的氟元素的化合物可能是理想的元素,不易燃的致冷剂。氟里昂的发现与元素周期表米奇利还分析了其它的一些规律,最终,一种全新的致冷剂CCl2F2终于应运而生了。
80年代,科学家们发现氟里昂会破坏大气的臭氧层,危害人类的健康的气候,逐步将被淘汰。人们又将在元素周期表的指导下去寻找新一代的致冷剂。三、同位素1、核素:
2、同位素:具有一定数目的质子和一定数目的中子的
一种原子。具有相同质子数而不同中子数的同种元素
的不同原子互称为同位数。3、原子的相对原子质量
原子的近似相对原子质量4、元素的相对原子质量
元素的近似相对原子质量M=M1×a%+M2 × b%
