元素周期律[下学期]
图片预览






文档简介
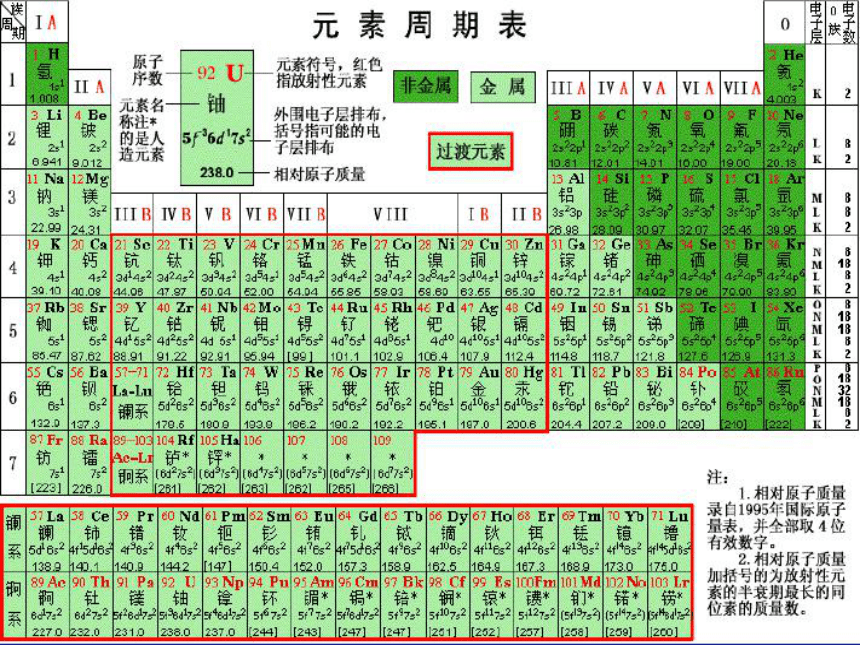
课件21张PPT。 元素周期表按原子序数的递增编排
将最外层电子数相同的元素归按原子序数递增的顺序从上到下排为一列。
将相同电子层数相同的元素排在一行。周期:具在相同的电子层数的元素按照原子序数递增的顺序排列的一个横行称为一个周期
周期序数??=??电子层数
每一周期都是以碱金属元素开始到卤素,最后以稀有气体元素结束。 第6周期中,57号元素到71号元素,共15种元素,它们原子的电子层结构和性质十分相似,总称镧系元素。
第7周期中,89号元素到103号元素,共15种元素,它们原子的电子层结构和性质也十分相似,总称锕系元素。 在锕系元素中92号元素铀(U)以后的各种元素,多数是人工进行核反应制得的元素,这些元素又叫做超铀元素。
[思考]如果不完全周期排满后,应为几种元素? 族:周期表中的每一个纵行称为一族,族的序号一般用罗马字母表示
(1)周期表中共有18个纵行,16个族。 (2)主族的序数???=??最外层电子数??=??该元素的最高化合价数。元素的金属性和非金属性的判断设元素所在的主族的族序数为m,所在的周期序数为n
m/n>1时,该元素为非金属元素,显非金属性.比值越大,非金属性越强
m/n<1时,该元素为金属元素,显金属性.比值越小,金属性越强
m/n=1时,具有金属性和非金属性.其氧化物为两性氧化物,对应的水化物为两性氢氧化物同周期从左到右,元素的金属性减弱,非金属性增强。
同主族从上至下,元素的金属性增强,非金属性减弱 1.当电子层数及核电荷数均不同时,电子层数越多的,半径越大。如Na与K。
2.当电子层数相同,核电荷数不同时,核电荷数越大的,半径越小。如Na与Mg。?
3.当核电荷数相同,电子层数也相同时,核外电子数越多的,半径越大。如Cl与Cl-。元素化合价与元素在周期表中位置的关系:
对于主族元素
最高正价?=??族序数
最高正化合价?+?∣最低负价∣?=?8 得失电子能力
同周期(从左到右)
失电子由 大→小
得电子由 小→大
同主族(从上到下)
得电子由 大→小
失电子由 小→大 最高价氧化物对应水化物的酸碱性
同周期(从左到右)
碱性减弱
酸性增强
同主族(从上到下)
碱性增强
酸性减弱 得电子力强 非金属性强 氧化性强
失电子能力强 金属性强 还原性强
金属的金属性越强,其最高价氧化物对应水化物的碱性越强
非金属的非金属性越强,其最高价氧化物对应的水化物的酸性越强。练习碱性强弱:
KOH NaOH Mg(OH)2
酸性强弱:
HClO4 HBrO4
HNO3 H3PO4
元素周期表的意义(1)?预测新元素
(2)?寻找原料 ①?农药——氟、氯、硫、磷、砷附近 ②?半导体——金属与非金属的分界线附近。 ③?催化剂——过渡元素 ④?耐高温、耐腐蚀性的合金——过渡元素。 单质密度最小的元素 H
单质密度最小的金属元素 Li
地壳中含量最多的元素 O
自然界最活泼的金属元素 铯Cs
周期表中最活泼的金属元素 钫Fr
最活泼的非金属元素 F
最稳定的气态氢化物 HF
最不稳定的气态氢化物 SiH4自然界最强的碱 CsOH
最强的含氧酸 HClO4
常温唯一液态非金属单质 Hg
自然界最硬的元素 C
单质延展性最好的金属 Au
单质导电性最好的金属 Ag
形成化合物种类最多的元素 C
同位素最多的元素 Sn
形成氧化物种类最多的元素 N Mn
将最外层电子数相同的元素归按原子序数递增的顺序从上到下排为一列。
将相同电子层数相同的元素排在一行。周期:具在相同的电子层数的元素按照原子序数递增的顺序排列的一个横行称为一个周期
周期序数??=??电子层数
每一周期都是以碱金属元素开始到卤素,最后以稀有气体元素结束。 第6周期中,57号元素到71号元素,共15种元素,它们原子的电子层结构和性质十分相似,总称镧系元素。
第7周期中,89号元素到103号元素,共15种元素,它们原子的电子层结构和性质也十分相似,总称锕系元素。 在锕系元素中92号元素铀(U)以后的各种元素,多数是人工进行核反应制得的元素,这些元素又叫做超铀元素。
[思考]如果不完全周期排满后,应为几种元素? 族:周期表中的每一个纵行称为一族,族的序号一般用罗马字母表示
(1)周期表中共有18个纵行,16个族。 (2)主族的序数???=??最外层电子数??=??该元素的最高化合价数。元素的金属性和非金属性的判断设元素所在的主族的族序数为m,所在的周期序数为n
m/n>1时,该元素为非金属元素,显非金属性.比值越大,非金属性越强
m/n<1时,该元素为金属元素,显金属性.比值越小,金属性越强
m/n=1时,具有金属性和非金属性.其氧化物为两性氧化物,对应的水化物为两性氢氧化物同周期从左到右,元素的金属性减弱,非金属性增强。
同主族从上至下,元素的金属性增强,非金属性减弱 1.当电子层数及核电荷数均不同时,电子层数越多的,半径越大。如Na与K。
2.当电子层数相同,核电荷数不同时,核电荷数越大的,半径越小。如Na与Mg。?
3.当核电荷数相同,电子层数也相同时,核外电子数越多的,半径越大。如Cl与Cl-。元素化合价与元素在周期表中位置的关系:
对于主族元素
最高正价?=??族序数
最高正化合价?+?∣最低负价∣?=?8 得失电子能力
同周期(从左到右)
失电子由 大→小
得电子由 小→大
同主族(从上到下)
得电子由 大→小
失电子由 小→大 最高价氧化物对应水化物的酸碱性
同周期(从左到右)
碱性减弱
酸性增强
同主族(从上到下)
碱性增强
酸性减弱 得电子力强 非金属性强 氧化性强
失电子能力强 金属性强 还原性强
金属的金属性越强,其最高价氧化物对应水化物的碱性越强
非金属的非金属性越强,其最高价氧化物对应的水化物的酸性越强。练习碱性强弱:
KOH NaOH Mg(OH)2
酸性强弱:
HClO4 HBrO4
HNO3 H3PO4
元素周期表的意义(1)?预测新元素
(2)?寻找原料 ①?农药——氟、氯、硫、磷、砷附近 ②?半导体——金属与非金属的分界线附近。 ③?催化剂——过渡元素 ④?耐高温、耐腐蚀性的合金——过渡元素。 单质密度最小的元素 H
单质密度最小的金属元素 Li
地壳中含量最多的元素 O
自然界最活泼的金属元素 铯Cs
周期表中最活泼的金属元素 钫Fr
最活泼的非金属元素 F
最稳定的气态氢化物 HF
最不稳定的气态氢化物 SiH4自然界最强的碱 CsOH
最强的含氧酸 HClO4
常温唯一液态非金属单质 Hg
自然界最硬的元素 C
单质延展性最好的金属 Au
单质导电性最好的金属 Ag
形成化合物种类最多的元素 C
同位素最多的元素 Sn
形成氧化物种类最多的元素 N Mn
