元素周期律第二课时[下学期]
文档属性
| 名称 | 元素周期律第二课时[下学期] | 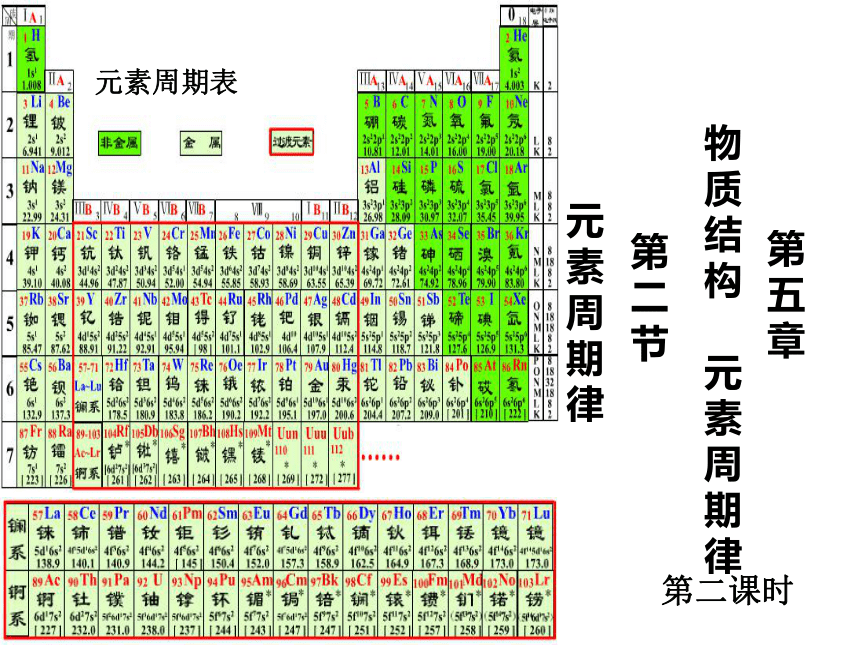 | |
| 格式 | rar | ||
| 文件大小 | 443.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-02 10:25:00 | ||
图片预览





文档简介
课件13张PPT。 元素周期表
物
质
结
构
元
素
周
期
律第
五
章第
二
节元
素
周
期
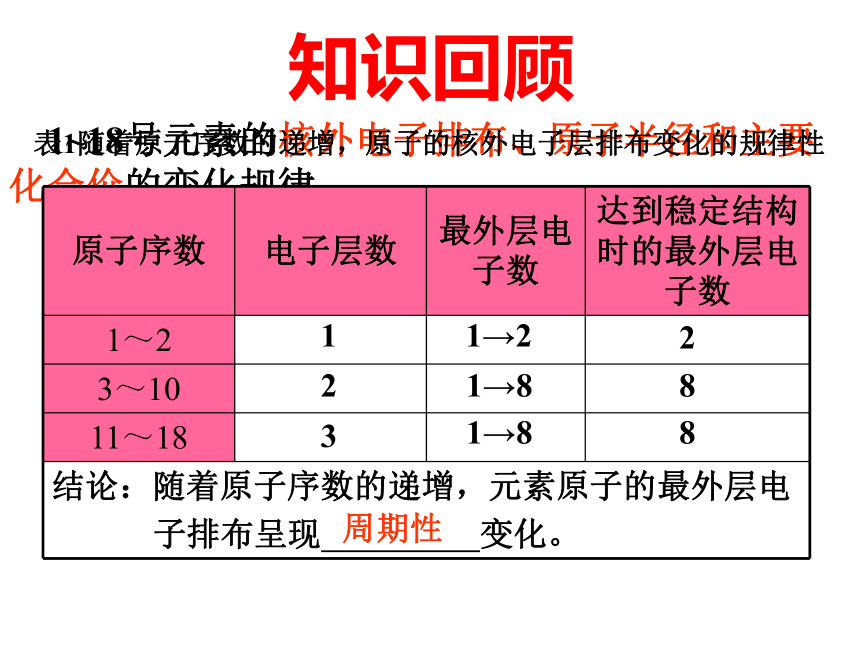
律 第二课时知识回顾 1~18号元素的核外电子排布、原子半径和主要化合价的变化规律表1随着原子序数的递增,原子的核外电子层排布变化的规律性1 1→2 22 1→8 8 3 1→8 8周期性知识回顾表2随着原子序数的递增,元素原子半径变化的规律性0.152nm→0.071nm大→小0.186nm→0.099nm大→小周期性知识回顾表3随着原子序数的递增,元素化合价变化的规律性+1→0 +1→+5—4→—1→0 +1→+7—4→—1→0 周期性 深入探讨 元素的性质即元素的金属性和非金属性与原子结构的关系?电子层数相同,核电荷数增大 原子半径减小原子核对核外电子的吸引能力增大失电子能力减弱,得电子能力增强金属性减弱,非金属性增强深入探讨 元素的性质即元素的金属性和非金属性与原子结构的关系?最外层电子数相同,电子层数增多 原子半径增大原子核对核外电子的吸引能力减弱失电子能力增强,得电子能力减弱金属性增强,非金属性减弱深入分析 元素的金属性和非金属性的判断依据有哪些? 小结:I、元素金属性强弱判断依据 1.金属单质与水或酸反应置换出H2的难易2.金属氧化物对应的水化物碱性强弱II、元素非金属性强弱判断依据 1.非金属单质与H2化合的难易程度及气态氢化
物的稳定性2.最高价氧化物对应的水化物(最高价含氧酸)
的酸性强弱1~18号元素的性质周期性变化规律继续学习 11~13号元素即Na、Mg、Al的金属性递变规律?演示实验现象化学
方程式结论常温下与冷水
发生剧烈的反应常温下较难反应,
与热水可发生作用2Na +2H2O =
2NaOH + H2↑Mg + 2H2O(热) =
Mg(OH)2 + H2 ↑>演示实验现象化学
方程式结论剧烈的反应反应不如镁的剧烈Mg + 2HCl =
MgCl2 + H2↑2Al + 6HCl =
2AlCl3 + 3H2↑>演示实验现象:白色沉淀白色沉淀沉淀溶解沉淀溶解沉淀溶解无明显现象实验3:氢氧化镁、氢氧化铝的性质 Al2O3 + 6H+= 2Al3++ 3H2OAl2O3 + 2OH- = 2AlO2- + H2O2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2OAl(OH)3 + NaOH = NaAlO2 + 2H2O偏铝酸钠偏铝酸根H3AlO3 铝酸小结 表I、11~13号元素即Na、Mg、Al的金属性递变规律跟冷水剧
烈反应NaOH强碱跟热水反应
放H2;跟酸…Mg(OH)2
中强碱反应不如镁与酸剧烈Al(OH)3
两性
氢氧化物碱性氧化物碱性氧化物两性氧化物金属性: Na>Mg>Al
物
质
结
构
元
素
周
期
律第
五
章第
二
节元
素
周
期
律 第二课时知识回顾 1~18号元素的核外电子排布、原子半径和主要化合价的变化规律表1随着原子序数的递增,原子的核外电子层排布变化的规律性1 1→2 22 1→8 8 3 1→8 8周期性知识回顾表2随着原子序数的递增,元素原子半径变化的规律性0.152nm→0.071nm大→小0.186nm→0.099nm大→小周期性知识回顾表3随着原子序数的递增,元素化合价变化的规律性+1→0 +1→+5—4→—1→0 +1→+7—4→—1→0 周期性 深入探讨 元素的性质即元素的金属性和非金属性与原子结构的关系?电子层数相同,核电荷数增大 原子半径减小原子核对核外电子的吸引能力增大失电子能力减弱,得电子能力增强金属性减弱,非金属性增强深入探讨 元素的性质即元素的金属性和非金属性与原子结构的关系?最外层电子数相同,电子层数增多 原子半径增大原子核对核外电子的吸引能力减弱失电子能力增强,得电子能力减弱金属性增强,非金属性减弱深入分析 元素的金属性和非金属性的判断依据有哪些? 小结:I、元素金属性强弱判断依据 1.金属单质与水或酸反应置换出H2的难易2.金属氧化物对应的水化物碱性强弱II、元素非金属性强弱判断依据 1.非金属单质与H2化合的难易程度及气态氢化
物的稳定性2.最高价氧化物对应的水化物(最高价含氧酸)
的酸性强弱1~18号元素的性质周期性变化规律继续学习 11~13号元素即Na、Mg、Al的金属性递变规律?演示实验现象化学
方程式结论常温下与冷水
发生剧烈的反应常温下较难反应,
与热水可发生作用2Na +2H2O =
2NaOH + H2↑Mg + 2H2O(热) =
Mg(OH)2 + H2 ↑>演示实验现象化学
方程式结论剧烈的反应反应不如镁的剧烈Mg + 2HCl =
MgCl2 + H2↑2Al + 6HCl =
2AlCl3 + 3H2↑>演示实验现象:白色沉淀白色沉淀沉淀溶解沉淀溶解沉淀溶解无明显现象实验3:氢氧化镁、氢氧化铝的性质 Al2O3 + 6H+= 2Al3++ 3H2OAl2O3 + 2OH- = 2AlO2- + H2O2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2OAl(OH)3 + NaOH = NaAlO2 + 2H2O偏铝酸钠偏铝酸根H3AlO3 铝酸小结 表I、11~13号元素即Na、Mg、Al的金属性递变规律跟冷水剧
烈反应NaOH强碱跟热水反应
放H2;跟酸…Mg(OH)2
中强碱反应不如镁与酸剧烈Al(OH)3
两性
氢氧化物碱性氧化物碱性氧化物两性氧化物金属性: Na>Mg>Al
