新课标化学必修2第一章第二节元素周期律(第三课时)[下学期]
文档属性
| 名称 | 新课标化学必修2第一章第二节元素周期律(第三课时)[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 349.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-02 12:35:00 | ||
图片预览








文档简介
课件22张PPT。第二节 元素周期律(第三课时)随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
元素原子半径呈现周期性变化
元素化合价呈现周期性变化
元素的化学性质呈现周期性变化 元素的性质随着元素原子序数的递增而呈现周期性的变化—元素周期律 元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。 元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。元素周期律元素周期律元素周期律【复习】(3)实质:元素性质周期性变化是由于______
___________________________周期性
变化的必然结果。 (2)内容:元素性质的周期性变化主要体现在
_________________________、_____
________________、______________
___________等方面。(1)定义:____________随着原子________
___________________________的规律叫做元素周期律。元素的性质原子序数原子核外电子排布的周期性变化元素原子元素主要化合价的半径的周期性变化周期性变化的递增而呈现周期性的变化的原子核外电子排布的周期性变化练习元素基本性质:
金属性与非金属性
化合价四.元素的性质与元素在周期表中位置的关系 1.元素的金属性和非金属性与元素在周期表中位置的关系 同周期 从左到右:
金属性递变规律
随着原子序数递增,金属性逐渐减弱
Ex: Na > Mg > Al
这种递变规律从哪些方面体现出来单质与水或酸反应置换出氢的难易程度。
最高价氧化物对应的水化物的碱性强弱。同周期 从左到右:
非金属性递变规律
随着原子序数递增,非金属性逐渐增强
Ex: Si < P < S < Cl
这种递变规律从哪些方面体现出来?如何从结构上解释同周期金属性和非金属性的递变?元素与氢气生成气态气态氢化物的难易程度及其稳定性。
最高价氧化物对应的水化物的酸性强弱。答:电荷数依次增多,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强.同主族 从上到下:
金属性递变规律
随着原子序数递增,金属性逐渐增强
Ex: Cs > Rb > K > Na > Li
这种递变规律从哪些方面体现出来
单质与水或酸反应置换出氢的难易程度。
最高价氧化物对应的水化物的碱性强弱。
同主族 从上到下:
非金属性递变规律
随着原子序数递增,非金属性逐渐减弱
Ex: F > Cl > Br > I
这种递变规律从哪些方面体现出来?元素与氢气生成气态气态氢化物的难易 程度及其稳定性。
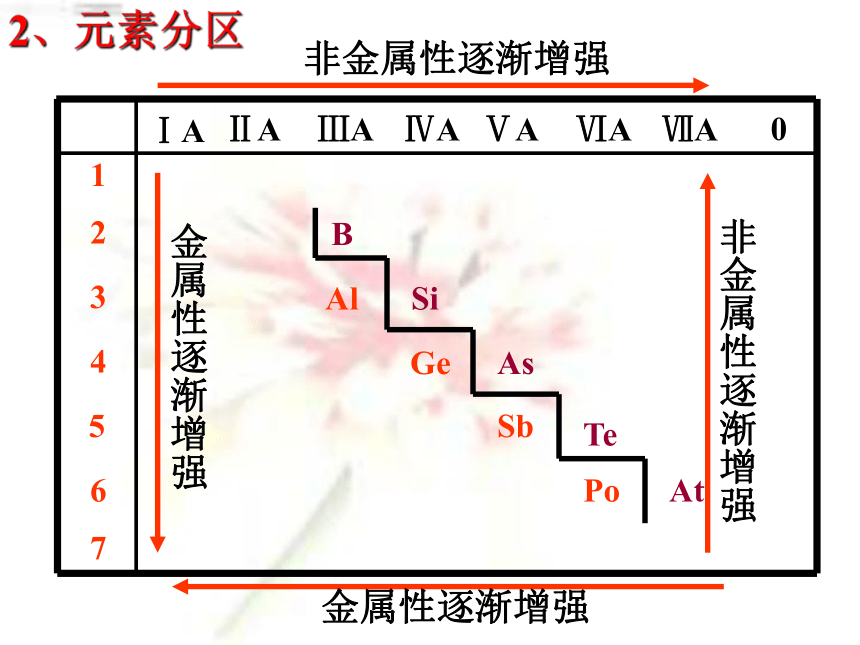
最高价氧化物对应的水化物的酸性强弱。如何从结构上解释同主族金属性和非金属性的递变?答:核电荷数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱. 0 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强2、元素分区【学与问】教材第16页
什么元素的金属性最强?
什么元素的非金属性最强?
它们分别位于元素周期表中的什么位置?元素之最最活泼金属Cs、最活泼非金属F
最轻的金属Li、最轻的非金属H
最高熔沸点是C、最低熔沸点是He
最稳定的气态氢化物HF,含H%最大的是CH4
最强酸HClO4、最强碱CsOH
地壳中含量最多的金属和非金属 Al O【知识归纳】3、元素化合价与结构的关系:(1) 价电子:(2)主族元素:
最高正价=最外层电子数元素原子的最外层电子或某些元素的原子的次外层或倒数第三层的部分电子。(3)副族和第VⅢ族化合价较复杂原子序数= 核电荷数周期数= 电子层数主族序数=最外层电子数同位素-化学性质相同 相似性
递变性(从上至下,金属性增强,非金属性减弱)同周期同主族递变性(从左到右,金属性减弱,非金属性增强)电子层数最外层电子数金属性、非金属性强弱(主族)最外层电子数
= 最高正价数8 -最外层电子数= 最低负价数原子结构表中位置元素性质原子结构决定元素在周期表中的位置和性质。元素在周期表中的位置,反映了元素的原子结构和元素的性质。1、F 没有正价,O 通常不显示正价;
2、金属元素只有正化合价而无负价。 【位-构-性】 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。五、元素周期律及元素周期表的三大意义半导体:在“折线”附近 Si Ge Se Ga
农药: 在磷附近 P As S Cl F
催化剂、耐高温、耐腐蚀材料:
过渡元素 Fe Ni Pt Pd Rh 1870年门捷列夫预言了31号元素镓,门捷列夫
把它称作亚铝,指出:“亚铝是一种容易挥发的物质,
将来一定有人利用光谱分析发现它” 1875年法国人布瓦德朗果然用光谱分析法发现新
元素,并命名为镓。除比重有差异外,一切都应验了。 门捷列夫写信给巴黎科学院,“ 镓就是我预言的
亚铝,它的原子量接近68,比重应该是5.9上下,不是
4.7,请再试验一下,也许您那块物质还不纯……” 布瓦德朗重新测定镓的比重,果然是5.9。例:X和Y均为短周期元素,已知aXn-比bYm+多两个电子层,则下列说法正确的是 ( )A b < 5
B X只能位于第3周期
C a + n – b + m = 10或16
D Y 不可能位于第2周期A C第一周期第二周期第二周期第三周期a + n – b + m
=阴离子电子数 - 阳离子电子数a + n – b + m = 10 – 0 = 10a + n – b + m = 18 – 2 = 16例:在元素周期表的前4周期中,如图排列着5种元素,若B元素的核电荷数为Z,则这5种元素核电荷数之和可能是( )A 5Z+2 B 5Z
C 5Z+10 D 5Z+18BC 二
三
四Z Z - 8 Z + 8
或 Z + 18EZ - 1Z+1【课堂练习】1、相邻三个短周期的主族元素A、B、C、D、E,它们的原子序数依次增大,B、C、D元素在同一周期,A、E在同一主族。除A外的各元素的原子的电子层内层已填满电子。其中B的最外层有4个电子。A与B,B与C都能生成气态的化合物。D与E生成离子化合物。在离子化合物中它们化合价的绝对值相等。试回答:它们各是什么元素?H、C、O、F、Na 2、 下列叙述正确的是:
A、两种微粒,若核外电子排布完全相同,则其化学性质一定相同。
B、若两原子核外电子排布相同,则一定是同一种元素。
C、阴离子的核外电子排布,一定与上一周期稀有气体元素原子电子排布相同。
D、凡单原子形成的离子,一定具有稀有气体元素的原子核外电子排布。分子、原子、离子同位素H+、 Fe2+、Fe3+B3、 请选择正确的序号:
A、质子数 B、中子数 C、核外电子数
D、最外层电子数 E、电子层数
1、原子(核素)种类由___ ____ __决定。
2、元素种类由___ ____ __决定。
3、元素有同位素由___ ____ __决定。
4、同位素原子量由___ ____ __决定。
5、原子半径由___ ____ __决定。
6、元素化合价由___ ____ __决定。
7、元素化学性质由___ ____ __决定。
8、价电子数通常是指___ ____ __。
9、核电荷数由___ ____ __决定。ABABABE、A、CDDDA同周期、同主族元素的递变规律依次增大逐渐增多相同逐渐减小周期性变化金属性减弱,非金属性增强还原性减弱,氧化性增强碱性减弱,酸性增强逐渐增强按周期元素数增加相同依次递增逐渐增大基本相同非金属性减弱,金属性增强氧化性减弱,还原性增强酸性减弱,碱性增强逐渐减弱本节总结再见!
元素原子的核外电子排布呈现周期性变化
元素原子半径呈现周期性变化
元素化合价呈现周期性变化
元素的化学性质呈现周期性变化 元素的性质随着元素原子序数的递增而呈现周期性的变化—元素周期律 元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。 元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。元素周期律元素周期律元素周期律【复习】(3)实质:元素性质周期性变化是由于______
___________________________周期性
变化的必然结果。 (2)内容:元素性质的周期性变化主要体现在
_________________________、_____
________________、______________
___________等方面。(1)定义:____________随着原子________
___________________________的规律叫做元素周期律。元素的性质原子序数原子核外电子排布的周期性变化元素原子元素主要化合价的半径的周期性变化周期性变化的递增而呈现周期性的变化的原子核外电子排布的周期性变化练习元素基本性质:
金属性与非金属性
化合价四.元素的性质与元素在周期表中位置的关系 1.元素的金属性和非金属性与元素在周期表中位置的关系 同周期 从左到右:
金属性递变规律
随着原子序数递增,金属性逐渐减弱
Ex: Na > Mg > Al
这种递变规律从哪些方面体现出来单质与水或酸反应置换出氢的难易程度。
最高价氧化物对应的水化物的碱性强弱。同周期 从左到右:
非金属性递变规律
随着原子序数递增,非金属性逐渐增强
Ex: Si < P < S < Cl
这种递变规律从哪些方面体现出来?如何从结构上解释同周期金属性和非金属性的递变?元素与氢气生成气态气态氢化物的难易程度及其稳定性。
最高价氧化物对应的水化物的酸性强弱。答:电荷数依次增多,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强.同主族 从上到下:
金属性递变规律
随着原子序数递增,金属性逐渐增强
Ex: Cs > Rb > K > Na > Li
这种递变规律从哪些方面体现出来
单质与水或酸反应置换出氢的难易程度。
最高价氧化物对应的水化物的碱性强弱。
同主族 从上到下:
非金属性递变规律
随着原子序数递增,非金属性逐渐减弱
Ex: F > Cl > Br > I
这种递变规律从哪些方面体现出来?元素与氢气生成气态气态氢化物的难易 程度及其稳定性。
最高价氧化物对应的水化物的酸性强弱。如何从结构上解释同主族金属性和非金属性的递变?答:核电荷数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱. 0 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强2、元素分区【学与问】教材第16页
什么元素的金属性最强?
什么元素的非金属性最强?
它们分别位于元素周期表中的什么位置?元素之最最活泼金属Cs、最活泼非金属F
最轻的金属Li、最轻的非金属H
最高熔沸点是C、最低熔沸点是He
最稳定的气态氢化物HF,含H%最大的是CH4
最强酸HClO4、最强碱CsOH
地壳中含量最多的金属和非金属 Al O【知识归纳】3、元素化合价与结构的关系:(1) 价电子:(2)主族元素:
最高正价=最外层电子数元素原子的最外层电子或某些元素的原子的次外层或倒数第三层的部分电子。(3)副族和第VⅢ族化合价较复杂原子序数= 核电荷数周期数= 电子层数主族序数=最外层电子数同位素-化学性质相同 相似性
递变性(从上至下,金属性增强,非金属性减弱)同周期同主族递变性(从左到右,金属性减弱,非金属性增强)电子层数最外层电子数金属性、非金属性强弱(主族)最外层电子数
= 最高正价数8 -最外层电子数= 最低负价数原子结构表中位置元素性质原子结构决定元素在周期表中的位置和性质。元素在周期表中的位置,反映了元素的原子结构和元素的性质。1、F 没有正价,O 通常不显示正价;
2、金属元素只有正化合价而无负价。 【位-构-性】 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。五、元素周期律及元素周期表的三大意义半导体:在“折线”附近 Si Ge Se Ga
农药: 在磷附近 P As S Cl F
催化剂、耐高温、耐腐蚀材料:
过渡元素 Fe Ni Pt Pd Rh 1870年门捷列夫预言了31号元素镓,门捷列夫
把它称作亚铝,指出:“亚铝是一种容易挥发的物质,
将来一定有人利用光谱分析发现它” 1875年法国人布瓦德朗果然用光谱分析法发现新
元素,并命名为镓。除比重有差异外,一切都应验了。 门捷列夫写信给巴黎科学院,“ 镓就是我预言的
亚铝,它的原子量接近68,比重应该是5.9上下,不是
4.7,请再试验一下,也许您那块物质还不纯……” 布瓦德朗重新测定镓的比重,果然是5.9。例:X和Y均为短周期元素,已知aXn-比bYm+多两个电子层,则下列说法正确的是 ( )A b < 5
B X只能位于第3周期
C a + n – b + m = 10或16
D Y 不可能位于第2周期A C第一周期第二周期第二周期第三周期a + n – b + m
=阴离子电子数 - 阳离子电子数a + n – b + m = 10 – 0 = 10a + n – b + m = 18 – 2 = 16例:在元素周期表的前4周期中,如图排列着5种元素,若B元素的核电荷数为Z,则这5种元素核电荷数之和可能是( )A 5Z+2 B 5Z
C 5Z+10 D 5Z+18BC 二
三
四Z Z - 8 Z + 8
或 Z + 18EZ - 1Z+1【课堂练习】1、相邻三个短周期的主族元素A、B、C、D、E,它们的原子序数依次增大,B、C、D元素在同一周期,A、E在同一主族。除A外的各元素的原子的电子层内层已填满电子。其中B的最外层有4个电子。A与B,B与C都能生成气态的化合物。D与E生成离子化合物。在离子化合物中它们化合价的绝对值相等。试回答:它们各是什么元素?H、C、O、F、Na 2、 下列叙述正确的是:
A、两种微粒,若核外电子排布完全相同,则其化学性质一定相同。
B、若两原子核外电子排布相同,则一定是同一种元素。
C、阴离子的核外电子排布,一定与上一周期稀有气体元素原子电子排布相同。
D、凡单原子形成的离子,一定具有稀有气体元素的原子核外电子排布。分子、原子、离子同位素H+、 Fe2+、Fe3+B3、 请选择正确的序号:
A、质子数 B、中子数 C、核外电子数
D、最外层电子数 E、电子层数
1、原子(核素)种类由___ ____ __决定。
2、元素种类由___ ____ __决定。
3、元素有同位素由___ ____ __决定。
4、同位素原子量由___ ____ __决定。
5、原子半径由___ ____ __决定。
6、元素化合价由___ ____ __决定。
7、元素化学性质由___ ____ __决定。
8、价电子数通常是指___ ____ __。
9、核电荷数由___ ____ __决定。ABABABE、A、CDDDA同周期、同主族元素的递变规律依次增大逐渐增多相同逐渐减小周期性变化金属性减弱,非金属性增强还原性减弱,氧化性增强碱性减弱,酸性增强逐渐增强按周期元素数增加相同依次递增逐渐增大基本相同非金属性减弱,金属性增强氧化性减弱,还原性增强酸性减弱,碱性增强逐渐减弱本节总结再见!
