第二章 化学反应和能量复习学案[下学期]
文档属性
| 名称 | 第二章 化学反应和能量复习学案[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 39.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-04-16 00:00:00 | ||
图片预览

文档简介
第二章 化学反应和能量复习学案
第一节 化学能与热能
学习目标:
1 知道化学键的断裂和形成是化学反应中能量变化的主要原因,了解吸热反应和放热反应。知道常见的吸热反应和放热反应。
2通过生活中的实例了解化学能与热能的相互转化
归纳与整理
1.当物质发生化学反应时,断开反应物中的化学键要 能量,而形成生成物的化学键要 能量; 是化学反应中能量变化的主要原因。
2.一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于 。
具体情况:
a 反应物的总能量 生成物的总能量,则化学反应放出能量;
b 反应物的总能量 生成物的总能量,则化学反应吸收能量。
3.化学反应中的能量变化通常表现为 的变化,吸热或者放热。例如Ba(OH)2·8H2O和NH4Cl之间的反应、灼热的碳和水制取水煤气的反应以及KClO3的分解等都是 反应;例如活泼金属和酸反应、物质的燃烧反应以及酸碱中和反应等都是 反应。
自我检测
1.下列反应属于放热反应的是( )
A.铁与盐酸 B.C和CO2 C.碳酸钙的分解 D.Ba(OH)2·8H2O与NH4Cl晶体
2.下列反应过程一定吸收能量的是( )
A.化合反应 B.分解反应 C.分子拆成原子 D.原子组成分子
3.下列说法中错误的是( )
A.化学反应中的能量变化通常表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.需要加热才能发生的反应一定是吸热反应
D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
4. 已物金刚石在一定条件下转化为石墨是放热的,则金刚石和石墨比较,能量“贮存”高的是( )
A.石墨 B.金刚石 C.一样高 D.无法判断
5. 下列说法正确的是( )
A.化学反应中的能量变化,通常表现为热量的变化
B.煤和石油属于可再生能源
C.要使燃料燃烧只需要大量的氧气
D.汽车排出大量尾气中含有CO会污染大气
6. 下列不是化石能源的是( )
A.氢气 B.煤 C.石油 D.天然气
7.下列叙述正确的是 ( )
A、电能是二级能源 B、水力是二级能源C、天然气是一级能源 D、水煤气是一级能源
8 已知反应:X + Y =M + N 为放热反应,对该反应的下列说法中正确的是( )
A.X 的能量一定高于 M B.Y 的能量一定高于 N
C.X 和 Y 的总能量一定高于 M 和 N 的总能量
D.因为该反应是放热反应,故不必加热反应就一定能发生
第二节 化学能与电能
学习目标:
1 掌握原电池的形成条件,准确判断原电池的正负极,并学会书写简单原电池的电极反应。
2 了解日常生活中常用的化学电源和新型化学电池
归纳与整理
1.原电池的构成条件
① 不同的两种金属(或金属与石墨)构成电极;
② 溶液;
③构成 电路。
2.如何判断原电池正、负极?
(1)依据原电池两极材料:
较活泼的金属作 极(K、Ca、Na太活泼,一般不能作电极);较不活泼的金属或可导电的非金属(石墨)等作 极。
(2)根据电子流向或电流方向:
电子流出或电流流入的一极是 极,电子流入或电流流出的一极是 极。
(3)根据内电路离子的迁移方向:阳离子移向原电池的 极。
(4)根据原电池中电极反应或总反应方程式判断:
负极 (填失去或得到)电子→化合价 →还原剂;
正极 电子→化合价 →氧化剂。
3.书写原电池的电极反应式(以Cu、Zn、H2SO4溶液构成的原电池为例)
正极是 ,发生 ,电极反应是 ;
负极是 , 发生 , 电极反应是 ,
总的反应式(离子方程式)是 。
自我检测
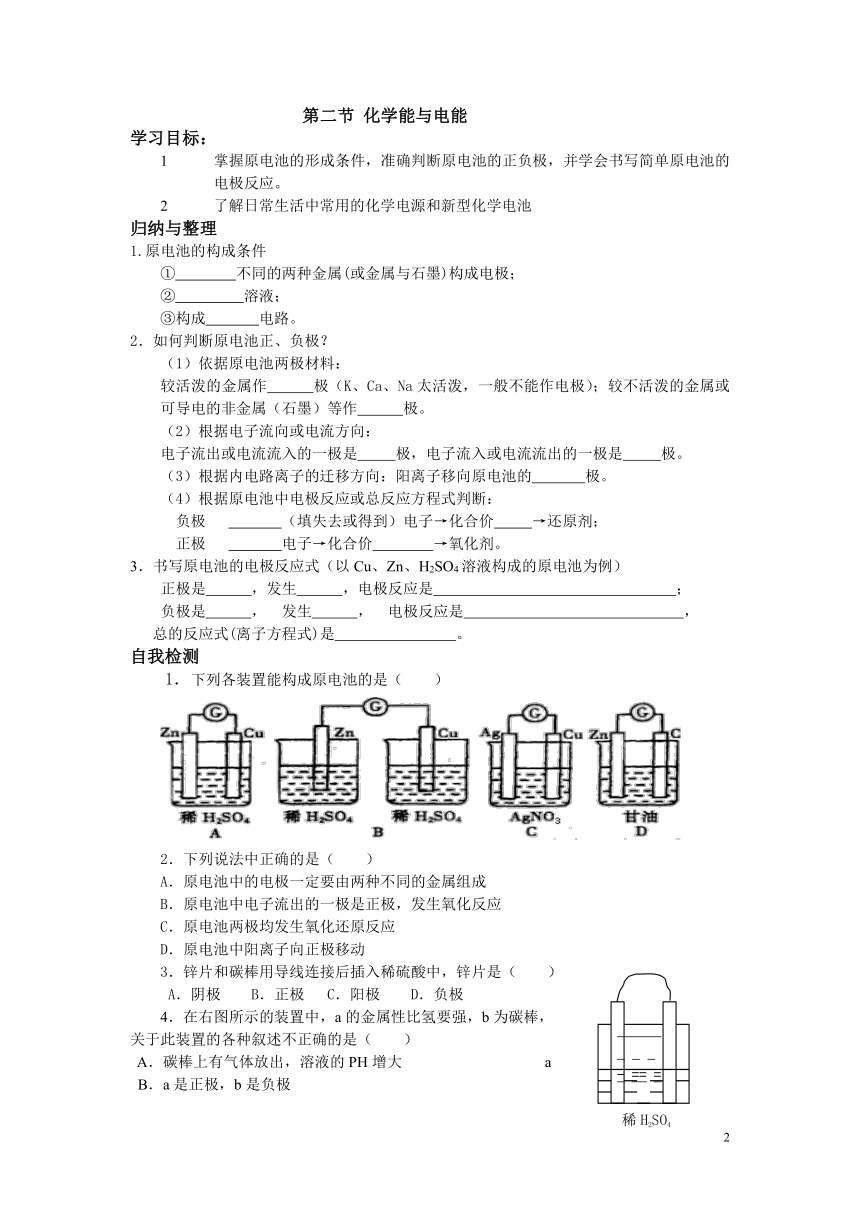
1.下列各装置能构成原电池的是( )
2.下列说法中正确的是( )
A.原电池中的电极一定要由两种不同的金属组成
B.原电池中电子流出的一极是正极,发生氧化反应
C.原电池两极均发生氧化还原反应
D.原电池中阳离子向正极移动
3.锌片和碳棒用导线连接后插入稀硫酸中,锌片是( )
A.阴极 B.正极 C.阳极 D.负极
4.在右图所示的装置中,a的金属性比氢要强,b为碳棒,
关于此装置的各种叙述不正确的是( )
A.碳棒上有气体放出,溶液的PH增大 a b
B.a是正极,b是负极
C.导线中有电子流动,电子从a极流到b极
D.a极上发生了氧化反应
5.实验室准备较快地制取氢气,可采用的方法是( )
A.用纯锌与稀硫酸反应 B.用粗锌与稀硫酸反应
C.用粗锌与稀硝酸反应 D.在CuSO4溶液中浸泡过的纯锌与稀硫酸反应。
6.人造地球卫星上使用的一种高能电池——银锌蓄电池,其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断氧化银是( )
A、负极,被氧化 B、正极,被还原
C、负极,被还原 D、正极,被氧化
7.根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W做电极组成的原电池,电极反应为W2++2e-=W,Y-2e-=Y2+。可知X、Y、W、Z的还原性由强到弱的顺序是( )
A、X>Z>Y>W B、Z>W>X>Y
C、Z>X>Y>W D、Z>Y>X>W
8. 有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是
A.d、c、a、b B.d、a、b、c C.d、b、a、c D.b、a、d、c
9.原电池是一种 装置。电子的流动方向是从 极到 极;电流方向是从 极到 极。
10写出下列原电池的电极反应式和总反应的离子方程式
正负极组 电解质 别 溶液 负极 正极 电解质溶液
(1) Zn Cu CuCl2
(2) Fe Ag H2SO4
(3) Cu Ag AgNO3
(1)负极 正极
总反应式
(2)负极 正极
总反应式
(3)负极 正极
总反应式
第三节 化学反应的速率和限度
学习目标:
1 认识化学反应的速率和化学反应的限度。
2.了解化学反应速率的概念及表示方法,认识浓度、压强、温度、催化剂和固体表面积对化学反应速率的影响。
归纳与整理
1.如何表示化学反应速率?
(1)表示方法:用单位时间内反应物 的减少量或者生成物 的增加量来表示,浓度用 为单位,时间常用 、 或者 为单位,那么化学反应速率的单位就是 、 或mol/(L h)。
(2)化学反应速率的数学表达式为:v= 。
化学反应速率是 速率(填“平均”或“瞬时”),而不是 速率;
2.影响化学反应速率的因素有哪些?
外因:浓度、压强、温度、催化剂、固体表面积等。
(1)浓度:在其他条件不变时,增大反应物的浓度,化学反应速率 ;减小反应物的浓度, 化学反应速率 。
(2)压强:在其他条件不变时,增大气体反应体系压强,化学反应速率 ;反之则慢。
(3)温度:在其他条件不变时,升高温度,化学反应速率 ;降低温度,化学反应速率 。
(4)催化剂:使用催化剂,化学反应速率 。
自我检测
1.化学反应速率主要由物质本身的性质决定的,影响化学反应速率的因素还有
、 、 、 、 等。
2.面粉厂必须严禁烟火的主要原因是( )。
A.防止火灾发生 B.防止污染面粉 C.吸烟有害健康
D.面粉颗粒极小,当其扩散在空气中与空气充分接触,一旦引发反应,极易发生爆炸
3.在溶液中发生的反应,对反应速率不发生影响的因素是( )。
A.温度 B.压强 C.浓度 D.催化剂
4.在反应:C+CO22CO中,可使反应速率增大的措施是( )。
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
A.①②③④ B.②③④⑤ C.①②③ D.②③④
5.在2 L的密闭容器中,充人2 molN2和3 molH2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以N2的浓度变化表示的反应速率为 。
6.分析下列实例,根据已有的知识和经验,填写下表。
实 例 影响速率的因素 如何影响
夏天食物易变质
硫在氧气中比在空气中燃烧快
粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快
氯酸钾与二氧化锰混合共热可快速产生氧气
工业合成氨通常要在高压下进行
7.在28℃时,鲜牛奶约4 h变酸,但在5℃的冰箱内,鲜牛奶要48 h后才变酸。原因是 。
8.燃料充分燃烧的条件是 。
- == = = =
稀H2SO4
PAGE
1
第一节 化学能与热能
学习目标:
1 知道化学键的断裂和形成是化学反应中能量变化的主要原因,了解吸热反应和放热反应。知道常见的吸热反应和放热反应。
2通过生活中的实例了解化学能与热能的相互转化
归纳与整理
1.当物质发生化学反应时,断开反应物中的化学键要 能量,而形成生成物的化学键要 能量; 是化学反应中能量变化的主要原因。
2.一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于 。
具体情况:
a 反应物的总能量 生成物的总能量,则化学反应放出能量;
b 反应物的总能量 生成物的总能量,则化学反应吸收能量。
3.化学反应中的能量变化通常表现为 的变化,吸热或者放热。例如Ba(OH)2·8H2O和NH4Cl之间的反应、灼热的碳和水制取水煤气的反应以及KClO3的分解等都是 反应;例如活泼金属和酸反应、物质的燃烧反应以及酸碱中和反应等都是 反应。
自我检测
1.下列反应属于放热反应的是( )
A.铁与盐酸 B.C和CO2 C.碳酸钙的分解 D.Ba(OH)2·8H2O与NH4Cl晶体
2.下列反应过程一定吸收能量的是( )
A.化合反应 B.分解反应 C.分子拆成原子 D.原子组成分子
3.下列说法中错误的是( )
A.化学反应中的能量变化通常表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.需要加热才能发生的反应一定是吸热反应
D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
4. 已物金刚石在一定条件下转化为石墨是放热的,则金刚石和石墨比较,能量“贮存”高的是( )
A.石墨 B.金刚石 C.一样高 D.无法判断
5. 下列说法正确的是( )
A.化学反应中的能量变化,通常表现为热量的变化
B.煤和石油属于可再生能源
C.要使燃料燃烧只需要大量的氧气
D.汽车排出大量尾气中含有CO会污染大气
6. 下列不是化石能源的是( )
A.氢气 B.煤 C.石油 D.天然气
7.下列叙述正确的是 ( )
A、电能是二级能源 B、水力是二级能源C、天然气是一级能源 D、水煤气是一级能源
8 已知反应:X + Y =M + N 为放热反应,对该反应的下列说法中正确的是( )
A.X 的能量一定高于 M B.Y 的能量一定高于 N
C.X 和 Y 的总能量一定高于 M 和 N 的总能量
D.因为该反应是放热反应,故不必加热反应就一定能发生
第二节 化学能与电能
学习目标:
1 掌握原电池的形成条件,准确判断原电池的正负极,并学会书写简单原电池的电极反应。
2 了解日常生活中常用的化学电源和新型化学电池
归纳与整理
1.原电池的构成条件
① 不同的两种金属(或金属与石墨)构成电极;
② 溶液;
③构成 电路。
2.如何判断原电池正、负极?
(1)依据原电池两极材料:
较活泼的金属作 极(K、Ca、Na太活泼,一般不能作电极);较不活泼的金属或可导电的非金属(石墨)等作 极。
(2)根据电子流向或电流方向:
电子流出或电流流入的一极是 极,电子流入或电流流出的一极是 极。
(3)根据内电路离子的迁移方向:阳离子移向原电池的 极。
(4)根据原电池中电极反应或总反应方程式判断:
负极 (填失去或得到)电子→化合价 →还原剂;
正极 电子→化合价 →氧化剂。
3.书写原电池的电极反应式(以Cu、Zn、H2SO4溶液构成的原电池为例)
正极是 ,发生 ,电极反应是 ;
负极是 , 发生 , 电极反应是 ,
总的反应式(离子方程式)是 。
自我检测
1.下列各装置能构成原电池的是( )
2.下列说法中正确的是( )
A.原电池中的电极一定要由两种不同的金属组成
B.原电池中电子流出的一极是正极,发生氧化反应
C.原电池两极均发生氧化还原反应
D.原电池中阳离子向正极移动
3.锌片和碳棒用导线连接后插入稀硫酸中,锌片是( )
A.阴极 B.正极 C.阳极 D.负极
4.在右图所示的装置中,a的金属性比氢要强,b为碳棒,
关于此装置的各种叙述不正确的是( )
A.碳棒上有气体放出,溶液的PH增大 a b
B.a是正极,b是负极
C.导线中有电子流动,电子从a极流到b极
D.a极上发生了氧化反应
5.实验室准备较快地制取氢气,可采用的方法是( )
A.用纯锌与稀硫酸反应 B.用粗锌与稀硫酸反应
C.用粗锌与稀硝酸反应 D.在CuSO4溶液中浸泡过的纯锌与稀硫酸反应。
6.人造地球卫星上使用的一种高能电池——银锌蓄电池,其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断氧化银是( )
A、负极,被氧化 B、正极,被还原
C、负极,被还原 D、正极,被氧化
7.根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W做电极组成的原电池,电极反应为W2++2e-=W,Y-2e-=Y2+。可知X、Y、W、Z的还原性由强到弱的顺序是( )
A、X>Z>Y>W B、Z>W>X>Y
C、Z>X>Y>W D、Z>Y>X>W
8. 有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是
A.d、c、a、b B.d、a、b、c C.d、b、a、c D.b、a、d、c
9.原电池是一种 装置。电子的流动方向是从 极到 极;电流方向是从 极到 极。
10写出下列原电池的电极反应式和总反应的离子方程式
正负极组 电解质 别 溶液 负极 正极 电解质溶液
(1) Zn Cu CuCl2
(2) Fe Ag H2SO4
(3) Cu Ag AgNO3
(1)负极 正极
总反应式
(2)负极 正极
总反应式
(3)负极 正极
总反应式
第三节 化学反应的速率和限度
学习目标:
1 认识化学反应的速率和化学反应的限度。
2.了解化学反应速率的概念及表示方法,认识浓度、压强、温度、催化剂和固体表面积对化学反应速率的影响。
归纳与整理
1.如何表示化学反应速率?
(1)表示方法:用单位时间内反应物 的减少量或者生成物 的增加量来表示,浓度用 为单位,时间常用 、 或者 为单位,那么化学反应速率的单位就是 、 或mol/(L h)。
(2)化学反应速率的数学表达式为:v= 。
化学反应速率是 速率(填“平均”或“瞬时”),而不是 速率;
2.影响化学反应速率的因素有哪些?
外因:浓度、压强、温度、催化剂、固体表面积等。
(1)浓度:在其他条件不变时,增大反应物的浓度,化学反应速率 ;减小反应物的浓度, 化学反应速率 。
(2)压强:在其他条件不变时,增大气体反应体系压强,化学反应速率 ;反之则慢。
(3)温度:在其他条件不变时,升高温度,化学反应速率 ;降低温度,化学反应速率 。
(4)催化剂:使用催化剂,化学反应速率 。
自我检测
1.化学反应速率主要由物质本身的性质决定的,影响化学反应速率的因素还有
、 、 、 、 等。
2.面粉厂必须严禁烟火的主要原因是( )。
A.防止火灾发生 B.防止污染面粉 C.吸烟有害健康
D.面粉颗粒极小,当其扩散在空气中与空气充分接触,一旦引发反应,极易发生爆炸
3.在溶液中发生的反应,对反应速率不发生影响的因素是( )。
A.温度 B.压强 C.浓度 D.催化剂
4.在反应:C+CO22CO中,可使反应速率增大的措施是( )。
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
A.①②③④ B.②③④⑤ C.①②③ D.②③④
5.在2 L的密闭容器中,充人2 molN2和3 molH2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以N2的浓度变化表示的反应速率为 。
6.分析下列实例,根据已有的知识和经验,填写下表。
实 例 影响速率的因素 如何影响
夏天食物易变质
硫在氧气中比在空气中燃烧快
粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快
氯酸钾与二氧化锰混合共热可快速产生氧气
工业合成氨通常要在高压下进行
7.在28℃时,鲜牛奶约4 h变酸,但在5℃的冰箱内,鲜牛奶要48 h后才变酸。原因是 。
8.燃料充分燃烧的条件是 。
- == = = =
稀H2SO4
PAGE
1
