化学平衡(二)[下学期]
文档属性
| 名称 | 化学平衡(二)[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 249.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-18 00:00:00 | ||
图片预览





文档简介
课件20张PPT。
化学平衡图像 高三第一轮复习湘乡四中化学组
2005年9月一. 浓度 时间图?
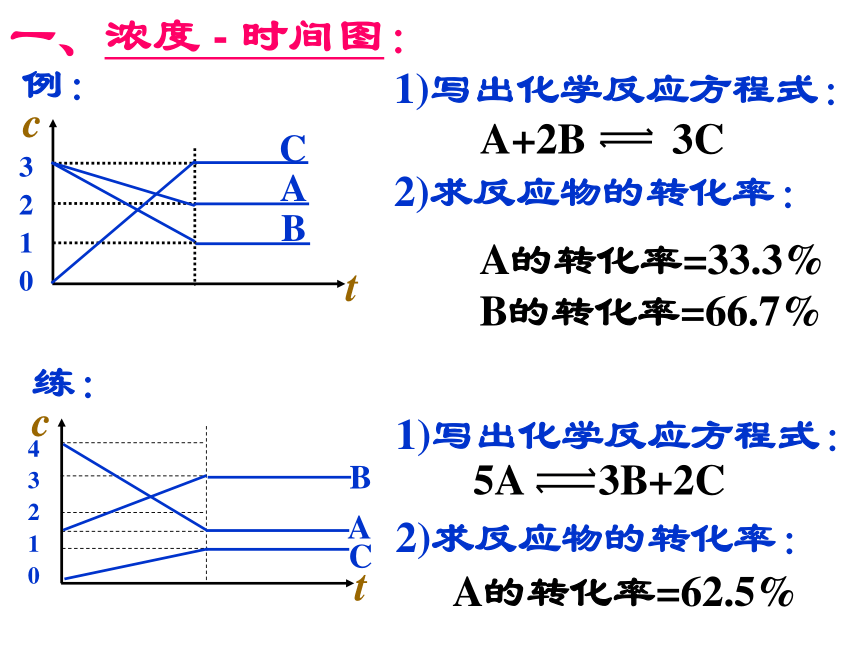
此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况。解题时要注意各物质曲线的折点(达平衡时刻),各物质浓度变化的内在联系及比例符合化学方程式中化学计量数关系等情况。?一、浓度 - 时间图:
1)写出化学反应方程式:
2)求反应物的转化率:A+2B 3C1)写出化学反应方程式:
2)求反应物的转化率:例:练:5A 3B+2CA的转化率=62.5%3 2 1 0 4 3 2 1 0A的转化率=33.3%
B的转化率=66.7%二. 速率 时间图?
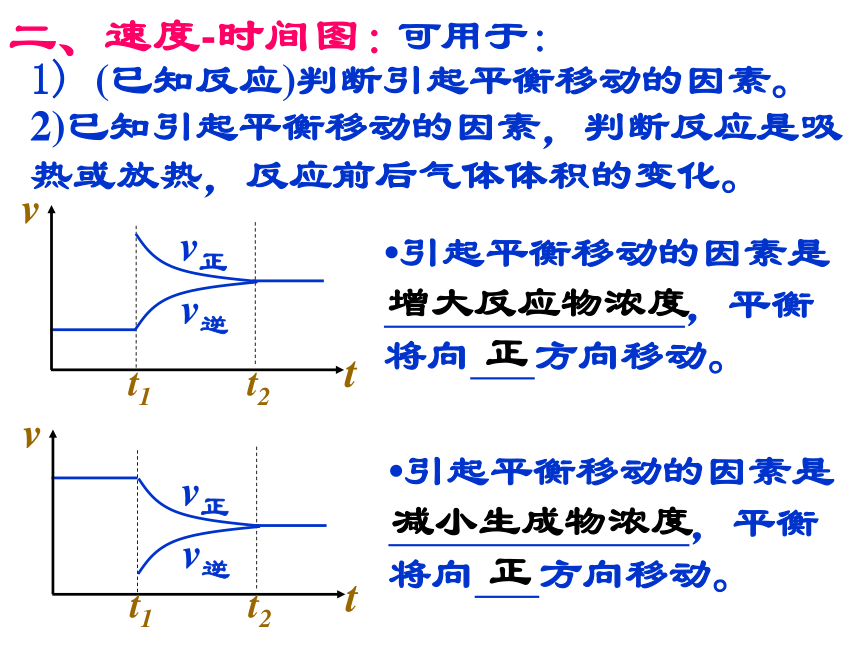
此类图象定性地揭示了v正、v逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向。二、速度-时间图: 可用于:
1) (已知反应)判断引起平衡移动的因素。
2)已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。?引起平衡移动的因素是
,平衡
将向 方向移动。增大反应物浓度正?引起平衡移动的因素是
,平衡
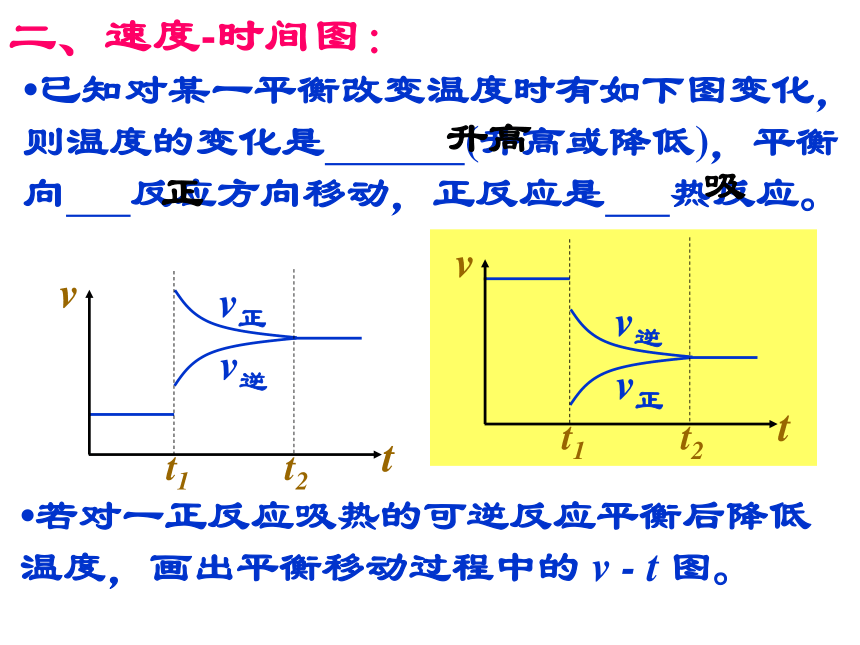
将向 方向移动。减小生成物浓度正二、速度-时间图:?已知对某一平衡改变温度时有如下图变化,则温度的变化是 (升高或降低),平衡向 反应方向移动,正反应是 热反应。升高正吸?若对一正反应吸热的可逆反应平衡后降低温度,画出平衡移动过程中的 v - t 图。二、速度-时间图:?对于mA(g)+nB(g) pC(g)+qD(g),改变压强时有如下图变化,则压强变化是 (增大或减小),平衡向 反应方向移动,m+n
(>、<、=)p+q。增大逆p+q,平衡后降低压强时,画出相关的 v – t 图。二、速度-时间图:?对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。 ?由于v正、v逆均有不同程
度的增大,引起平衡移动
的因素可能是 a.升高温度
b.增大压强。根据反应方
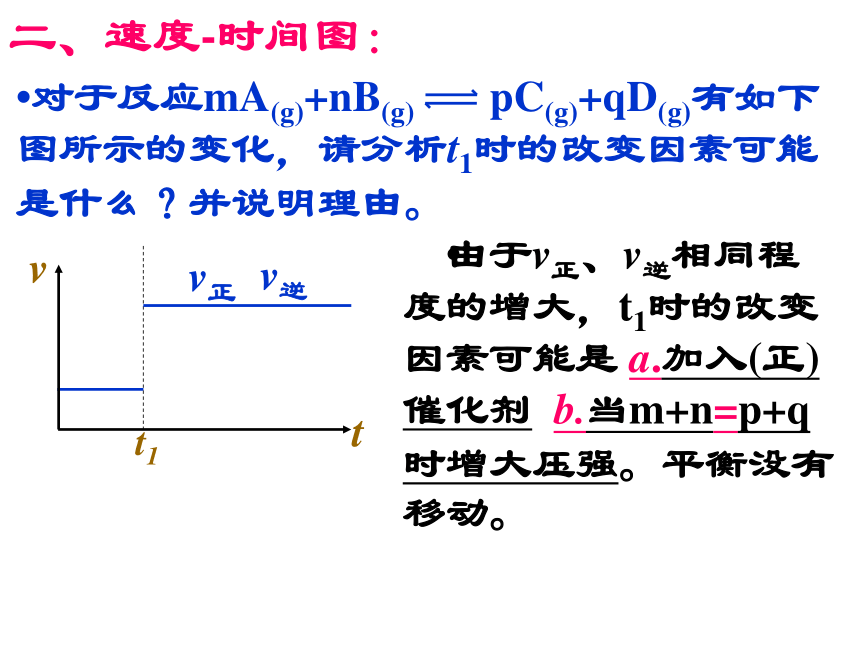
程式,升高温度平衡向逆反应方向移动,与图示相符;增大压强平衡向正反应方向移动,与图示不相符。故此题中引起平衡移动的因素是升高温度。?对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。二、速度-时间图: ?由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。三. 转化率(含量) 时间 温度(压强)图?
这类图象反映了反应物或生成物的量在不同温度(压强)下对时间的关系,解题时要注意一定条件下物质含量不再改变时,应是化学反应达到平衡的特征。?三、某物质的转化率(或百分含量)-时间-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应 热?m+n p+q?正反应 热?m+n p+q 吸<放=三、某物质的转化率(或百分含量)-时间-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)P1 P2; m+n p+qT1 T2;正反应 热吸<<>P1 P2; m+n p+q<吸四、转化率(含量) 温度(压强)图:
该类图象的纵坐标为反应物的转化率或某物质的百分含量,横坐标为温度或压强;包括等温线与等压线。?四、某物质的转化率(或百分含量)-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应放热m+n>p+q?正反应放热m+nb
cT1m+n p+q<四、某物质的转化率(或百分含量)-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应吸热m+n>p+q?正反应吸热m+n=p+q四、某物质的转化率(或百分含量)-温度(或压强)图:?对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示:
A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%A、D五、其它:?正反应吸热?正反应吸热?正反应放热?m+n一、浓度 时间图
?
二、 速率 时间图
三、转化率(含量)时间 温度(压强)图
四、转化率(含量) 温度(压强)图
化学平衡图像 高三第一轮复习湘乡四中化学组
2005年9月一. 浓度 时间图?
此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况。解题时要注意各物质曲线的折点(达平衡时刻),各物质浓度变化的内在联系及比例符合化学方程式中化学计量数关系等情况。?一、浓度 - 时间图:
1)写出化学反应方程式:
2)求反应物的转化率:A+2B 3C1)写出化学反应方程式:
2)求反应物的转化率:例:练:5A 3B+2CA的转化率=62.5%3 2 1 0 4 3 2 1 0A的转化率=33.3%
B的转化率=66.7%二. 速率 时间图?
此类图象定性地揭示了v正、v逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向。二、速度-时间图: 可用于:
1) (已知反应)判断引起平衡移动的因素。
2)已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。?引起平衡移动的因素是
,平衡
将向 方向移动。增大反应物浓度正?引起平衡移动的因素是
,平衡
将向 方向移动。减小生成物浓度正二、速度-时间图:?已知对某一平衡改变温度时有如下图变化,则温度的变化是 (升高或降低),平衡向 反应方向移动,正反应是 热反应。升高正吸?若对一正反应吸热的可逆反应平衡后降低温度,画出平衡移动过程中的 v - t 图。二、速度-时间图:?对于mA(g)+nB(g) pC(g)+qD(g),改变压强时有如下图变化,则压强变化是 (增大或减小),平衡向 反应方向移动,m+n
(>、<、=)p+q。增大逆p+q,平衡后降低压强时,画出相关的 v – t 图。二、速度-时间图:?对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。 ?由于v正、v逆均有不同程
度的增大,引起平衡移动
的因素可能是 a.升高温度
b.增大压强。根据反应方
程式,升高温度平衡向逆反应方向移动,与图示相符;增大压强平衡向正反应方向移动,与图示不相符。故此题中引起平衡移动的因素是升高温度。?对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。二、速度-时间图: ?由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。三. 转化率(含量) 时间 温度(压强)图?
这类图象反映了反应物或生成物的量在不同温度(压强)下对时间的关系,解题时要注意一定条件下物质含量不再改变时,应是化学反应达到平衡的特征。?三、某物质的转化率(或百分含量)-时间-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应 热?m+n p+q?正反应 热?m+n p+q 吸<放=三、某物质的转化率(或百分含量)-时间-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)P1 P2; m+n p+qT1 T2;正反应 热吸<<>P1 P2; m+n p+q<
该类图象的纵坐标为反应物的转化率或某物质的百分含量,横坐标为温度或压强;包括等温线与等压线。?四、某物质的转化率(或百分含量)-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应放热m+n>p+q?正反应放热m+n
cT1m+n p+q<四、某物质的转化率(或百分含量)-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应吸热m+n>p+q?正反应吸热m+n=p+q四、某物质的转化率(或百分含量)-温度(或压强)图:?对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示:
A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%A、D五、其它:?正反应吸热?正反应吸热?正反应放热?m+n
?
二、 速率 时间图
三、转化率(含量)时间 温度(压强)图
四、转化率(含量) 温度(压强)图
