化学反应的速率和限度(第二课时)[下学期]
文档属性
| 名称 | 化学反应的速率和限度(第二课时)[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 236.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-15 11:21:00 | ||
图片预览




文档简介
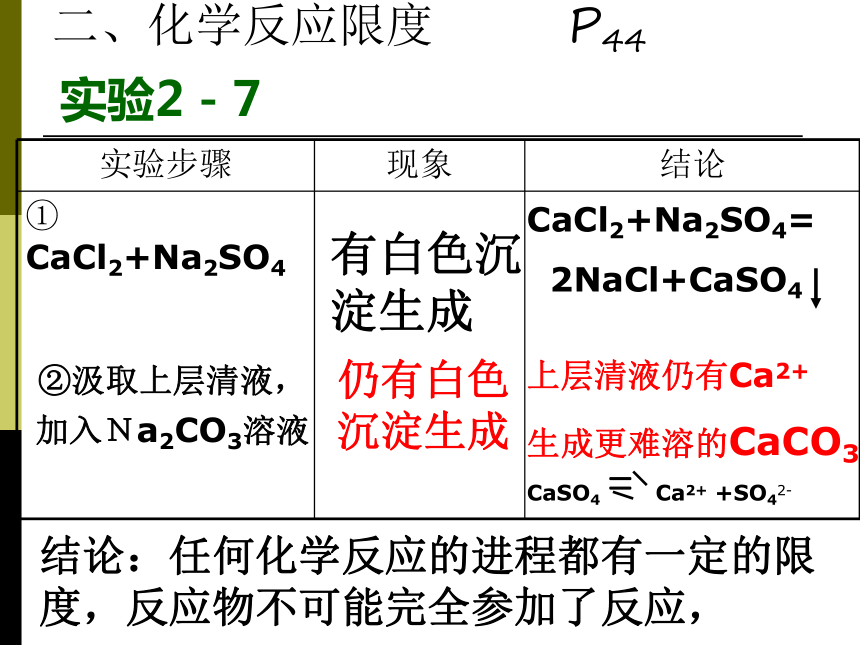
课件13张PPT。第三节 化学反应速率和限度南海艺术高中自然组第二课时思考与交流: 一个反应在实际进行时,反应物能否按化学方程式中相应的物质的计算关系完全转变为生成物?如果能,是在什么条件下?如果不能,原因是什么?二、化学反应限度 P44实验2-7有白色沉淀生成②汲取上层清液,
加入Na2CO3溶液
仍有白色沉淀生成CaCl2+Na2SO4=
2NaCl+CaSO4
上层清液仍有Ca2+
生成更难溶的CaCO3CaSO4 = Ca2+ +SO42-结论:任何化学反应的进程都有一定的限度,反应物不可能完全参加了反应,可逆反应一定条件下,既能正向又能逆向进行的化学反应叫可逆反应。
如:2HI(g) H2(g) + I2(g); 可逆反应。
2KClO3 = 2KCl + 2O2(g) 不可逆反应。
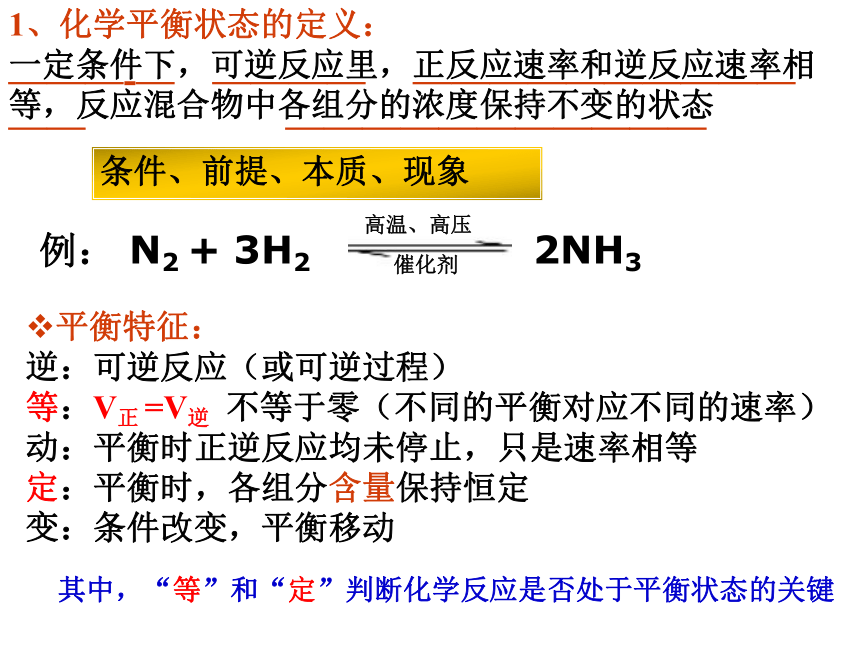
大多数化学反应都是可逆反应。少数反应,在逆反应条件还没建立时反应物已经耗尽了,不能建立平衡,是不可逆反应。1、化学平衡状态的定义:
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态———-— ———— ——————————
—— ———————————平衡特征:
逆
等
动
定
变:可逆反应(或可逆过程)
:V正 =V逆 不等于零(不同的平衡对应不同的速率)
:平衡时正逆反应均未停止,只是速率相等
:平衡时,各组分含量保持恒定
:条件改变,平衡移动条件、前提、本质、现象其中,“等”和“定”判断化学反应是否处于平衡状态的关键例: N2 + 3H2 2NH3高温、高压
催化剂三、化学反应条件的控制定向爆破思考与交流:从前面的定向爆破录像中,你可以得到什么启示?
回忆你在实验室进行的或观察过的化学实验,及在生活中见到过的涉及化学变化的现象或事例,要使反应符合或接近人们的期望,你认为应如何控制反应的条件?角色扮演 现在,假设你是一名工程师,你要使到你工厂的煤尽可能的完全燃烧,提高煤的燃烧效率,你认为应该从哪些方面进行分析?怎样提高煤的燃烧效率?煤的状态与燃烧的速率有何关系?与煤的充分燃烧有何关系?
空气的用量对煤的充分燃烧有什么影响?原因是什么?
应选用什么样的炉膛材料?
如何充分利用煤燃烧后的废气中的热量?归纳:尽可能的使煤充分燃烧,提高能量的转化率,关键是燃料与空气或氧气要尽可能充分的接触,且空气要适当过量。燃料与空气要有足够大的接触面积。
尽可能充分地利用燃料燃烧所放出来的热能,提高热能的利用率。
实质是从多方面控制燃烧反应的条件,它的意义在于节约能源,节省资源,减少污染等。为什么要控制反应的条件:对有利于我们的或我们需要的化学反应,要想办法增大反应速率.并提高原料的利用率或转化率.
对有害于我们的或我们不需要的化学反应,要设法降低反应的速率,或隔离会引起反应的物质.
对应用于特定环境下及特殊需要的化学反应,则需要对反应的条件进行特殊的控制.
练习:在下列事实中,什么因素影响了化学反应的速率?
1、集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸
2、黄铁矿煅烧时要粉粹成细小的矿粒
3、加热氯酸钾难以放出气体,加入少量的MnO2很快产生气体
4、夏天的食品容易发霉,冬天就不那么容易
5、同体积、同浓度的盐酸中放入同样大小的锌粒和镁块,产生的气体有快有慢1、化学反应速率及其表示方法。
2、影响化学反应速率的因素。
3、化学反应限度和化学平衡状态,以及化学平衡状态的特征判断。
4、化学反应条件的控制。本节小结
加入Na2CO3溶液
仍有白色沉淀生成CaCl2+Na2SO4=
2NaCl+CaSO4
上层清液仍有Ca2+
生成更难溶的CaCO3CaSO4 = Ca2+ +SO42-结论:任何化学反应的进程都有一定的限度,反应物不可能完全参加了反应,可逆反应一定条件下,既能正向又能逆向进行的化学反应叫可逆反应。
如:2HI(g) H2(g) + I2(g); 可逆反应。
2KClO3 = 2KCl + 2O2(g) 不可逆反应。
大多数化学反应都是可逆反应。少数反应,在逆反应条件还没建立时反应物已经耗尽了,不能建立平衡,是不可逆反应。1、化学平衡状态的定义:
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态———-— ———— ——————————
—— ———————————平衡特征:
逆
等
动
定
变:可逆反应(或可逆过程)
:V正 =V逆 不等于零(不同的平衡对应不同的速率)
:平衡时正逆反应均未停止,只是速率相等
:平衡时,各组分含量保持恒定
:条件改变,平衡移动条件、前提、本质、现象其中,“等”和“定”判断化学反应是否处于平衡状态的关键例: N2 + 3H2 2NH3高温、高压
催化剂三、化学反应条件的控制定向爆破思考与交流:从前面的定向爆破录像中,你可以得到什么启示?
回忆你在实验室进行的或观察过的化学实验,及在生活中见到过的涉及化学变化的现象或事例,要使反应符合或接近人们的期望,你认为应如何控制反应的条件?角色扮演 现在,假设你是一名工程师,你要使到你工厂的煤尽可能的完全燃烧,提高煤的燃烧效率,你认为应该从哪些方面进行分析?怎样提高煤的燃烧效率?煤的状态与燃烧的速率有何关系?与煤的充分燃烧有何关系?
空气的用量对煤的充分燃烧有什么影响?原因是什么?
应选用什么样的炉膛材料?
如何充分利用煤燃烧后的废气中的热量?归纳:尽可能的使煤充分燃烧,提高能量的转化率,关键是燃料与空气或氧气要尽可能充分的接触,且空气要适当过量。燃料与空气要有足够大的接触面积。
尽可能充分地利用燃料燃烧所放出来的热能,提高热能的利用率。
实质是从多方面控制燃烧反应的条件,它的意义在于节约能源,节省资源,减少污染等。为什么要控制反应的条件:对有利于我们的或我们需要的化学反应,要想办法增大反应速率.并提高原料的利用率或转化率.
对有害于我们的或我们不需要的化学反应,要设法降低反应的速率,或隔离会引起反应的物质.
对应用于特定环境下及特殊需要的化学反应,则需要对反应的条件进行特殊的控制.
练习:在下列事实中,什么因素影响了化学反应的速率?
1、集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸
2、黄铁矿煅烧时要粉粹成细小的矿粒
3、加热氯酸钾难以放出气体,加入少量的MnO2很快产生气体
4、夏天的食品容易发霉,冬天就不那么容易
5、同体积、同浓度的盐酸中放入同样大小的锌粒和镁块,产生的气体有快有慢1、化学反应速率及其表示方法。
2、影响化学反应速率的因素。
3、化学反应限度和化学平衡状态,以及化学平衡状态的特征判断。
4、化学反应条件的控制。本节小结
