新人教版必修2第二章第3节化学反应速率和限度当前适用精心制作效果很好建议下载共3课时[下学期]
文档属性
| 名称 | 新人教版必修2第二章第3节化学反应速率和限度当前适用精心制作效果很好建议下载共3课时[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-04-09 00:00:00 | ||
图片预览








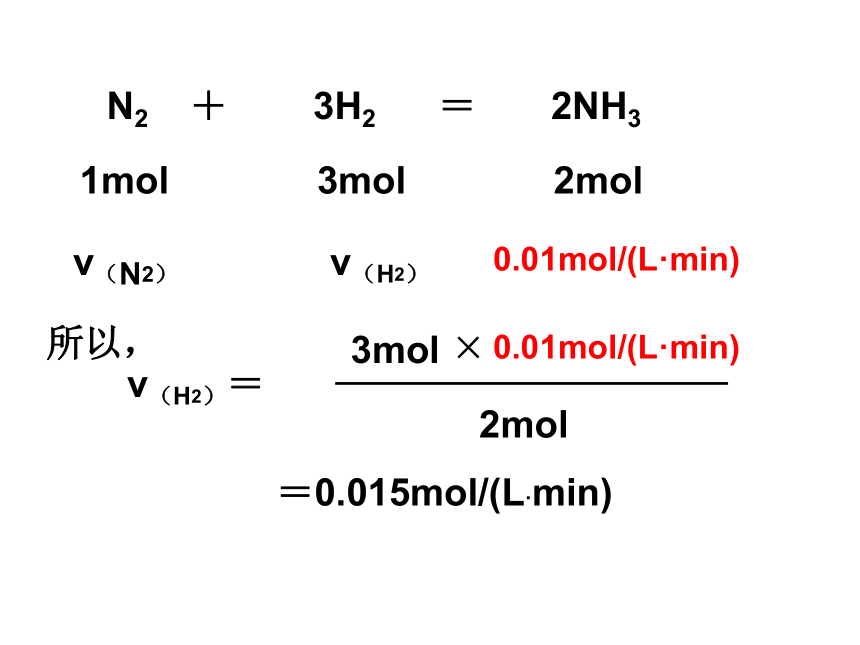
文档简介
课件45张PPT。第三节 化学反应的速率和限度 第二章 化学反应与能量一、化学反应的速率【思考与交流】
你了解下列化学变化过程进行的快慢吗?反应的快慢与我们有什么关系?大理石雕像受到酸雨的腐蚀 不同的化学反应进行的快慢千差万别,“快”与“慢”是相对而言的,在科学研究和实际应用中,需要用一个统一的定量标准来衡量或比较。与物理学中物体的运动快慢用“速度”表示相类似,化学反应过程中进行的快慢用“反应速率”来表示。一、化学反应速率及其表示方法:
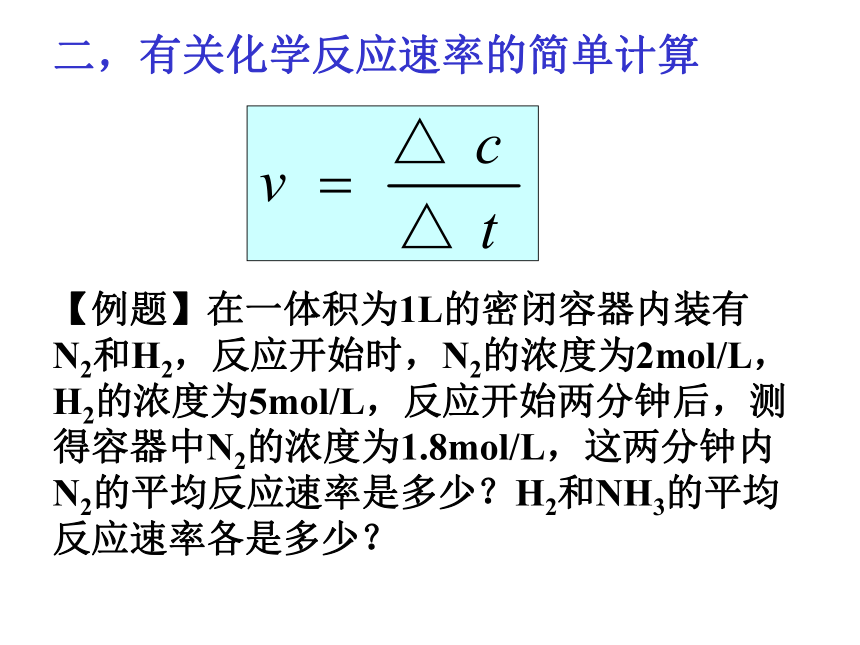
用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。浓度常用mol.L-1,时间常用s,min。化学反应的速率单位为:mol/(L·min)或mol/(L·s)等数学表达式为:【例题】在一体积为1L的密闭容器内装有N2和H2,反应开始时,N2的浓度为2mol/L,H2的浓度为5mol/L,反应开始两分钟后,测得容器中N2的浓度为1.8mol/L,这两分钟内N2的平均反应速率是多少?H2和NH3的平均反应速率各是多少? 二,有关化学反应速率的简单计算【分析】 N2 + 3H2 2NH3
开始浓度mol/L 2 5 0
开始物质的量mol
2min后物质的量mol
2min后浓度mol/L
浓度变化mol/L2 5 01.8 4.4 0.41.8 4.4 0.4-0.2 -0.6 +0.4【思考】
1、计算出的速率是瞬时速率还是平均速率?
2、同一反应中不同物质表示的速率数值上是否相等?意义是否一致?
3、同一反应中各物质的速率有何关系?5, 可以用某一反应物表示也可以用某一生成物表示,其数值不一定相等,但这些数值表示的意义相同,因此表示速率时应标明是什么物质的反应速率;
1,化学反应速率是用来衡量化学反应进行的快慢程度的物理量 2,决定化学反应速率的主要因素是反应物的性质 6,各物质的速率之比等于方程式计量数之比3,化学反应速率都取正值,4是某一段时间内的平均速率,而非瞬时速率;
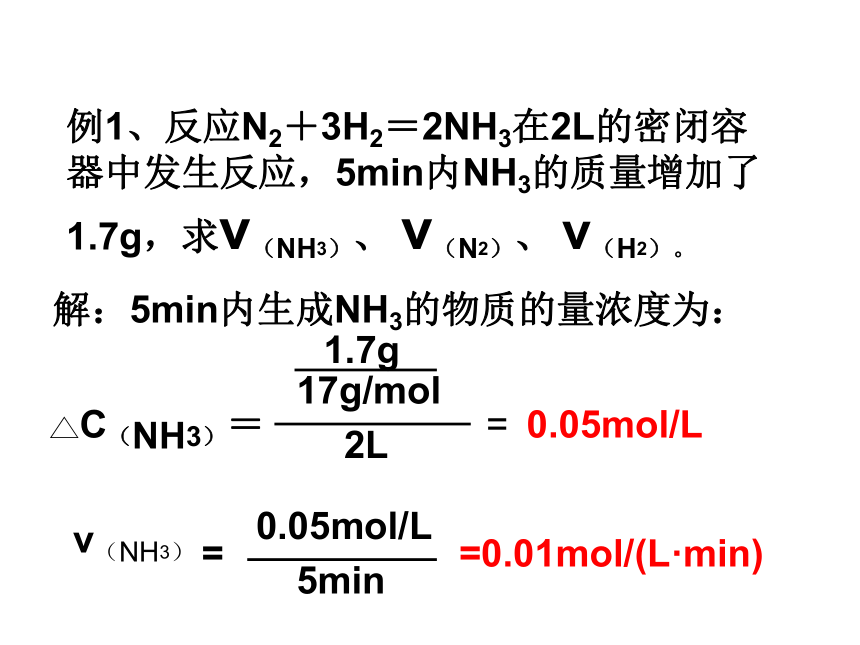
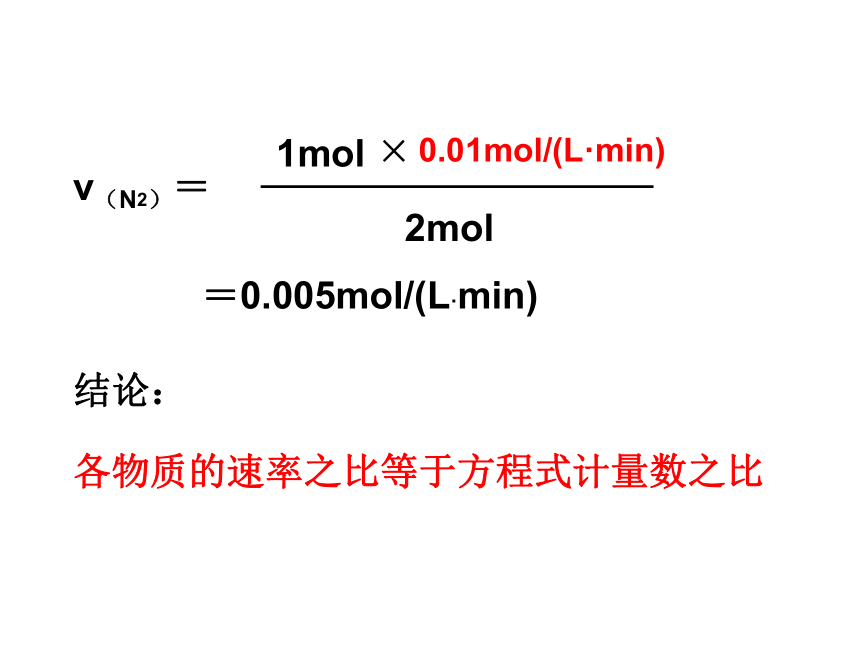
解:5min内生成NH3的物质的量浓度为:0.05mol/L=0.01mol/(L·min)例1、反应N2+3H2=2NH3在2L的密闭容器中发生反应,5min内NH3的质量增加了1.7g,求ν(NH3)、 ν(N2)、 ν(H2)。N2 + 3H2 = 2NH31mol3mol2mol0.01mol/(L·min)ν(H2)ν(N2)所以,ν(H2)=3mol×0.01mol/(L·min)2mol=0.015mol/(L·min)ν(N2)=1mol×0.01mol/(L·min)2mol=0.005mol/(L·min)结论:各物质的速率之比等于方程式计量数之比练习:1、在一定条件下,mA + nB = pC的反应中,各物质的化学反应速率为v(A)=amol/(L·s),
v(B)=0.5amol/(L·s),
v(C)=amol/(L·s),则该反应的化学方程式为:______________________答案: 2A+B=2C对于下面反应则有: 练习2、反应A(g) + 3B(g)=2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol,有关反应速率正确的是( )
A、V(A)=0.005mol/(L·s)
B、V(C)=0.002mol/(L·s)
C、V(B)=V(A)/3
D、V(A)=0.001mol/(L·s)A反应A+3B=4C+2D,在不同条件下反应,其平均速率Vx(表示反应物的消耗速率或生成物的生成速率)如下所示,则反应速率最快的是
A.VA=0.4mol/(L·s) B.VB=0.8mol/(L·s)
C.VC=1.2mol/(L·s) D.V D=0.7mol/(L·s)答案:A 注意:比较反应的快慢,必须比较用相同物质表示的速率大小 练习3答案: aqtV/m mol 在体积为VL的密闭容器中进行如下反应:mA(g)+nB(g)=pC(g)+qD(g)。用A物质的浓度变化表示的平均反应速率为a mol·L-1·min-1,则t min时,D物质增加的物质的量是 。 练习4反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率V(X)(反应物的消耗速率或产物的生成速率)可表示为
A.V(NH3)=0.0101mol·L-1·s-1 B.V(O2)=0.0010mol·L-1·s-1
C.V(NO)=0.0010mol·L-1·s-1 D.V(H2O)=0.045mol·L-1·s-1 答案: C 练习5小结化学反应速率定义表示方法:单位影响因素内因:反应物本身性质外因:浓度、温度、
催化剂、压强等1. 我们能够计算出一个化学反应的速率,能否改变化学反应速率呢? 2. 影响化学反应速率的主要因素是什么?我们人类能否控制这个因素? 3. 我们能否通过改变外在条件来改变化学反应的速率呢? 有哪些条件能够影响化学反应的速率呢?下面我们通过实验来探究二、外界条件对化学反应速率的影响1、内因:参与反应的物质本身的性质,起决定作用
2、外因:外界因素实验2-6立即有大量气泡产生有大量气泡产生溶液中有少量气泡出现不用催化剂,化学反应速率很小1,催化剂对过氧化氢的分解速率的影响在其它条件不变时,催化剂通常可以加快化学反应速率;
不同催化剂对同一个反应的催化能力不同。 自学P43 神奇的催化剂催化剂能极大地改变反应速率,而自身的
组成、化学性质和质量在反应前后不发生
变化,具有高度的选择性(或专一性)物理性质呢?改变吗?为什么选用FeCl3作催化剂?
怎样才能快速得到三支速率一致的试管?
如何快速得到三种温度不同的水? H2O2在不同温度条件下的分解情况 将试管中的溶液分装
到另外两支试管中,
然后放入装有三种不同
温度的水的烧杯中。2,温度对化学反应速度的影响溶液中产生气泡的速率很快温度越高,化学反应速率越快溶液中有气泡产生,且速率较快温度的高低,能够影响化学反应速率的大小溶液中产生气泡的速率较慢温度越低,化学反应速率越慢升高反应体系的温度,化学反应速率加快;2,温度对化学反应速度的影响实验2-5实验步骤:
截取3cm镁条,用砂纸打磨掉表面氧化物
组装好实验装置
量取40mL 0.5 mol/L HCl倒入锥形瓶中
将镁条投入锥形瓶中,立刻塞好橡皮塞
每隔5秒记录收集到氢气的体积,至第90秒
清洗锥形瓶
量取40 mL 2 mol/L HCl倒入锥形瓶中,重复上述实验
将所得数据绘成曲线3,浓度对化学反应的影响浓度越大,化学反应越快小结:当其它条件不变时,使用催化剂可以加快化学反应速率;升高反应体系的温度,化学反应速率加快;增大反应物浓度,化学反应速率加快;增大反应物之间的接触面,化学反应速率加快。除此之外,压强、紫外线、反应物状态、光等也会影响化学反应速率。阅读,思考与交流:P431、温度越低,食物变质腐败的速率越慢。这也是温度对化学反应速率的影响在生活中的应用。2、固体药品研得越细,其表面积越大,混合均匀后反应物之间接触得面积也越大,反应也迅速、充分。3、固体物质溶于水后,发生了电解质的电离,离子在溶液里受水分子作用而运动,增大了离子之间接触反应的机会,从而提高了化学反应速率。4、Zn+ H2SO4=ZnSO4+H2↑,离子方程式为:Zn+2H+=Zn2++ H2↑,C(H+)的大小影响着该反应的反应速率,气泡变稀少了,是因为C(H+)减小了,反应速率减慢,如果添加适当浓度的硫酸溶液时,由于溶液中C(H+)又迅速增大,因而反应速率加快,产生气泡的速率又加快了。实验2-7出现浑浊,
产生沉淀溶液中存在Ca2+CaCl2和Na2SO4没有反应完全CaCl2+Na2SO4== CaSO4↓(微溶)+ 2NaClCa2+ + CO32- == CaCO3↓二,化学反应的限度化学反应在实际进行时,反应物能否完全转变为生成物?加Na2SO4至不再有沉淀为止!!!化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
即正向反应和逆向反应能同时在同样的条件下进行。实验现象:加入Na2SO4溶液,有白色沉淀生。
再加入Na2CO3溶液,又有白色沉淀产生。1,不少化学反应都具有可逆性实验结论:CaSO4沉淀在溶液中存在如下可逆 反应:CaSO4=Ca2++SO42—。由于上层清液中仍有少量电离出的Ca2+,故可与CO32—反应生成更难溶的CaCO3沉淀。当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度。任何化学反应的进程都有一定的限度,只是不同反应的限度不同而已。2,平衡状态①当反应刚开始时,反应物和生成物的浓
度哪个大?
②当反应刚开始时,正反应与逆反应哪个
反应速率大?
③随着反应的进行,反应物和生成物浓度
如何变化?
④随着反应的进行,v(正)与v(逆)怎样变化?在密闭容器中加入1molH2和1mol I2发生反应⑴对于以下反应,请分析:H2(g) + I2 (g) 2HI(g) 正向反应逆向反应
(5)反应进行到什么时候会“停止”?当正反应速率与逆反应速率相等时(6)此时,反应物和生成物浓度如何变化? 反应物和生成物浓度均不再改变(7)给这个状态命名平衡状态(8)反应真的停止了吗?NO处于动态平衡0(1)0~t1:v(正)>v(逆)(2)t1以后: v(正)=v(逆)t1以后反应处于平衡状态!什么是化学平衡呢?定义:化学平衡状态在一定条件下的可逆反应里,正反应和逆
反应的速率相等,反应物和生成物浓度保
持不变的状态。化学平衡状态简称化学平衡。注意:(1)条件:一定条件下
(2)对象:可逆反应
特征: (1)定:反应物和生成物浓度保持不变
(2)动:动态平衡
(3)等: v(正)= v(逆)
如何理解V(正)=V(逆)?例如,一定条件下,可逆反应N2+3H2=2NH3,对该可逆反应,表示正、逆反应速率可以用N2或H2或NH3来表示:
(1)单位时间内,有1molN2反应掉,同时有1molN2生成
(2)单位时间内,有3molH2反应掉,同时有2molNH3反应掉
(3)单位时间内,有1molN2生成,同时有2molNH3生成
以上均表示V(正)=V(逆)三、化学反应条件的控制思考与交流P46通过讨论,我们可知,通常控制反应的条件可从浓度、温度、压强、催化剂、光照等方面考虑,使选择的条件既可提高化学反应速率又可提高化学反应的限度。下面以“提高煤的燃烧效率”为例,分析研究化学反应条件的选择。P461、煤被研得越细,粉末越小,与空气中O2得接触面积越大,燃烧越充分,反应速率越快。2、空气充足,煤燃烧生成CO2越充分,放热越多;若空气不足,则煤燃烧部分生成CO,CO排到空气中造成污染,且生成CO时,放出得热量大大减少。3、应选择保温隔热且耐热的炉膛材料;尽管煤燃烧是放热反应,但反应过程中煤燃烧需提供部分能量才能继续,因此利用煤燃烧放出的部分热量就可维持反应的继续进行,选用保温隔热材料的目的,正是为了防止热量散失。4、可将燃烧后的废气通过交换装置,供其他方面使用。5、燃料不充分燃烧有何危害?(1)产生热量少,浪费资源;(2)产生污染物,危害人体健康。6、燃料充分燃烧的条件是什么?燃料燃烧必须与空气接触,且要达到燃料的着火点,燃料充分燃烧要考虑两点:一是燃烧时要有足够多的空气,二是燃料与空气要有足够大的接触面积。小结:提高燃料的燃烧效率的措施(1)尽可能使燃料充分燃烧,提高能量的转化率。关键是,燃料与空气或氧气要尽可能充分接触,且空气要适当过量。(2)尽可能充分利用燃料燃烧所释放出的热能,提高热能的利用率。控制化学反应条件的意义:对有利的或我们需要的化学反应,要想办法增大反应速率以提高生产或工作效率,并要采取措施促进反应的完成程度以提高原料的利用率或转化率;对有害的或我们不希望发生的化学反应,要设法降低反应速率。练习1、课本习题P472、天然气和液化石油气燃烧的主要化学方程式依次为:CH4+2O2→CO2+2H2O,C3H8+5O2→3CO2+4H2O,现有一套以天然气为燃料的灶具,今改用液化石油气,应采用的正确措施是( )
A、减少空气进入量,增大石油气进入量
B、增大空气进入量,减少石油气进入量
C、减少空气进入量,减少石油气进入量
D、增大空气进入量,增大石油气进入量B作业:
1、完成课课测评
2、复习准备中段考
你了解下列化学变化过程进行的快慢吗?反应的快慢与我们有什么关系?大理石雕像受到酸雨的腐蚀 不同的化学反应进行的快慢千差万别,“快”与“慢”是相对而言的,在科学研究和实际应用中,需要用一个统一的定量标准来衡量或比较。与物理学中物体的运动快慢用“速度”表示相类似,化学反应过程中进行的快慢用“反应速率”来表示。一、化学反应速率及其表示方法:
用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。浓度常用mol.L-1,时间常用s,min。化学反应的速率单位为:mol/(L·min)或mol/(L·s)等数学表达式为:【例题】在一体积为1L的密闭容器内装有N2和H2,反应开始时,N2的浓度为2mol/L,H2的浓度为5mol/L,反应开始两分钟后,测得容器中N2的浓度为1.8mol/L,这两分钟内N2的平均反应速率是多少?H2和NH3的平均反应速率各是多少? 二,有关化学反应速率的简单计算【分析】 N2 + 3H2 2NH3
开始浓度mol/L 2 5 0
开始物质的量mol
2min后物质的量mol
2min后浓度mol/L
浓度变化mol/L2 5 01.8 4.4 0.41.8 4.4 0.4-0.2 -0.6 +0.4【思考】
1、计算出的速率是瞬时速率还是平均速率?
2、同一反应中不同物质表示的速率数值上是否相等?意义是否一致?
3、同一反应中各物质的速率有何关系?5, 可以用某一反应物表示也可以用某一生成物表示,其数值不一定相等,但这些数值表示的意义相同,因此表示速率时应标明是什么物质的反应速率;
1,化学反应速率是用来衡量化学反应进行的快慢程度的物理量 2,决定化学反应速率的主要因素是反应物的性质 6,各物质的速率之比等于方程式计量数之比3,化学反应速率都取正值,4是某一段时间内的平均速率,而非瞬时速率;
解:5min内生成NH3的物质的量浓度为:0.05mol/L=0.01mol/(L·min)例1、反应N2+3H2=2NH3在2L的密闭容器中发生反应,5min内NH3的质量增加了1.7g,求ν(NH3)、 ν(N2)、 ν(H2)。N2 + 3H2 = 2NH31mol3mol2mol0.01mol/(L·min)ν(H2)ν(N2)所以,ν(H2)=3mol×0.01mol/(L·min)2mol=0.015mol/(L·min)ν(N2)=1mol×0.01mol/(L·min)2mol=0.005mol/(L·min)结论:各物质的速率之比等于方程式计量数之比练习:1、在一定条件下,mA + nB = pC的反应中,各物质的化学反应速率为v(A)=amol/(L·s),
v(B)=0.5amol/(L·s),
v(C)=amol/(L·s),则该反应的化学方程式为:______________________答案: 2A+B=2C对于下面反应则有: 练习2、反应A(g) + 3B(g)=2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol,有关反应速率正确的是( )
A、V(A)=0.005mol/(L·s)
B、V(C)=0.002mol/(L·s)
C、V(B)=V(A)/3
D、V(A)=0.001mol/(L·s)A反应A+3B=4C+2D,在不同条件下反应,其平均速率Vx(表示反应物的消耗速率或生成物的生成速率)如下所示,则反应速率最快的是
A.VA=0.4mol/(L·s) B.VB=0.8mol/(L·s)
C.VC=1.2mol/(L·s) D.V D=0.7mol/(L·s)答案:A 注意:比较反应的快慢,必须比较用相同物质表示的速率大小 练习3答案: aqtV/m mol 在体积为VL的密闭容器中进行如下反应:mA(g)+nB(g)=pC(g)+qD(g)。用A物质的浓度变化表示的平均反应速率为a mol·L-1·min-1,则t min时,D物质增加的物质的量是 。 练习4反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率V(X)(反应物的消耗速率或产物的生成速率)可表示为
A.V(NH3)=0.0101mol·L-1·s-1 B.V(O2)=0.0010mol·L-1·s-1
C.V(NO)=0.0010mol·L-1·s-1 D.V(H2O)=0.045mol·L-1·s-1 答案: C 练习5小结化学反应速率定义表示方法:单位影响因素内因:反应物本身性质外因:浓度、温度、
催化剂、压强等1. 我们能够计算出一个化学反应的速率,能否改变化学反应速率呢? 2. 影响化学反应速率的主要因素是什么?我们人类能否控制这个因素? 3. 我们能否通过改变外在条件来改变化学反应的速率呢? 有哪些条件能够影响化学反应的速率呢?下面我们通过实验来探究二、外界条件对化学反应速率的影响1、内因:参与反应的物质本身的性质,起决定作用
2、外因:外界因素实验2-6立即有大量气泡产生有大量气泡产生溶液中有少量气泡出现不用催化剂,化学反应速率很小1,催化剂对过氧化氢的分解速率的影响在其它条件不变时,催化剂通常可以加快化学反应速率;
不同催化剂对同一个反应的催化能力不同。 自学P43 神奇的催化剂催化剂能极大地改变反应速率,而自身的
组成、化学性质和质量在反应前后不发生
变化,具有高度的选择性(或专一性)物理性质呢?改变吗?为什么选用FeCl3作催化剂?
怎样才能快速得到三支速率一致的试管?
如何快速得到三种温度不同的水? H2O2在不同温度条件下的分解情况 将试管中的溶液分装
到另外两支试管中,
然后放入装有三种不同
温度的水的烧杯中。2,温度对化学反应速度的影响溶液中产生气泡的速率很快温度越高,化学反应速率越快溶液中有气泡产生,且速率较快温度的高低,能够影响化学反应速率的大小溶液中产生气泡的速率较慢温度越低,化学反应速率越慢升高反应体系的温度,化学反应速率加快;2,温度对化学反应速度的影响实验2-5实验步骤:
截取3cm镁条,用砂纸打磨掉表面氧化物
组装好实验装置
量取40mL 0.5 mol/L HCl倒入锥形瓶中
将镁条投入锥形瓶中,立刻塞好橡皮塞
每隔5秒记录收集到氢气的体积,至第90秒
清洗锥形瓶
量取40 mL 2 mol/L HCl倒入锥形瓶中,重复上述实验
将所得数据绘成曲线3,浓度对化学反应的影响浓度越大,化学反应越快小结:当其它条件不变时,使用催化剂可以加快化学反应速率;升高反应体系的温度,化学反应速率加快;增大反应物浓度,化学反应速率加快;增大反应物之间的接触面,化学反应速率加快。除此之外,压强、紫外线、反应物状态、光等也会影响化学反应速率。阅读,思考与交流:P431、温度越低,食物变质腐败的速率越慢。这也是温度对化学反应速率的影响在生活中的应用。2、固体药品研得越细,其表面积越大,混合均匀后反应物之间接触得面积也越大,反应也迅速、充分。3、固体物质溶于水后,发生了电解质的电离,离子在溶液里受水分子作用而运动,增大了离子之间接触反应的机会,从而提高了化学反应速率。4、Zn+ H2SO4=ZnSO4+H2↑,离子方程式为:Zn+2H+=Zn2++ H2↑,C(H+)的大小影响着该反应的反应速率,气泡变稀少了,是因为C(H+)减小了,反应速率减慢,如果添加适当浓度的硫酸溶液时,由于溶液中C(H+)又迅速增大,因而反应速率加快,产生气泡的速率又加快了。实验2-7出现浑浊,
产生沉淀溶液中存在Ca2+CaCl2和Na2SO4没有反应完全CaCl2+Na2SO4== CaSO4↓(微溶)+ 2NaClCa2+ + CO32- == CaCO3↓二,化学反应的限度化学反应在实际进行时,反应物能否完全转变为生成物?加Na2SO4至不再有沉淀为止!!!化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
即正向反应和逆向反应能同时在同样的条件下进行。实验现象:加入Na2SO4溶液,有白色沉淀生。
再加入Na2CO3溶液,又有白色沉淀产生。1,不少化学反应都具有可逆性实验结论:CaSO4沉淀在溶液中存在如下可逆 反应:CaSO4=Ca2++SO42—。由于上层清液中仍有少量电离出的Ca2+,故可与CO32—反应生成更难溶的CaCO3沉淀。当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度。任何化学反应的进程都有一定的限度,只是不同反应的限度不同而已。2,平衡状态①当反应刚开始时,反应物和生成物的浓
度哪个大?
②当反应刚开始时,正反应与逆反应哪个
反应速率大?
③随着反应的进行,反应物和生成物浓度
如何变化?
④随着反应的进行,v(正)与v(逆)怎样变化?在密闭容器中加入1molH2和1mol I2发生反应⑴对于以下反应,请分析:H2(g) + I2 (g) 2HI(g) 正向反应逆向反应
(5)反应进行到什么时候会“停止”?当正反应速率与逆反应速率相等时(6)此时,反应物和生成物浓度如何变化? 反应物和生成物浓度均不再改变(7)给这个状态命名平衡状态(8)反应真的停止了吗?NO处于动态平衡0(1)0~t1:v(正)>v(逆)(2)t1以后: v(正)=v(逆)t1以后反应处于平衡状态!什么是化学平衡呢?定义:化学平衡状态在一定条件下的可逆反应里,正反应和逆
反应的速率相等,反应物和生成物浓度保
持不变的状态。化学平衡状态简称化学平衡。注意:(1)条件:一定条件下
(2)对象:可逆反应
特征: (1)定:反应物和生成物浓度保持不变
(2)动:动态平衡
(3)等: v(正)= v(逆)
如何理解V(正)=V(逆)?例如,一定条件下,可逆反应N2+3H2=2NH3,对该可逆反应,表示正、逆反应速率可以用N2或H2或NH3来表示:
(1)单位时间内,有1molN2反应掉,同时有1molN2生成
(2)单位时间内,有3molH2反应掉,同时有2molNH3反应掉
(3)单位时间内,有1molN2生成,同时有2molNH3生成
以上均表示V(正)=V(逆)三、化学反应条件的控制思考与交流P46通过讨论,我们可知,通常控制反应的条件可从浓度、温度、压强、催化剂、光照等方面考虑,使选择的条件既可提高化学反应速率又可提高化学反应的限度。下面以“提高煤的燃烧效率”为例,分析研究化学反应条件的选择。P461、煤被研得越细,粉末越小,与空气中O2得接触面积越大,燃烧越充分,反应速率越快。2、空气充足,煤燃烧生成CO2越充分,放热越多;若空气不足,则煤燃烧部分生成CO,CO排到空气中造成污染,且生成CO时,放出得热量大大减少。3、应选择保温隔热且耐热的炉膛材料;尽管煤燃烧是放热反应,但反应过程中煤燃烧需提供部分能量才能继续,因此利用煤燃烧放出的部分热量就可维持反应的继续进行,选用保温隔热材料的目的,正是为了防止热量散失。4、可将燃烧后的废气通过交换装置,供其他方面使用。5、燃料不充分燃烧有何危害?(1)产生热量少,浪费资源;(2)产生污染物,危害人体健康。6、燃料充分燃烧的条件是什么?燃料燃烧必须与空气接触,且要达到燃料的着火点,燃料充分燃烧要考虑两点:一是燃烧时要有足够多的空气,二是燃料与空气要有足够大的接触面积。小结:提高燃料的燃烧效率的措施(1)尽可能使燃料充分燃烧,提高能量的转化率。关键是,燃料与空气或氧气要尽可能充分接触,且空气要适当过量。(2)尽可能充分利用燃料燃烧所释放出的热能,提高热能的利用率。控制化学反应条件的意义:对有利的或我们需要的化学反应,要想办法增大反应速率以提高生产或工作效率,并要采取措施促进反应的完成程度以提高原料的利用率或转化率;对有害的或我们不希望发生的化学反应,要设法降低反应速率。练习1、课本习题P472、天然气和液化石油气燃烧的主要化学方程式依次为:CH4+2O2→CO2+2H2O,C3H8+5O2→3CO2+4H2O,现有一套以天然气为燃料的灶具,今改用液化石油气,应采用的正确措施是( )
A、减少空气进入量,增大石油气进入量
B、增大空气进入量,减少石油气进入量
C、减少空气进入量,减少石油气进入量
D、增大空气进入量,增大石油气进入量B作业:
1、完成课课测评
2、复习准备中段考
