第三 节 化学反应的速率和限度[下学期]
文档属性
| 名称 | 第三 节 化学反应的速率和限度[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 184.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-03-28 22:27:00 | ||
图片预览






文档简介
课件16张PPT。第3节化学反应速率与限度在实验过程中如何观察反应进行的快慢?(1)冒气泡快慢;
(2)固体量的减少;
(3)溶液的浑浊程度;
(4)温度的变化
思考化学反应速率涵义:衡量化学反应进行的快慢程度定义:单位时间内反应物浓度的减少量或生成物浓度的增加量。单位:mol/(L·s) 或 mol/(L·min) 公式:v ==_______△ct想一想:某反应的反应物浓度在5min内由6mol/L变成了2mol/L,求以该反应物浓度的变化来表示的该反应的化学反应速率?V = (6-2)/5mol/(L·min)
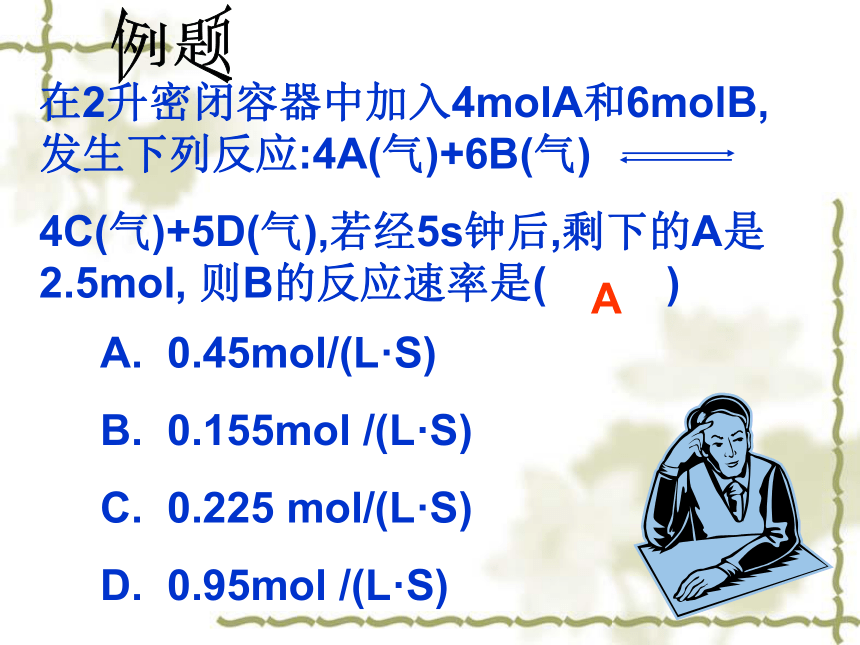
=0.8mol/(L·min)在2升密闭容器中加入4molA和6molB,发生下列反应:4A(气)+6B(气)
4C(气)+5D(气),若经5s钟后,剩下的A是2.5mol, 则B的反应速率是( )A. 0.45mol/(L·S)
B. 0.155mol /(L·S)
C. 0.225 mol/(L·S)
D. 0.95mol /(L·S) A例题1、指明表示该反应速率的物质2、指的是平均速率而不是瞬时速率3、方程式中化学反应速率之比等于
各物质的系数之比注 意 事 项4.化学反应速率一定是正值二、影响化学反应的因素温度升高可以加快化学反应速率。实验2-5加快H2O2分解的催化剂。实验2-6想一想(1)人们为什么使用电冰箱储藏食物?◆ 使用电冰箱储存食物,可以降低食物温度,减慢发生缓慢氧化引起食物变质的速率。(2)实验室通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应.原因是什么?●将块状或颗粒状固体研细成粉末,可使反应物充分混合,增加反应物的接触面积,加快化学反应速率。◆因为两种溶液混合比两种固体混合更
均匀,反应物接触面积大。(3)实验室进行化学反应时,通常把一些固体物质溶于水配成溶液再进行反应.原因是什么?●因为随反应的进行,H+的浓度不断降低,所以反应的减慢,气泡减少,但添加一些适当浓度的硫酸后,溶液中的H+的浓度突然增大,所以反应速率又加大,气泡重新增多。(4)实验室常用约30%左右的硫酸溶液(约3.7mol/L)与锌粒反应制取氢气,当反应进行一段时间后,气泡变得稀少了(锌粒还有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又会重新增多起来.原因是什么?※采用哪些方法可以加快化学反应?●加大反应物的浓度
◆升高反应温度
●增大气体反应物的压力
◇加大反应物的接触表面积,即把块状固体反应物磨碎成粉末。
●使用催化剂的存在与否;
◇增加光能(或辐射能)等等
§影响反应速率的因素
内因: (1)反应物的本性;
( 2)反应物的浓度
(3)反应物的温度
(4)反应物粒子的大小(表面 积)
(5)催化剂的存在与否
(6)光能(或辐射能)等等 外因小结
(2)固体量的减少;
(3)溶液的浑浊程度;
(4)温度的变化
思考化学反应速率涵义:衡量化学反应进行的快慢程度定义:单位时间内反应物浓度的减少量或生成物浓度的增加量。单位:mol/(L·s) 或 mol/(L·min) 公式:v ==_______△ct想一想:某反应的反应物浓度在5min内由6mol/L变成了2mol/L,求以该反应物浓度的变化来表示的该反应的化学反应速率?V = (6-2)/5mol/(L·min)
=0.8mol/(L·min)在2升密闭容器中加入4molA和6molB,发生下列反应:4A(气)+6B(气)
4C(气)+5D(气),若经5s钟后,剩下的A是2.5mol, 则B的反应速率是( )A. 0.45mol/(L·S)
B. 0.155mol /(L·S)
C. 0.225 mol/(L·S)
D. 0.95mol /(L·S) A例题1、指明表示该反应速率的物质2、指的是平均速率而不是瞬时速率3、方程式中化学反应速率之比等于
各物质的系数之比注 意 事 项4.化学反应速率一定是正值二、影响化学反应的因素温度升高可以加快化学反应速率。实验2-5加快H2O2分解的催化剂。实验2-6想一想(1)人们为什么使用电冰箱储藏食物?◆ 使用电冰箱储存食物,可以降低食物温度,减慢发生缓慢氧化引起食物变质的速率。(2)实验室通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应.原因是什么?●将块状或颗粒状固体研细成粉末,可使反应物充分混合,增加反应物的接触面积,加快化学反应速率。◆因为两种溶液混合比两种固体混合更
均匀,反应物接触面积大。(3)实验室进行化学反应时,通常把一些固体物质溶于水配成溶液再进行反应.原因是什么?●因为随反应的进行,H+的浓度不断降低,所以反应的减慢,气泡减少,但添加一些适当浓度的硫酸后,溶液中的H+的浓度突然增大,所以反应速率又加大,气泡重新增多。(4)实验室常用约30%左右的硫酸溶液(约3.7mol/L)与锌粒反应制取氢气,当反应进行一段时间后,气泡变得稀少了(锌粒还有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又会重新增多起来.原因是什么?※采用哪些方法可以加快化学反应?●加大反应物的浓度
◆升高反应温度
●增大气体反应物的压力
◇加大反应物的接触表面积,即把块状固体反应物磨碎成粉末。
●使用催化剂的存在与否;
◇增加光能(或辐射能)等等
§影响反应速率的因素
内因: (1)反应物的本性;
( 2)反应物的浓度
(3)反应物的温度
(4)反应物粒子的大小(表面 积)
(5)催化剂的存在与否
(6)光能(或辐射能)等等 外因小结
