化学能与电能(二课时)[下学期]
文档属性
| 名称 | 化学能与电能(二课时)[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-27 00:00:00 | ||
图片预览






文档简介
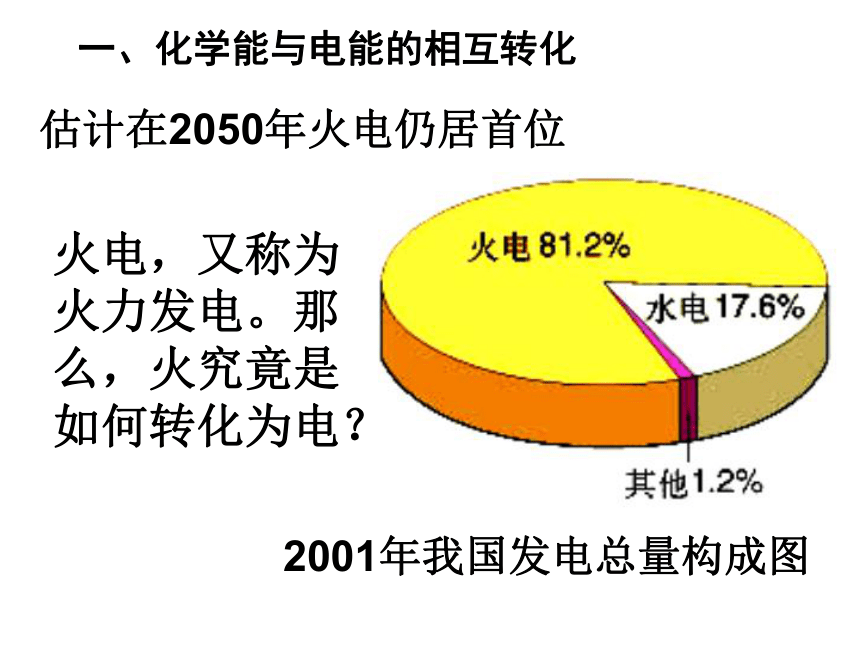
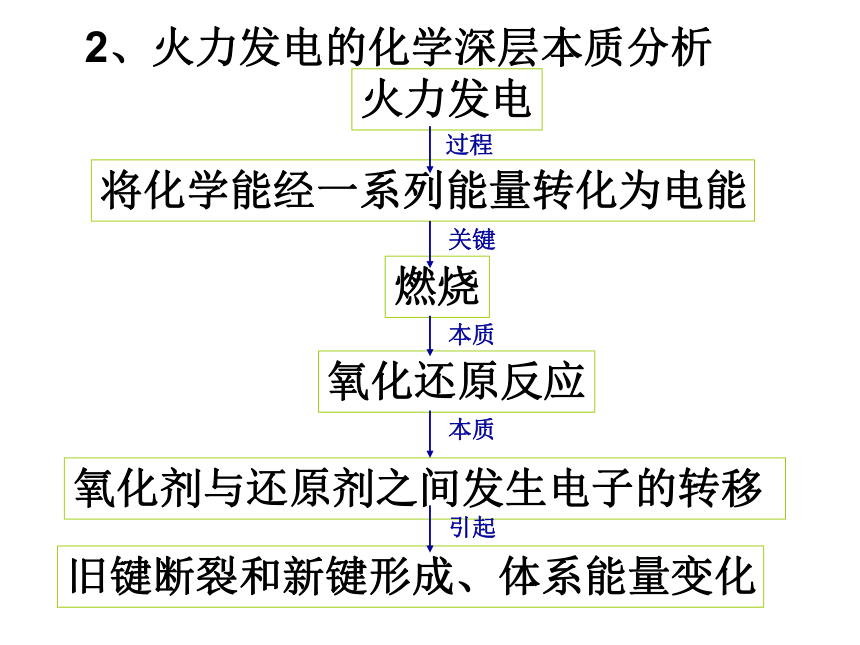
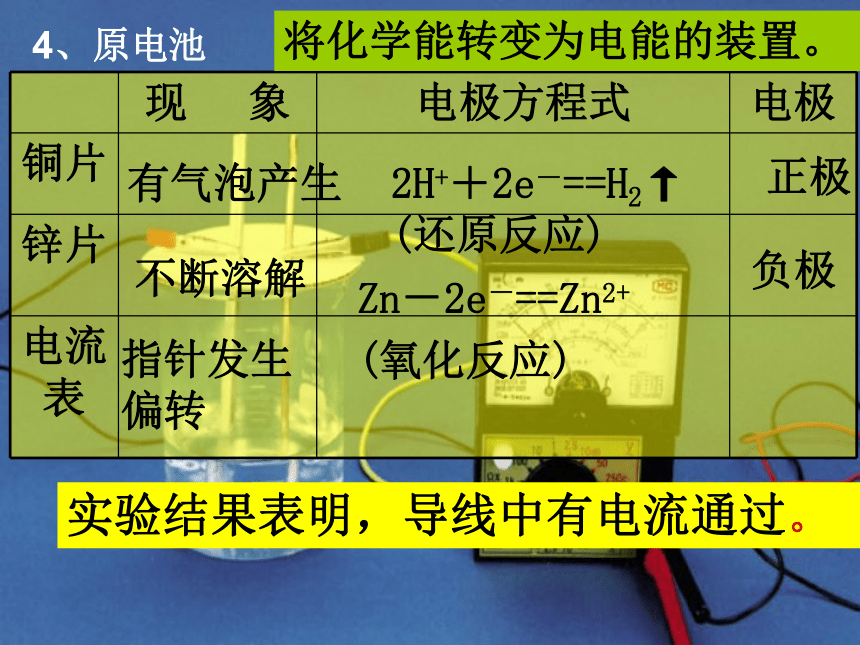
课件29张PPT。化学能与电能 电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称为电力。一、化学能与电能的相互转化2001年我国发电总量构成图估计在2050年火电仍居首位火电,又称为火力发电。那么,火究竟是如何转化为电?1、火力发电的原理分析。2、火力发电的化学深层本质分析燃烧氧化还原反应氧化剂与还原剂之间发生电子的转移火力发电将化学能经一系列能量转化为电能旧键断裂和新键形成、体系能量变化过程关键本质本质引起3、火力发电的利弊分析。思考1:火力发电有何利与弊?燃料燃烧转化为电能后,社会中应用最广泛、使用最方便。利弊产生二氧化硫和氮的氧化物,导致空气污染,也会造成酸雨,破坏生态环境;会产生二氧化碳,会使地球的温室效应恶化。能量的转化效率地低.思考2:假设你是电力工程师,面对这些利与弊,你会如何应对呢?a、改进火力发电 方式之一就是尝试将化学能直接转化为电能。就像电池。其好处就是减少中间环节能损,高效、清洁利用燃料,不浪费能源,更方便。4、原电池学生实验2-4有气泡产生不断溶解指针发生
偏转Zn-2e-==Zn2+
(氧化反应)2H++2e-==H2↑
(还原反应)实验结果表明,导线中有电流通过。 正极负极将化学能转变为电能的装置。 当把用导线连接的铜片和锌片一同浸入稀硫酸时,由于锌比铜活泼,容易失去电子,锌被氧化成Zn2+而进入溶液,电子由锌片通过导线流向铜片,溶液中的H+从铜片获得电子被还原成氢原子,氢原子结合成氢分子从铜片上逸出。 ☆ 学 与 问 ☆
你知道电子是怎样流动的吗?你如何判断电源的正极、负极? 我们知道,电流是从正极流向负极的,与电子的流向是相反的。从实验知道电子从锌片流向铜片,所以电流应该是从铜片流向锌片的,因此可知原电池两极的判断方法:活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。 实践活动
自制电池——水果电池。如下图:原电池化学反应本质: 较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极) 化学电池由正极、负极、电解质溶液
以及容器组成。思考与交流
通过以上实验和探究,试说明化学电池由几部分组成,它的组成条件是什么? 总结归纳原电池的构成条件:① 有两种活动性不同的金属
(或非金属导体)作电极。② 电极材料均插入电解质溶液中。③ 两极相连形成闭合电路。一、铜片和锌片用导线连接后插入稀硫酸中,锌片是( ) 极 二、在用锌片,铜片和稀硫酸组成的原电池装置中,经过一段时间工作后,下列说法中正确的是( )
A、锌片是正极,铜片上有气泡产生
B、电流方向是从 锌片流向铜片
C、溶液中硫酸的物质的量减小
D、电解液的PH保持不变 负C化学电源空气电池锂电池(1)干电池的构造是什么样的?
(2)干电池的负极和正极分别是什么?电解质溶液又是什么?
(3)干电池使用久了会发生什么现象?
思考题(4)什么叫做充电电池?铅蓄电池的构造是什么样的?
(5)铅蓄电池负极和正极分别是什么?电解质溶液又是什么?
(6)废旧电池是否应该回收?为什么?
?干
电
池 上图是锌-锰干电池负极:Zn-- 2e- ==Zn2+
正极(C):2NH4++ 2e- ==2NH3↑+2H2 ↑ 体积小、性能好的碱性锌-锰电池应运
而生。这类电池的重要特征是电解液由原来
的中性变为离子导电性更好的碱性,负极也由
锌片改为锌粉,反应面积成倍增长,使放电电
流大幅度提高。铅蓄电池锂电池 锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。新型燃料电池 燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池负极:2H2-4e- +4OH- ==4H2O
正极:O2+2H2O+4e- ==4OH-
总反应:2H2+O2==2H2O
电极:多孔镍 电解质:KOH科学探究——构成原电池的条件学生实验探究?
偏转Zn-2e-==Zn2+
(氧化反应)2H++2e-==H2↑
(还原反应)实验结果表明,导线中有电流通过。 正极负极将化学能转变为电能的装置。 当把用导线连接的铜片和锌片一同浸入稀硫酸时,由于锌比铜活泼,容易失去电子,锌被氧化成Zn2+而进入溶液,电子由锌片通过导线流向铜片,溶液中的H+从铜片获得电子被还原成氢原子,氢原子结合成氢分子从铜片上逸出。 ☆ 学 与 问 ☆
你知道电子是怎样流动的吗?你如何判断电源的正极、负极? 我们知道,电流是从正极流向负极的,与电子的流向是相反的。从实验知道电子从锌片流向铜片,所以电流应该是从铜片流向锌片的,因此可知原电池两极的判断方法:活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。 实践活动
自制电池——水果电池。如下图:原电池化学反应本质: 较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极) 化学电池由正极、负极、电解质溶液
以及容器组成。思考与交流
通过以上实验和探究,试说明化学电池由几部分组成,它的组成条件是什么? 总结归纳原电池的构成条件:① 有两种活动性不同的金属
(或非金属导体)作电极。② 电极材料均插入电解质溶液中。③ 两极相连形成闭合电路。一、铜片和锌片用导线连接后插入稀硫酸中,锌片是( ) 极 二、在用锌片,铜片和稀硫酸组成的原电池装置中,经过一段时间工作后,下列说法中正确的是( )
A、锌片是正极,铜片上有气泡产生
B、电流方向是从 锌片流向铜片
C、溶液中硫酸的物质的量减小
D、电解液的PH保持不变 负C化学电源空气电池锂电池(1)干电池的构造是什么样的?
(2)干电池的负极和正极分别是什么?电解质溶液又是什么?
(3)干电池使用久了会发生什么现象?
思考题(4)什么叫做充电电池?铅蓄电池的构造是什么样的?
(5)铅蓄电池负极和正极分别是什么?电解质溶液又是什么?
(6)废旧电池是否应该回收?为什么?
?干
电
池 上图是锌-锰干电池负极:Zn-- 2e- ==Zn2+
正极(C):2NH4++ 2e- ==2NH3↑+2H2 ↑ 体积小、性能好的碱性锌-锰电池应运
而生。这类电池的重要特征是电解液由原来
的中性变为离子导电性更好的碱性,负极也由
锌片改为锌粉,反应面积成倍增长,使放电电
流大幅度提高。铅蓄电池锂电池 锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。新型燃料电池 燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池负极:2H2-4e- +4OH- ==4H2O
正极:O2+2H2O+4e- ==4OH-
总反应:2H2+O2==2H2O
电极:多孔镍 电解质:KOH科学探究——构成原电池的条件学生实验探究?
