化学能与电能 第一课时[下学期]
文档属性
| 名称 | 化学能与电能 第一课时[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-27 08:55:00 | ||
图片预览



文档简介
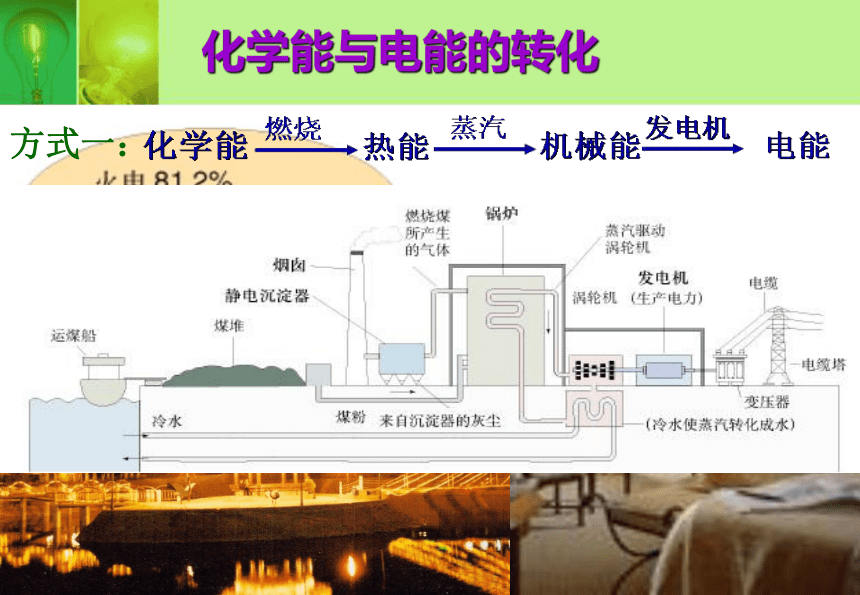
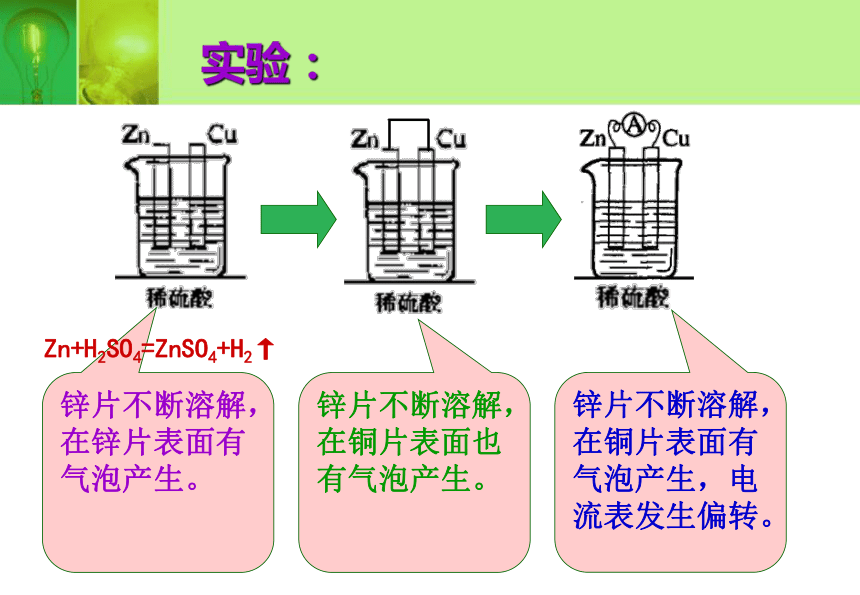
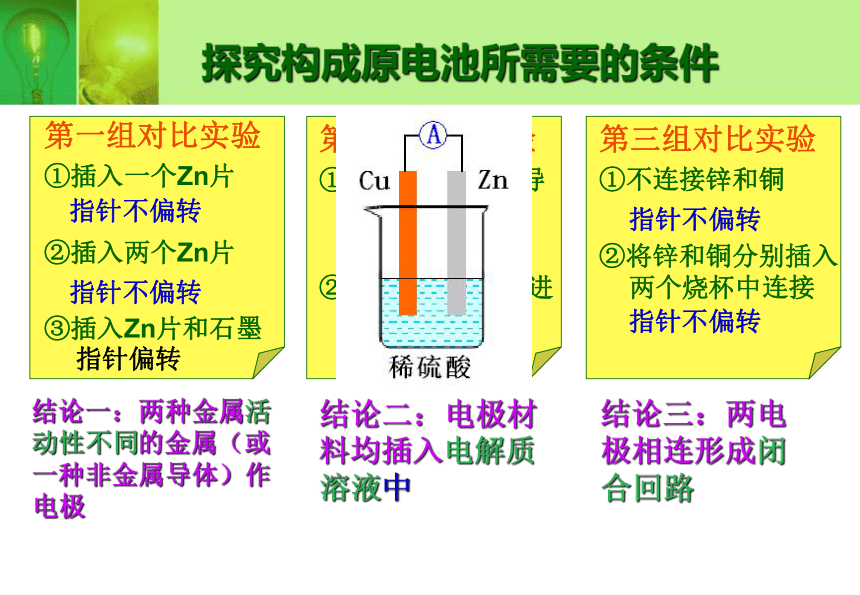
课件16张PPT。化学能与电能第一课时化学能与电能的转化方式一:电池的广泛运用把化学能转化为电能的装置叫原电池实验:锌片不断溶解,在锌片表面有气泡产生。锌片不断溶解,在铜片表面也有气泡产生。锌片不断溶解,在铜片表面有气泡产生,电流表发生偏转。Zn+H2SO4=ZnSO4+H2↑探究构成原电池所需要的条件结论一:两种金属活动性不同的金属(或一种非金属导体)作电极结论二:电极材料均插入电解质溶液中结论三:两电极相连形成闭合回路第二组对比实验
①只将Cu和Zn用导线连接起来
② Cu和Zn与乙醇进行实验第三组对比实验
①不连接锌和铜
②将锌和铜分别插入两个烧杯中连接指针不偏转指针不偏转指针偏转指针不偏转指针不偏转指针不偏转第一组对比实验
①插入一个Zn片
②插入两个Zn片
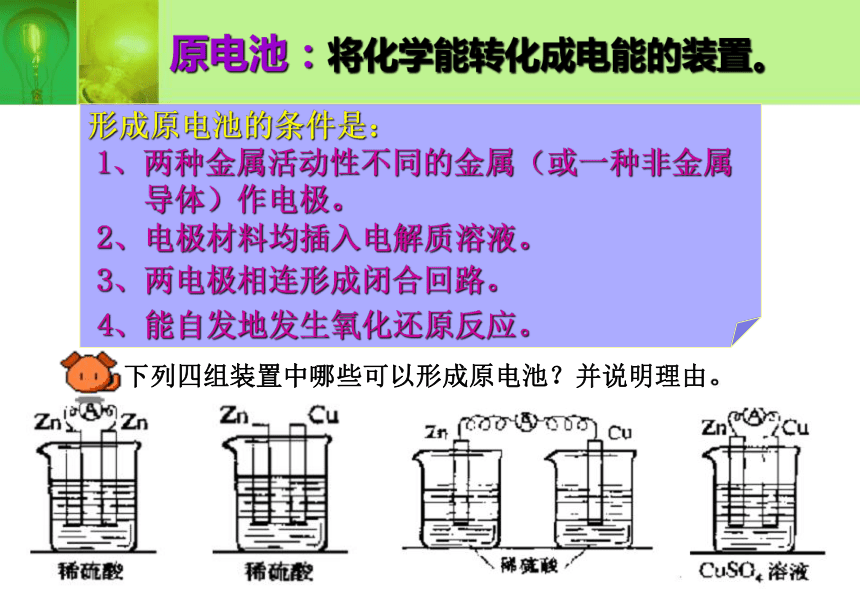
③插入Zn片和石墨指针不偏转这个装置能不能形成原电池?在原电池中必须能发生氧化还原反应,如果不能发生氧化还原反应是不能产生电流,不形成原电池的。 怎样判断能否发生氧化还原反应?电极能否与所在的电解质溶液反应原电池:将化学能转化成电能的装置。形成原电池的条件是:1、两种金属活动性不同的金属(或一种非金属 导体)作电极。 2、电极材料均插入电解质溶液。3、两电极相连形成闭合回路。 下列四组装置中哪些可以形成原电池?并说明理由。4、能自发地发生氧化还原反应。练习1、原电池是( )
A、把光能转化成了化学能的装置
B、把化学能转化成了光能的装置
C、把热能转变成了电能的装置
D、把化学能转变成了电能的装置
2、以下装置哪些可以形成原电池?
ABCDDDA练习3、现在家中有以下材料,根据你所学的知识,能不能设计一套电池装置?
用品:铜片、铁片、导线、石墨棒、苹果汁、柠檬汁、酒精、醋酸、烧杯、手电筒用小灯泡、电流表及家庭常见的一些用品。
作 业预习书上36页原电池的电极反应。
做练习册29页问题导读一。原电池:将化学能转化成电能的装置。形成原电池的条件是:1、两种金属活动性不同的金属(或一种非金属 导体)作电极。 2、电极材料均插入电解质溶液。3、两电极相连形成闭合回路。4、能自发地发生氧化还原反应。电极与电解质溶液发生反应通常构成原电池后反应速率加快。现象:Zn片:Zn-2e- =Zn2+Cu片:2H++2e- =H2↑负极(—)正极(+)总反应:Zn+2H+=Zn2++H2 ↑为什么会有电流的产生?发生氧化反应发生还原反应电极反应: 锌片不断溶解,在铜片表面有气泡产生,电流表发生偏转。通过实验可知,Zn—CuSO4—Cu也能形成原电池,请你写该电池的电极反应和总的化学反应方程式,并指出正极和负极材料。负极Zn片:Zn-2e-=Zn2+正极Cu片:Cu2++2e-=Cu总反应: Zn+ Cu 2 + =Zn2+ + Cu你能推断出看到的现象吗?通过上述的原电池,请你总结在原电池中,活泼金属做 极,不活泼金属做 极; 极跟电解质溶液发生氧化还原反应。正负负 练习1、原电池是一种 _______________________装置。一般说来,在原电池中,较活泼的金属发生_________反应,是 极, 电子;活动性较差的金属(或非金属导体)上发生 反应,是 极, 电子。把化学能转为电能氧化负还原正2、现有A、B、C、D四种金属,把A、B分别浸入稀H2SO4中,产生气泡都很慢;把C、D分别浸入稀H2SO4中,产生气泡都很快;把A、B用导线连接时,A上有气泡析出;把C浸入D的硝酸盐溶液中,C的表面有D析出。这四种金属的活动性顺序由强到弱为 。C>D>B>A得失 练习3、请写出下面各电极的反应及总反应负极:Fe: Fe-2e-=Fe2+
正极:Ag:2H++2e-=H2↑
总反应: Fe+ 2H + =Fe2+ + H2↑4、你能将氧化还原反应:Fe + Cu2+ = Cu + Fe2+设计成原电池吗?负极: Fe
正极:活动性不如Fe的金属或石墨
电解质溶液: CuSO4 、CuCl2等5、请将氧化还原反应:Mg + 2H+ = Mg2+ +H2↑设计成原电池。负极:
正极:
电解质溶液:Mg活动性不如Mg的金属或石墨稀H2SO4或稀盐酸
①只将Cu和Zn用导线连接起来
② Cu和Zn与乙醇进行实验第三组对比实验
①不连接锌和铜
②将锌和铜分别插入两个烧杯中连接指针不偏转指针不偏转指针偏转指针不偏转指针不偏转指针不偏转第一组对比实验
①插入一个Zn片
②插入两个Zn片
③插入Zn片和石墨指针不偏转这个装置能不能形成原电池?在原电池中必须能发生氧化还原反应,如果不能发生氧化还原反应是不能产生电流,不形成原电池的。 怎样判断能否发生氧化还原反应?电极能否与所在的电解质溶液反应原电池:将化学能转化成电能的装置。形成原电池的条件是:1、两种金属活动性不同的金属(或一种非金属 导体)作电极。 2、电极材料均插入电解质溶液。3、两电极相连形成闭合回路。 下列四组装置中哪些可以形成原电池?并说明理由。4、能自发地发生氧化还原反应。练习1、原电池是( )
A、把光能转化成了化学能的装置
B、把化学能转化成了光能的装置
C、把热能转变成了电能的装置
D、把化学能转变成了电能的装置
2、以下装置哪些可以形成原电池?
ABCDDDA练习3、现在家中有以下材料,根据你所学的知识,能不能设计一套电池装置?
用品:铜片、铁片、导线、石墨棒、苹果汁、柠檬汁、酒精、醋酸、烧杯、手电筒用小灯泡、电流表及家庭常见的一些用品。
作 业预习书上36页原电池的电极反应。
做练习册29页问题导读一。原电池:将化学能转化成电能的装置。形成原电池的条件是:1、两种金属活动性不同的金属(或一种非金属 导体)作电极。 2、电极材料均插入电解质溶液。3、两电极相连形成闭合回路。4、能自发地发生氧化还原反应。电极与电解质溶液发生反应通常构成原电池后反应速率加快。现象:Zn片:Zn-2e- =Zn2+Cu片:2H++2e- =H2↑负极(—)正极(+)总反应:Zn+2H+=Zn2++H2 ↑为什么会有电流的产生?发生氧化反应发生还原反应电极反应: 锌片不断溶解,在铜片表面有气泡产生,电流表发生偏转。通过实验可知,Zn—CuSO4—Cu也能形成原电池,请你写该电池的电极反应和总的化学反应方程式,并指出正极和负极材料。负极Zn片:Zn-2e-=Zn2+正极Cu片:Cu2++2e-=Cu总反应: Zn+ Cu 2 + =Zn2+ + Cu你能推断出看到的现象吗?通过上述的原电池,请你总结在原电池中,活泼金属做 极,不活泼金属做 极; 极跟电解质溶液发生氧化还原反应。正负负 练习1、原电池是一种 _______________________装置。一般说来,在原电池中,较活泼的金属发生_________反应,是 极, 电子;活动性较差的金属(或非金属导体)上发生 反应,是 极, 电子。把化学能转为电能氧化负还原正2、现有A、B、C、D四种金属,把A、B分别浸入稀H2SO4中,产生气泡都很慢;把C、D分别浸入稀H2SO4中,产生气泡都很快;把A、B用导线连接时,A上有气泡析出;把C浸入D的硝酸盐溶液中,C的表面有D析出。这四种金属的活动性顺序由强到弱为 。C>D>B>A得失 练习3、请写出下面各电极的反应及总反应负极:Fe: Fe-2e-=Fe2+
正极:Ag:2H++2e-=H2↑
总反应: Fe+ 2H + =Fe2+ + H2↑4、你能将氧化还原反应:Fe + Cu2+ = Cu + Fe2+设计成原电池吗?负极: Fe
正极:活动性不如Fe的金属或石墨
电解质溶液: CuSO4 、CuCl2等5、请将氧化还原反应:Mg + 2H+ = Mg2+ +H2↑设计成原电池。负极:
正极:
电解质溶液:Mg活动性不如Mg的金属或石墨稀H2SO4或稀盐酸
