原电池原理[下学期]
图片预览








文档简介
课件22张PPT。化学能与化学电源实验观察与思考:
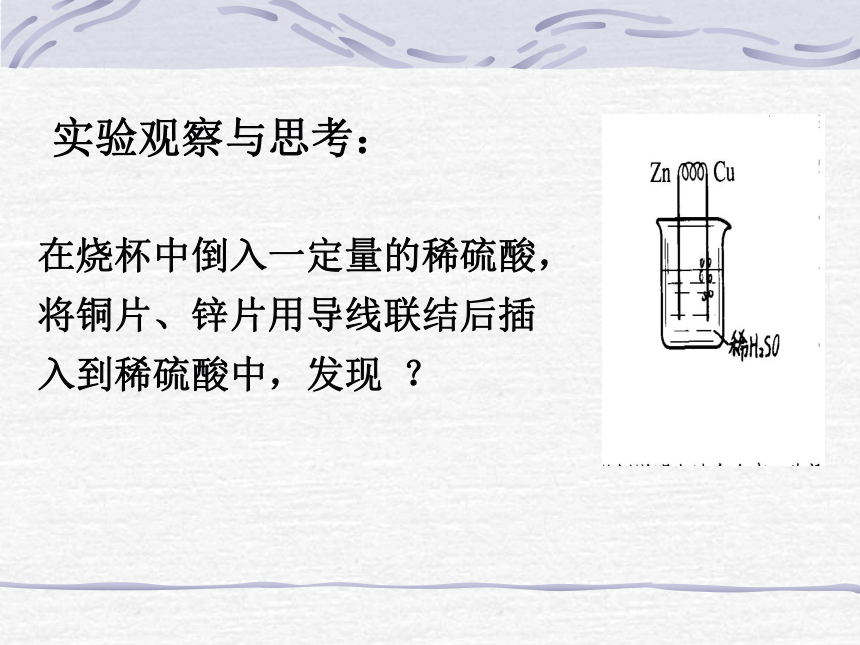
在烧杯中倒入一定量的稀硫酸,
将铜片、锌片用导线联结后插
入到稀硫酸中,发现 ?
一、原电池的原理锌片和铜片用导线连接后,插入稀硫酸中,
电流计的指针发生偏转说明什么问题?
电路中的电子流从哪里来? 哪一种金属是正极?哪一种金属是负极?
两极上各发生什么反应,能否写出电极反应方程式? 能否写出总的离子反应方程式,
跟锌和稀硫酸反应作比较得出什么结论? 负极—失电子 Zn – 2e → Zn2+ 氧化反应
正极—得电子 2H+ + 2e → H2 还原反应
总反应 Zn + 2H+→ Zn2+ + H2↑
Zn + H2SO4 → ZnSO4 + H2↑从能量转变的观点分析这是一种什么样的装置呢? 原电池是一种将化学能转变为电能的装置原电池中正、负极如何确定? 电子流动方向、电流方向如何? 形成原电池需哪些条件? 1、组成原电池的条件: (1)两电极相互接触或用导线连接
(2)两个活泼性不同的电极
(3)电解质溶液
(一般与活泼性强的电极发生反应)
碳棒可以用来做什么?正极负极 Zn – 2e → Zn2+ 氧化反应
正极 2H+ + 2e → H2 还原反应
总反应 Zn + 2H+→ Zn2+ + H2↑
Zn + H2SO4 → ZnSO4 + H2↑
2、趣味实验与探索实验(1) 果蔬电池说明了什么问题?(2) Mg + CuSO4 → Cu + MgSO4
2AgNO3 + Cu → 2Ag + Cu(NO3)2
请将上述两个反应分别设计成原电池实验装置,
用实验加以证明,写出电极反应式,说明反应类型考考你:将A、B、C、D四块不同的金属片浸入稀硫酸,
导线两两相连可组成原电池。
若A、B相连形成原电池时,A为负极,
C、D相连形成原电池时,C为负极,
A、C相连形成原电池时,C极有大量的气泡产生,
D、B相连形成原电池时,B极有大量的气泡产生。
判断这四种金属的活动性由大到小的顺序 二、化学电池
化学电池中一定发生什么类型的反应?
1、干电池负极Zn Zn – 2e → Zn2+
正极C 2NH4+ + 2e → 2NH3 + H2
H2 + 2MnO2 → Mn2O3 + H2O2、蓄电池Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O放电时,正极 PbO2 ——得电子 化合价降低,被还原
负极 Pb —— 失电子 化合价升高,被氧化化学电池的危害 废电池中含有Hg、Cd、Pb等大量毒性很强的重金属,
一节1号电池烂在地里,能使1m2的土地失去利用价值。
3、新型能源 —— 燃料电池电解质溶液: KOH(aq)负极 多孔性C 2H2 + 4OH- - 4e → 4H2O
正极 多孔性C O2 + 2H2O + 4e → 4OH-2H2 + O2 → 2H2O cat原电池(普通干电池、钮扣电池)—— 一次电池
蓄电池(镍镉电池、铅蓄电池)—— 二次电池
燃料电池(H2、CH4)
化学电池——按用途、使用方式分类:
化学电池中发生的一定是氧化还原反应!三、金属为什么容易发生腐蚀现象?实验室制取H2时,粗锌比纯锌速度更快?金属的化学腐蚀——直接发生化学反应
金属的电化腐蚀—— 不纯的金属形成许多微小原电池,
活泼金属做负极被腐蚀思考:为什么马口铁比白铁皮更容易被腐蚀?
什么是钢铁的析氢腐蚀与吸氧腐蚀?钢铁的主要成分是什么?Fe C析氢腐蚀——酸性介质,放H2
吸氧腐蚀——中性或碱性介质,铁锈2、常见的金属保护方法有哪些?
在烧杯中倒入一定量的稀硫酸,
将铜片、锌片用导线联结后插
入到稀硫酸中,发现 ?
一、原电池的原理锌片和铜片用导线连接后,插入稀硫酸中,
电流计的指针发生偏转说明什么问题?
电路中的电子流从哪里来? 哪一种金属是正极?哪一种金属是负极?
两极上各发生什么反应,能否写出电极反应方程式? 能否写出总的离子反应方程式,
跟锌和稀硫酸反应作比较得出什么结论? 负极—失电子 Zn – 2e → Zn2+ 氧化反应
正极—得电子 2H+ + 2e → H2 还原反应
总反应 Zn + 2H+→ Zn2+ + H2↑
Zn + H2SO4 → ZnSO4 + H2↑从能量转变的观点分析这是一种什么样的装置呢? 原电池是一种将化学能转变为电能的装置原电池中正、负极如何确定? 电子流动方向、电流方向如何? 形成原电池需哪些条件? 1、组成原电池的条件: (1)两电极相互接触或用导线连接
(2)两个活泼性不同的电极
(3)电解质溶液
(一般与活泼性强的电极发生反应)
碳棒可以用来做什么?正极负极 Zn – 2e → Zn2+ 氧化反应
正极 2H+ + 2e → H2 还原反应
总反应 Zn + 2H+→ Zn2+ + H2↑
Zn + H2SO4 → ZnSO4 + H2↑
2、趣味实验与探索实验(1) 果蔬电池说明了什么问题?(2) Mg + CuSO4 → Cu + MgSO4
2AgNO3 + Cu → 2Ag + Cu(NO3)2
请将上述两个反应分别设计成原电池实验装置,
用实验加以证明,写出电极反应式,说明反应类型考考你:将A、B、C、D四块不同的金属片浸入稀硫酸,
导线两两相连可组成原电池。
若A、B相连形成原电池时,A为负极,
C、D相连形成原电池时,C为负极,
A、C相连形成原电池时,C极有大量的气泡产生,
D、B相连形成原电池时,B极有大量的气泡产生。
判断这四种金属的活动性由大到小的顺序 二、化学电池
化学电池中一定发生什么类型的反应?
1、干电池负极Zn Zn – 2e → Zn2+
正极C 2NH4+ + 2e → 2NH3 + H2
H2 + 2MnO2 → Mn2O3 + H2O2、蓄电池Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O放电时,正极 PbO2 ——得电子 化合价降低,被还原
负极 Pb —— 失电子 化合价升高,被氧化化学电池的危害 废电池中含有Hg、Cd、Pb等大量毒性很强的重金属,
一节1号电池烂在地里,能使1m2的土地失去利用价值。
3、新型能源 —— 燃料电池电解质溶液: KOH(aq)负极 多孔性C 2H2 + 4OH- - 4e → 4H2O
正极 多孔性C O2 + 2H2O + 4e → 4OH-2H2 + O2 → 2H2O cat原电池(普通干电池、钮扣电池)—— 一次电池
蓄电池(镍镉电池、铅蓄电池)—— 二次电池
燃料电池(H2、CH4)
化学电池——按用途、使用方式分类:
化学电池中发生的一定是氧化还原反应!三、金属为什么容易发生腐蚀现象?实验室制取H2时,粗锌比纯锌速度更快?金属的化学腐蚀——直接发生化学反应
金属的电化腐蚀—— 不纯的金属形成许多微小原电池,
活泼金属做负极被腐蚀思考:为什么马口铁比白铁皮更容易被腐蚀?
什么是钢铁的析氢腐蚀与吸氧腐蚀?钢铁的主要成分是什么?Fe C析氢腐蚀——酸性介质,放H2
吸氧腐蚀——中性或碱性介质,铁锈2、常见的金属保护方法有哪些?
