第二节 化学能与电能(第二课时)[下学期]
文档属性
| 名称 | 第二节 化学能与电能(第二课时)[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 854.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-29 09:36:00 | ||
图片预览



文档简介
课件29张PPT。 1、什么是原电池?
原电池中的化学反应有什么特征?
2、构成原电池的条件是什么?
3、原电池的正负极和电子流向如何判断?
4、如何书写电极反应和电池反应?
5、原电池的工作原理是什么?REVIEW结论:原电池装置特点:化学能转化为电能
形成条件:⑴两个活泼性不同的电极;
⑵电解质溶液;
⑶形成闭合回路
电极名称:负极:较活泼金属;
正极:较不活泼金属或能导电的非金属。
反应原理:
负极:发生氧化反应,负极本身失电子 。
正极:发生还原反应,溶液中阳离子得电子。
电子流向:
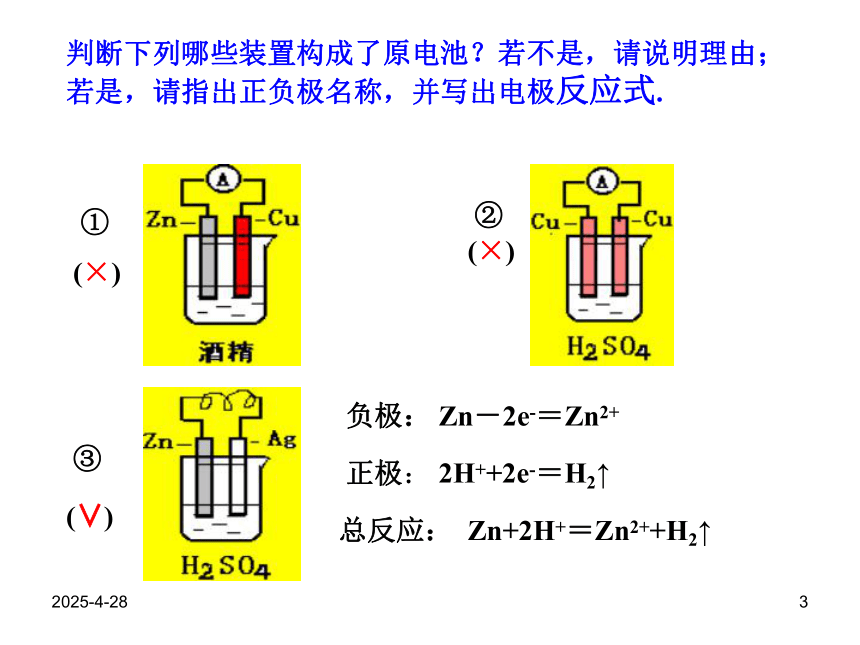
负极正极2019/2/283判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.①②③(×)(×)(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑
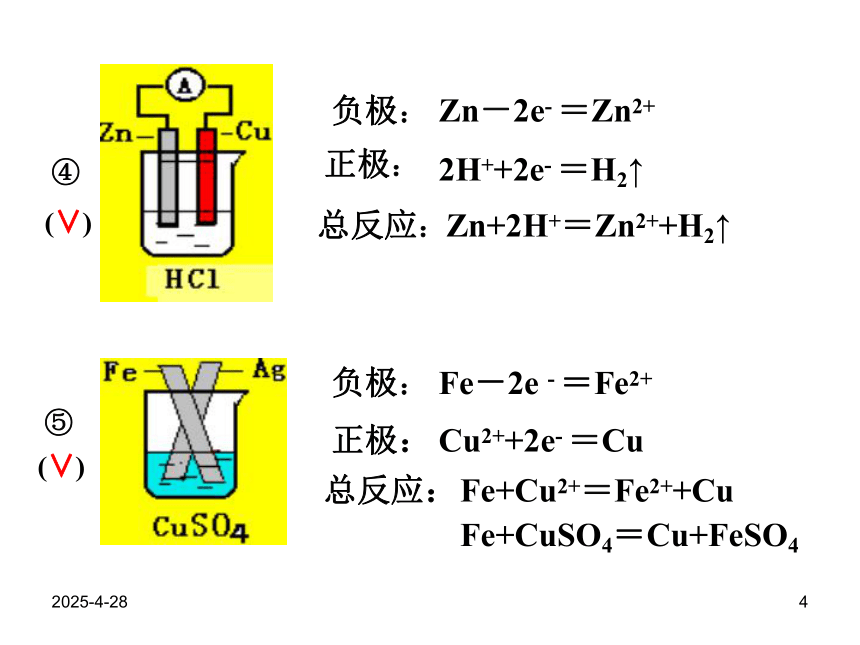
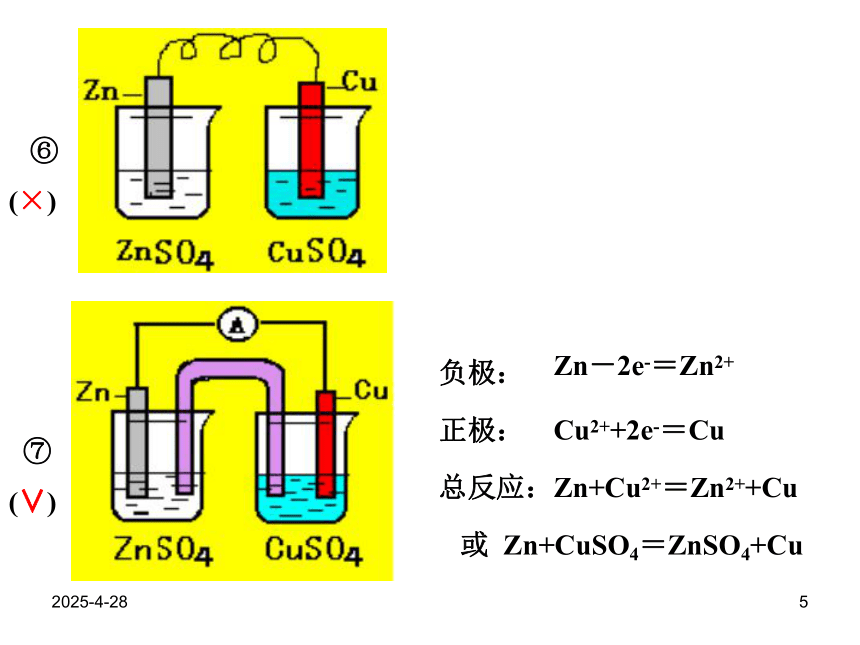
2019/2/284⑤④(∨)(∨)负极:正极:总反应:正极:负极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO42019/2/285 ⑦⑥(×)(∨)负极:正极:总反应:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu或 Zn+CuSO4=ZnSO4+Cu2019/2/286原电池原理的应用锂电池发展中的化学电源2019/2/287(1)干电池-1:负极(Zn) : Zn -2e- = Zn2+
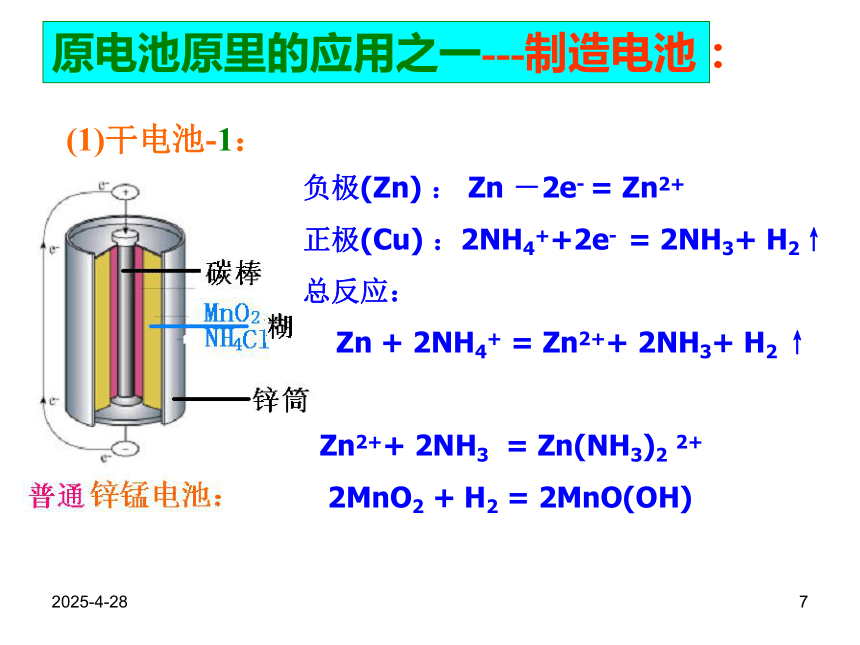
正极(Cu) :2NH4++2e- = 2NH3+ H2↑
总反应:
Zn + 2NH4+ = Zn2++ 2NH3+ H2 ↑
Zn2++ 2NH3 = Zn(NH3)2 2+
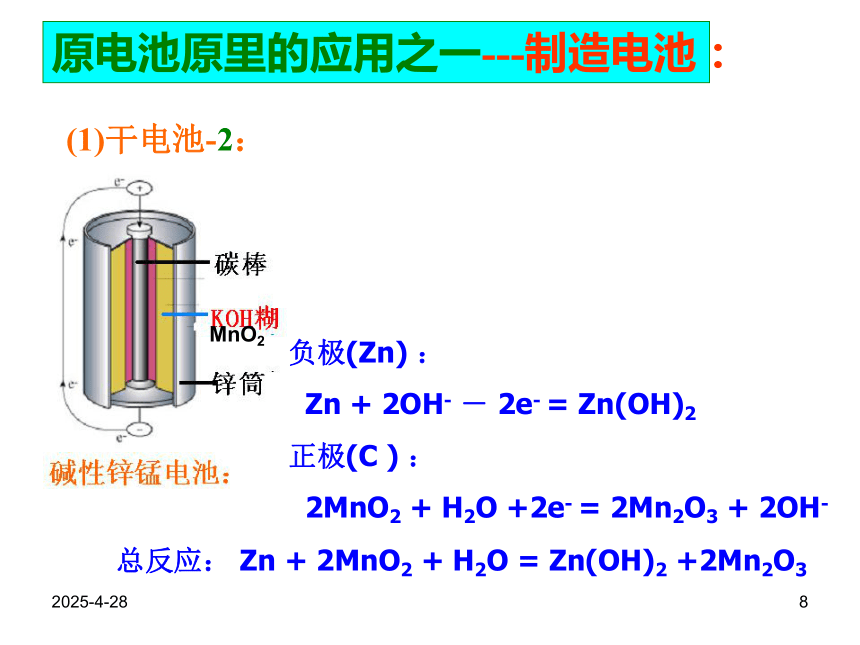
2MnO2 + H2 = 2MnO(OH)原电池原里的应用之一---制造电池:2019/2/288原电池原里的应用之一---制造电池:(1)干电池-2:负极(Zn) :
Zn + 2OH- - 2e- = Zn(OH)2
正极(C ) :
2MnO2 + H2O +2e- = 2Mn2O3 + 2OH-MnO2总反应: Zn + 2MnO2 + H2O = Zn(OH)2 +2Mn2O3 2019/2/289(2)铅蓄电池:负极(Pb ) :
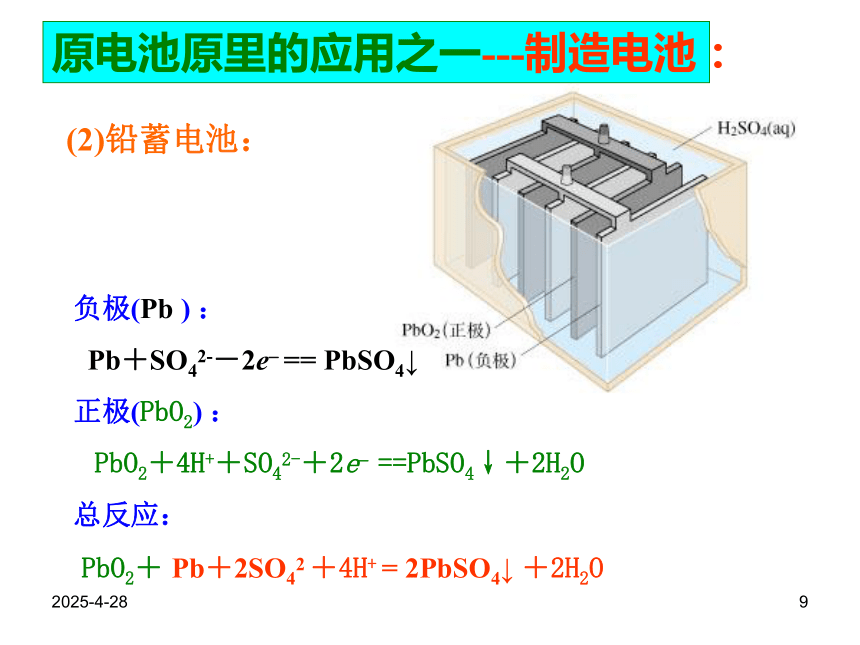
Pb+SO42--2e? == PbSO4↓
正极(PbO2) :
PbO2+4H++SO42-+2e? ==PbSO4↓+2H2O
总反应:
PbO2+ Pb+2SO42 +4H+ = 2PbSO4↓ +2H2O原电池原里的应用之一---制造电池:2019/2/2810(3)锂离子电池:负极( Li) :Li-e- == Li+
正极(MnO2) :MnO2 + Li+ + e- == LiMnO2
总反应: Li+MnO2==LiMnO2原电池原里的应用之一---制造电池:2019/2/2811(4)氢氧燃料电池:酸性溶液:
负极(H2 ) :2H2+- 4e- == 4H+
正极(O2) :O2+ 4H+ +4e- == 2H2O
总反应: 2H2 + O2 == 2H2O 原电池原里的应用之一---制造电池:碱性溶液:
负极(H2 ) :2H2+4OH- - 4e- == 4H2O
正极(O2) :O2+2H2O+4e- == 4OH-
总反应: 2H2 + O2 == 2H2O 2019/2/2812例1:下列叙述中,可以说明金属甲比乙活泼性强的是C.将甲乙作电极组成原电池时甲是负极;A.甲和乙用导线连接插入稀盐酸溶液中,
乙溶解,甲上有H2气放出;B.在氧化–还原反应中,甲比乙失去的电子多;D.同价态的阳离子,甲比乙的氧化性强;(C)原电池原里的应用之二---比较金属活动性:2019/2/2813例2 :
下列制氢气的反应速率最快的是纯锌和 1mol/L 盐酸;B.A.纯锌和1mol/L 硫酸;粗锌和18 mol/L 硫酸;C.纯锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。D.( D )原电池原里的应用之三---比较反应速率:2019/2/2814例3:下列装置中四块相同的Zn片,放置一段时间后腐蚀速
率由慢到快的顺序是(4)(2)(1)(3)原电池原里的应用之三---比较反应速率:2019/2/2815问题讨论(1).(2).判断下列装置是否为原电池?若是, 指出电极名称并写出电极反应式。若将Fe棒C棒粉碎掺在一起制成一光亮的Fe-C合金棒,插在HCl里,则是否构成了原电池?若是,电极反应是什么?长期放置,铁棒表面会有什么变化?原电池原里的应用之四---金属的腐蚀和防护:2019/2/2816(2) 钢铁及其制品通常为含碳的铁合金,若在潮湿的环境里长期放置,常易生锈变红,原因是什么?2019/2/2817钢铁表面形成的微小原电池示意图2019/2/2818知识总结1、2、金属阳离子失e-氧化反应金属腐蚀的类型化学腐蚀电化腐蚀析氢腐蚀吸氧腐蚀(常见普遍)㈠.金属腐蚀金属原子金属腐蚀的本质:3、金属腐蚀:是指金属或合金跟接触的气体或液体发生化学反应(氧化—还原)而腐蚀损耗的过程。2019/2/2819钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图2019/2/2820㈡钢铁腐蚀的防护:例6:改变金属的内部组织结构:如将Cr、Ni等金属加进钢里制成合金钢。⒈A.C.铜的金属活动性比氢小,因此不宜被氧化;B.D.它们的表面都电镀上了一层耐腐蚀的黄金;2000年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首,普通铜器时间稍久容易出现铜绿,其主要成分是[Cu2(OH)2CO3]这三件1760年铜铸的国宝在240 年后看上去仍然熠熠生辉不生锈,下列对起原因的分析,最可能的是环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去;( D )它们是含一定比例金、银、锡、锌的合金;2019/2/28212.金属表面覆盖保护层3.电化学保护法原理:原理 :如油漆、油脂等,电镀(Zn,Cr等易氧化形成致密的氧化
物薄膜)作保护层。隔绝金属与外界空气、电解质溶液的接触。——牺牲阳极的阴极保护法形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。2019/2/2822牺牲阳极的阴极保护法示意图2019/2/2823练习下列各情况,在其中Fe片腐蚀由快到慢的顺序是(5)(2)(1)(3)(4)2019/2/2824原电池小结定义形成条件正负极名称和电子流向判断工作原理(氧化还原反应,写电极反应式)应用分析各种电池。比较金属活动性强弱比较反应速率比较金属腐蚀的快慢判断溶液pH变化金属的腐蚀和防护原电池腐蚀(定义、本质、类型)腐蚀防护(常见三种方法)(从活泼性比较、电子得失、氧还反应等多角度判断)题型(三点记住)2019/2/2825练 习1、 如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若液面上升,则溶液呈 性,发生
腐蚀,电极反应式为:负极: ,
正极: ; 若液面下降,则溶液呈 性,发生
腐蚀,电极反应式为:负极:
正极: 。(2)中性或碱性 吸氧Fe–2e-=Fe2+O2+2H2O+4e-=4OH-酸性析氢Fe–2e-=Fe2+2H++2e-=H2↑ 2019/2/28262、分析右图,按要求写出有关反应方程式:
(1)、铁棒上的电极反应式为:
(2)、碳棒上的电极反应式为:
(3)、溶液中发生反应的化学方程式:
3、镍—镉可充电电池可发生如下反应:Cd+2NiO(OH)+2H2O由此可知,该电池的负极材料是Cd(OH)2+2Ni(OH)2放电充电A. Cd, ( D )B. NiO(OH), D. Ni(OH)2C. Cd(OH)22Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3O2+2H2O+4e-=4OH-2Fe–4e-=2Fe2+2019/2/28274.盐酸与锌片反应时,若加入可溶性醋酸铜
〔(CH3COO)2Cu〕,将产生两种影响生成速率的因素,其
一是: ,
其二是:
;5.有M、N两种金属,分别与盐酸反应,产生H2速率相近,试设计一个实验比较M、N两种金属的活泼性。H+与CH3COO-结合生成CH3COOH,使H+浓度减小,从而减慢了反应速率。Zn置换出Cu形成了原电池,从而加快了反应速率2019/2/28284.钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3 · nH2O(铁锈)通常两种腐蚀同时存在,但以后者更普遍。析氢腐蚀吸氧腐蚀条件水膜呈酸性。水膜呈中性或酸性很弱。CO2+H2O?H2CO3 ? H++HCO 3- 电极反应负极Fe(- )Fe-2e=Fe2+2Fe-4e=2Fe2+正极C(+)2H++2e=H2↑O2+2H2O+4e=4OH-总反应:Fe+2H+=Fe2+↑2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3联系1.化学电池是把化学能直接转化为电能的装置。其反应的基础是氧化还原反应。 2.一次性干电池中的氧化还原反应是不可逆的,放完电之后就不能再使用。而蓄电池中的氧化还原反应是可逆的,它在放电时所进行的氧化还原反应,在充电时可以逆向进行,使生成物恢复原状。 3.从电极材料判断:活泼金属作负极,不活泼金属(或石墨)作正极。从发生的反应判断:发生氧化反应的电极是负极,发生还原反应的电极是正极。 4.家用电器的普及和种类的增加,使得电池的使用量随之剧增。废电池混在垃圾中,不仅污染环境,而且造成浪费。据报道,全国的电池年消耗量为30亿只,因疏于回收而丢失铜740吨,锌1.6万吨,锰粉9.7万吨。另外,普通干电池里含有镉和汞两种元素,这两种元素若污染了土壤和水源,进入人类的食物链,就会发生“水俣病”(汞中毒)和“痛痛病”(镉中毒),这两种工业公害病,都在日本发生过,造成很多人死亡。 为防止悲剧重演,我们应该把废旧电池与其他垃圾分开,集中回收。许多国家都很重视废旧电池的回收,如德国的很多商店要求顾客在购买电池时,同时要把废旧电池交回商店;日本的分类垃圾箱里有一种专门放废旧电池的黄色垃圾箱,垃圾箱的投入口有三个,分别标有普通电池、纽扣电池和其他电池。教材习题参考答案
原电池中的化学反应有什么特征?
2、构成原电池的条件是什么?
3、原电池的正负极和电子流向如何判断?
4、如何书写电极反应和电池反应?
5、原电池的工作原理是什么?REVIEW结论:原电池装置特点:化学能转化为电能
形成条件:⑴两个活泼性不同的电极;
⑵电解质溶液;
⑶形成闭合回路
电极名称:负极:较活泼金属;
正极:较不活泼金属或能导电的非金属。
反应原理:
负极:发生氧化反应,负极本身失电子 。
正极:发生还原反应,溶液中阳离子得电子。
电子流向:
负极正极2019/2/283判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.①②③(×)(×)(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑
2019/2/284⑤④(∨)(∨)负极:正极:总反应:正极:负极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO42019/2/285 ⑦⑥(×)(∨)负极:正极:总反应:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu或 Zn+CuSO4=ZnSO4+Cu2019/2/286原电池原理的应用锂电池发展中的化学电源2019/2/287(1)干电池-1:负极(Zn) : Zn -2e- = Zn2+
正极(Cu) :2NH4++2e- = 2NH3+ H2↑
总反应:
Zn + 2NH4+ = Zn2++ 2NH3+ H2 ↑
Zn2++ 2NH3 = Zn(NH3)2 2+
2MnO2 + H2 = 2MnO(OH)原电池原里的应用之一---制造电池:2019/2/288原电池原里的应用之一---制造电池:(1)干电池-2:负极(Zn) :
Zn + 2OH- - 2e- = Zn(OH)2
正极(C ) :
2MnO2 + H2O +2e- = 2Mn2O3 + 2OH-MnO2总反应: Zn + 2MnO2 + H2O = Zn(OH)2 +2Mn2O3 2019/2/289(2)铅蓄电池:负极(Pb ) :
Pb+SO42--2e? == PbSO4↓
正极(PbO2) :
PbO2+4H++SO42-+2e? ==PbSO4↓+2H2O
总反应:
PbO2+ Pb+2SO42 +4H+ = 2PbSO4↓ +2H2O原电池原里的应用之一---制造电池:2019/2/2810(3)锂离子电池:负极( Li) :Li-e- == Li+
正极(MnO2) :MnO2 + Li+ + e- == LiMnO2
总反应: Li+MnO2==LiMnO2原电池原里的应用之一---制造电池:2019/2/2811(4)氢氧燃料电池:酸性溶液:
负极(H2 ) :2H2+- 4e- == 4H+
正极(O2) :O2+ 4H+ +4e- == 2H2O
总反应: 2H2 + O2 == 2H2O 原电池原里的应用之一---制造电池:碱性溶液:
负极(H2 ) :2H2+4OH- - 4e- == 4H2O
正极(O2) :O2+2H2O+4e- == 4OH-
总反应: 2H2 + O2 == 2H2O 2019/2/2812例1:下列叙述中,可以说明金属甲比乙活泼性强的是C.将甲乙作电极组成原电池时甲是负极;A.甲和乙用导线连接插入稀盐酸溶液中,
乙溶解,甲上有H2气放出;B.在氧化–还原反应中,甲比乙失去的电子多;D.同价态的阳离子,甲比乙的氧化性强;(C)原电池原里的应用之二---比较金属活动性:2019/2/2813例2 :
下列制氢气的反应速率最快的是纯锌和 1mol/L 盐酸;B.A.纯锌和1mol/L 硫酸;粗锌和18 mol/L 硫酸;C.纯锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。D.( D )原电池原里的应用之三---比较反应速率:2019/2/2814例3:下列装置中四块相同的Zn片,放置一段时间后腐蚀速
率由慢到快的顺序是(4)(2)(1)(3)原电池原里的应用之三---比较反应速率:2019/2/2815问题讨论(1).(2).判断下列装置是否为原电池?若是, 指出电极名称并写出电极反应式。若将Fe棒C棒粉碎掺在一起制成一光亮的Fe-C合金棒,插在HCl里,则是否构成了原电池?若是,电极反应是什么?长期放置,铁棒表面会有什么变化?原电池原里的应用之四---金属的腐蚀和防护:2019/2/2816(2) 钢铁及其制品通常为含碳的铁合金,若在潮湿的环境里长期放置,常易生锈变红,原因是什么?2019/2/2817钢铁表面形成的微小原电池示意图2019/2/2818知识总结1、2、金属阳离子失e-氧化反应金属腐蚀的类型化学腐蚀电化腐蚀析氢腐蚀吸氧腐蚀(常见普遍)㈠.金属腐蚀金属原子金属腐蚀的本质:3、金属腐蚀:是指金属或合金跟接触的气体或液体发生化学反应(氧化—还原)而腐蚀损耗的过程。2019/2/2819钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图2019/2/2820㈡钢铁腐蚀的防护:例6:改变金属的内部组织结构:如将Cr、Ni等金属加进钢里制成合金钢。⒈A.C.铜的金属活动性比氢小,因此不宜被氧化;B.D.它们的表面都电镀上了一层耐腐蚀的黄金;2000年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首,普通铜器时间稍久容易出现铜绿,其主要成分是[Cu2(OH)2CO3]这三件1760年铜铸的国宝在240 年后看上去仍然熠熠生辉不生锈,下列对起原因的分析,最可能的是环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去;( D )它们是含一定比例金、银、锡、锌的合金;2019/2/28212.金属表面覆盖保护层3.电化学保护法原理:原理 :如油漆、油脂等,电镀(Zn,Cr等易氧化形成致密的氧化
物薄膜)作保护层。隔绝金属与外界空气、电解质溶液的接触。——牺牲阳极的阴极保护法形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。2019/2/2822牺牲阳极的阴极保护法示意图2019/2/2823练习下列各情况,在其中Fe片腐蚀由快到慢的顺序是(5)(2)(1)(3)(4)2019/2/2824原电池小结定义形成条件正负极名称和电子流向判断工作原理(氧化还原反应,写电极反应式)应用分析各种电池。比较金属活动性强弱比较反应速率比较金属腐蚀的快慢判断溶液pH变化金属的腐蚀和防护原电池腐蚀(定义、本质、类型)腐蚀防护(常见三种方法)(从活泼性比较、电子得失、氧还反应等多角度判断)题型(三点记住)2019/2/2825练 习1、 如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若液面上升,则溶液呈 性,发生
腐蚀,电极反应式为:负极: ,
正极: ; 若液面下降,则溶液呈 性,发生
腐蚀,电极反应式为:负极:
正极: 。(2)中性或碱性 吸氧Fe–2e-=Fe2+O2+2H2O+4e-=4OH-酸性析氢Fe–2e-=Fe2+2H++2e-=H2↑ 2019/2/28262、分析右图,按要求写出有关反应方程式:
(1)、铁棒上的电极反应式为:
(2)、碳棒上的电极反应式为:
(3)、溶液中发生反应的化学方程式:
3、镍—镉可充电电池可发生如下反应:Cd+2NiO(OH)+2H2O由此可知,该电池的负极材料是Cd(OH)2+2Ni(OH)2放电充电A. Cd, ( D )B. NiO(OH), D. Ni(OH)2C. Cd(OH)22Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3O2+2H2O+4e-=4OH-2Fe–4e-=2Fe2+2019/2/28274.盐酸与锌片反应时,若加入可溶性醋酸铜
〔(CH3COO)2Cu〕,将产生两种影响生成速率的因素,其
一是: ,
其二是:
;5.有M、N两种金属,分别与盐酸反应,产生H2速率相近,试设计一个实验比较M、N两种金属的活泼性。H+与CH3COO-结合生成CH3COOH,使H+浓度减小,从而减慢了反应速率。Zn置换出Cu形成了原电池,从而加快了反应速率2019/2/28284.钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3 · nH2O(铁锈)通常两种腐蚀同时存在,但以后者更普遍。析氢腐蚀吸氧腐蚀条件水膜呈酸性。水膜呈中性或酸性很弱。CO2+H2O?H2CO3 ? H++HCO 3- 电极反应负极Fe(- )Fe-2e=Fe2+2Fe-4e=2Fe2+正极C(+)2H++2e=H2↑O2+2H2O+4e=4OH-总反应:Fe+2H+=Fe2+↑2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3联系1.化学电池是把化学能直接转化为电能的装置。其反应的基础是氧化还原反应。 2.一次性干电池中的氧化还原反应是不可逆的,放完电之后就不能再使用。而蓄电池中的氧化还原反应是可逆的,它在放电时所进行的氧化还原反应,在充电时可以逆向进行,使生成物恢复原状。 3.从电极材料判断:活泼金属作负极,不活泼金属(或石墨)作正极。从发生的反应判断:发生氧化反应的电极是负极,发生还原反应的电极是正极。 4.家用电器的普及和种类的增加,使得电池的使用量随之剧增。废电池混在垃圾中,不仅污染环境,而且造成浪费。据报道,全国的电池年消耗量为30亿只,因疏于回收而丢失铜740吨,锌1.6万吨,锰粉9.7万吨。另外,普通干电池里含有镉和汞两种元素,这两种元素若污染了土壤和水源,进入人类的食物链,就会发生“水俣病”(汞中毒)和“痛痛病”(镉中毒),这两种工业公害病,都在日本发生过,造成很多人死亡。 为防止悲剧重演,我们应该把废旧电池与其他垃圾分开,集中回收。许多国家都很重视废旧电池的回收,如德国的很多商店要求顾客在购买电池时,同时要把废旧电池交回商店;日本的分类垃圾箱里有一种专门放废旧电池的黄色垃圾箱,垃圾箱的投入口有三个,分别标有普通电池、纽扣电池和其他电池。教材习题参考答案
