原电池[下学期]
图片预览


文档简介
(共10张PPT)
乐清市虹桥中学高二化学备课组
邵益君
原电池原理 及其应用
第一课时
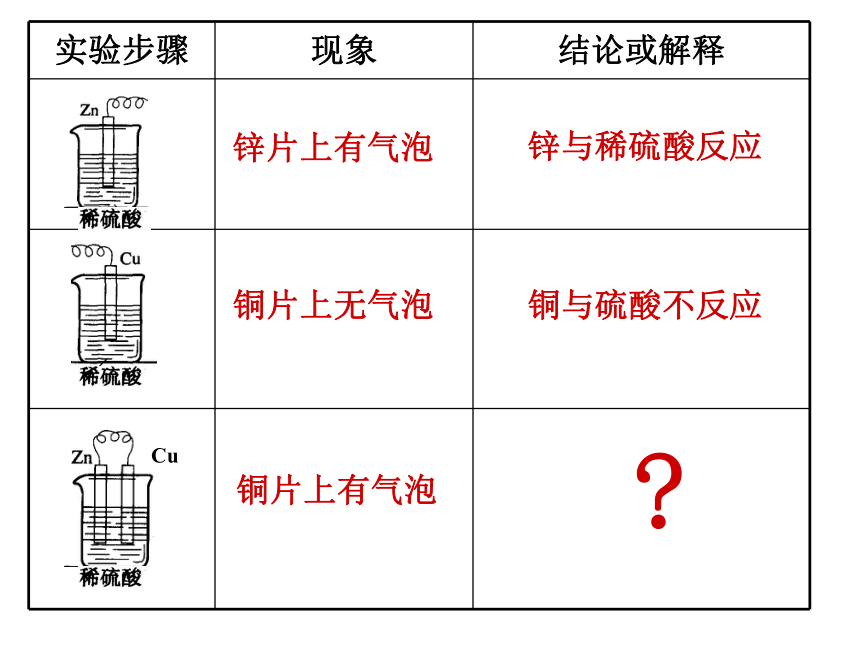
实验步骤 现象 结论或解释
锌片上有气泡
锌与稀硫酸反应
铜片上无气泡
铜与硫酸不反应
铜片上有气泡
Cu
讨论:
铜片上的气体是哪里来的?
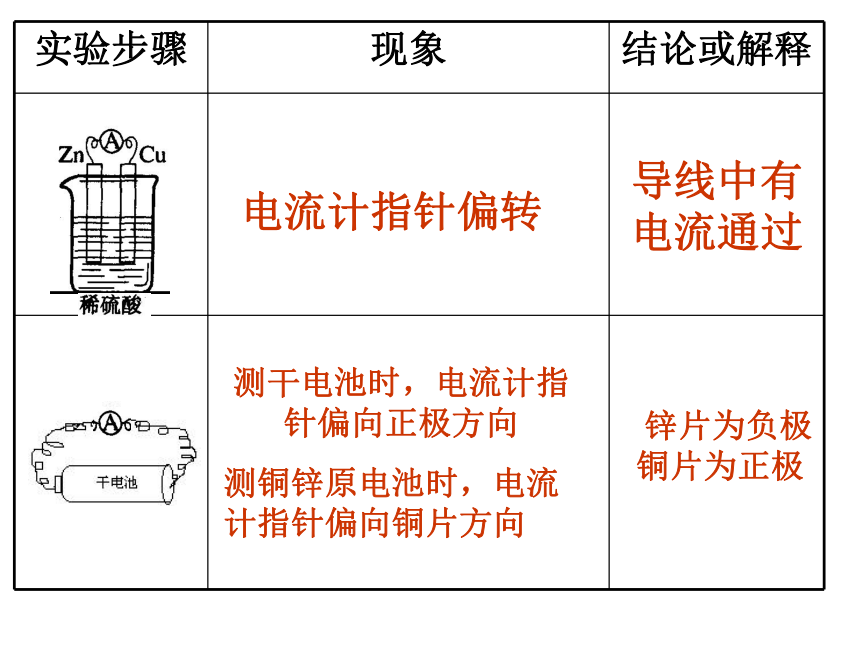
实验步骤 现象 结论或解释
电流计指针偏转
导线中有电流通过
测干电池时,电流计指针偏向正极方向
测铜锌原电池时,电流计指针偏向铜片方向
锌片为负极 铜片为正极
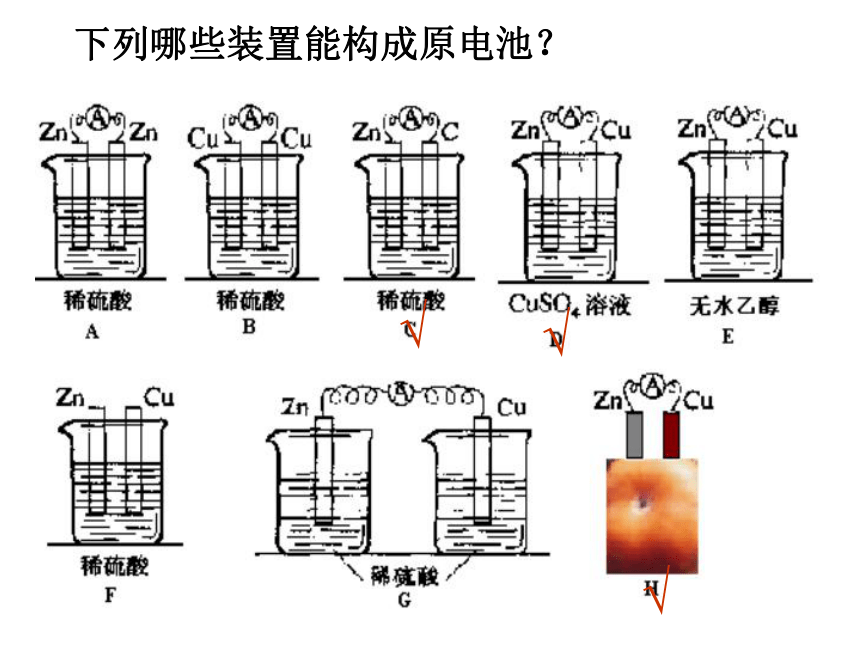
下列哪些装置能构成原电池?
√
√
√
组成原电池的条件:
1.有两种活动性不同的金属(或
一种非金属导体)作电极
2.两电极均插入电解质溶液中
3.两极相连形成闭合回路
负极(锌片): Zn -2e - = Zn 2+
负极(锌片): Zn -2e - = Zn 2+
正极(石墨): 2H++2e - = H2 ↑
正极(铜片): Cu2+ + 2e - = Cu
Zn + 2H+ = Zn 2+ + H2 ↑
Zn + Cu2+ = Zn 2+ + Cu
Cu
Ag
以下装置是否构成原电池?
请将氧化还原反应:Fe + Cu2+ = Cu + Fe2+
Fe
比Fe不活泼的金属或石墨
CuSO4 、CuCl2等
设计成原电池。
负极:
正极:
电解质溶液:
1.课本习题一、1.3.4;二、1.2.3.
2.回家搜集废干电池并拆开,弄清
它的构造及原理。
作业:
乐清市虹桥中学高二化学备课组
邵益君
原电池原理 及其应用
第一课时
实验步骤 现象 结论或解释
锌片上有气泡
锌与稀硫酸反应
铜片上无气泡
铜与硫酸不反应
铜片上有气泡
Cu
讨论:
铜片上的气体是哪里来的?
实验步骤 现象 结论或解释
电流计指针偏转
导线中有电流通过
测干电池时,电流计指针偏向正极方向
测铜锌原电池时,电流计指针偏向铜片方向
锌片为负极 铜片为正极
下列哪些装置能构成原电池?
√
√
√
组成原电池的条件:
1.有两种活动性不同的金属(或
一种非金属导体)作电极
2.两电极均插入电解质溶液中
3.两极相连形成闭合回路
负极(锌片): Zn -2e - = Zn 2+
负极(锌片): Zn -2e - = Zn 2+
正极(石墨): 2H++2e - = H2 ↑
正极(铜片): Cu2+ + 2e - = Cu
Zn + 2H+ = Zn 2+ + H2 ↑
Zn + Cu2+ = Zn 2+ + Cu
Cu
Ag
以下装置是否构成原电池?
请将氧化还原反应:Fe + Cu2+ = Cu + Fe2+
Fe
比Fe不活泼的金属或石墨
CuSO4 、CuCl2等
设计成原电池。
负极:
正极:
电解质溶液:
1.课本习题一、1.3.4;二、1.2.3.
2.回家搜集废干电池并拆开,弄清
它的构造及原理。
作业:
