电离平衡2[上学期]
图片预览




文档简介
学科:化学
教学内容:电离平衡
【基础知识导引】
1.为什么NaC1熔融时能导电,但液态HC1却不能导电?为什么相同物质的量浓度的盐酸和醋酸溶液做导电性实验时,盐酸的灯泡比较亮?
2.向稀醋酸溶液中滴入石蕊试液,溶液呈红色,加热后溶液颜色加深,为什么?
【重点难点解析】
重点讲解
1.强电解质和弱电解质
根据电解质在水溶液里电离能力的大小又可将电解质分为强电解质和弱电解质.能完全电离的电解质叫做强电解质,如强酸、强碱和绝大多数盐,其电离方程式用“”表示,例如:,.只能部分电离的电解质叫做弱电解质,如弱酸、弱碱等.其电离过程可逆,故电离方程式用“”表示.例如:,
弱电解质在水溶液中发生电离的“部分”大小是有差异的,这体现了弱电解质的相对强弱,可用特定的方法定量地表示不同弱电解质在相同条件下的电离程度的差异.
2.弱电解质电离平衡的实质
溶液中弱电解质的电离和离子的重新结合这两种过程是同时存在的(可逆反应),在一定条件下,当两者的速率相等时,就达到了平衡状态,这称为电离平衡.
平衡时,溶液里离子的浓度和分子浓度都保持不变.如:氨水中存在着平衡:,溶液中既有离子,又有电解质分子存在,而且溶液中、、保持不变.
电离平衡是相对的、有条件的,当外界条件改变时,平衡就会发生移动.
3.影响弱电解质电离程度大小的因素
决定因素:弱电解质的相对强弱.
弱电解质的相对强弱电离度的大小.
弱电解质的相对强弱与弱电解质分子结构有关,取决于其分子中共价键的极性强弱,是该电解质分子和“本性”.
影响因素:
(1)浓度的影响:同一弱电解质,通常是溶液越稀,电离度越大.
(2)温度的影响:升高温度,电解质的电离程度增大.
(3)外加试剂的影响:外加试剂改变了溶液中离子的浓度,也会对电离平衡有所影响.
4.弱电解质电离程度大小的表示方法——电离平衡常数
与化学平衡一样,在一定条件下,弱电解质的电离达到平衡时,溶液中各组分浓度之间也存在着一定的关系,可以用电离常数来表示.
如:对于反应AB,.K值越大,表示该电解质电离程度越大,所以可以用K的大小来判断弱电解质的相对强弱.
电离平衡常数与化学平衡常数一样,只受温度的影响;电离常数越大,表示该弱电解质的电离程度越大,电离能力越强.
难点突破
1.物质溶解度大小与电离能力强弱
强、弱电解质是根据电解质在水溶液中能否全部电离来区分的.
这里的“在水溶液中”,应理解为“已经溶解于水的”,不管溶解度是大还是小,若已溶于水的那部分电解质能完全电离,就是强电解质;若已溶解在水中那部分电解质只能部分电离就是弱电解质.换言之,电解质的强弱是指电解质电离能力的大小,与电解质的溶解度无关.
例如,、等难溶性盐,虽然它们的溶解度很小,但溶解的那一部分可以完全电离,所以它们是强电解质.
2.溶液导电能力大小的判断
电解质溶液导电是由于其中存在可以自由移动的离子,其导电能力的强弱与溶液中的自由移动的离子浓度、离子所带的电荷数和温度有关,若温度相同,关键取决于离子浓度的大小,而离子浓度的大小由电解质溶液的浓度和电解质的电离程度共同决定.所以我们不能武断地说:强电解质溶液的导电性就一定强.
解决此类问题时,需要将有关电解质的基本概念、外界因素对弱电解质电离程度的影响、溶液混合时可能发生的化学反应、溶液体积的变化等因素综合考虑,这样才能正确判断溶液中离子浓度的大小,才能正确判断溶液的导电能力的强弱.
【难题巧解点拨】
例1 强电解质和弱电解质的本质区别在于( )
A.物质的量浓度相同时,溶液导电能力的强和弱
B.物质的量浓度相同时,溶液离子浓度的大和小
C.水溶液中是否存在着电离平衡
D.电离程度的大小
解析:本题考查的知识点是有关强、弱电解质的基础知识.
强、弱电解质的电离能力不同,所以当物质的量浓度相同时,溶液中的离子浓度不同,溶液的导电性也不同.而弱电解质之所以在水溶液中电离程度较小,就是因为存在着电离平衡,其电离过程可逆,只能部分电离.
答案:C
点悟:解此题的关键点是明确题目的要求——“本质区别”
理清弱电解质“在水溶液中存在电离平衡”与“电解质电离程度大小”、“溶液离子浓度大小”、“溶液导电性能力大小”之间的因果关系.
解此题时还容易出现的错误是不能正确区分“溶液浓度”和“离子浓度”两个概念.
例2 下列三种酸溶液:0.50mol/L氢溴酸溶液40mL、0.50mol/L硫酸溶液20mL、0.50mol/L醋酸溶液80mL分别与锌粉反应产生氢气由快到慢的顺序是_________________________.
解析:本题考查的知识点是影响化学反应速率的因素和电解质的电离程度的比较.
三种酸溶液分别与锌粉反应,实质上都是酸电离出的与金属锌反应,故产生氢气的速度决定于酸溶液中的大小,而与溶液的物质的量浓度、酸的电离有关.氢溴酸是一元强酸,在水溶液中完全电离,溶液中;硫酸是二元强酸,溶液中;醋酸是一元弱酸,在其水溶液中只有少量电离,故溶液中远低于0.50mol/L.
答案:硫酸>氢溴酸>醋酸
点悟:解决此题的关键点是理清“反应速率——离子浓度——电解质溶液浓度和电离程度”之间的关系.
解题易错点是受题中设置的迷惑性信息(40mL、20mL、80mL等溶液体积)的误导,错误地以溶液中离子的物质的量来衡量反应的速率.
例3 化合物HIn的水溶液中因存在以下电离平衡,故用作酸碱指示剂.
HIn(溶液)
红色 黄色
浓度为0.02mol/L的下列各溶液:(1)盐酸,(2)石灰水;(3)NaC1溶液,(4)溶液,(5),(6)氨水.其中能使指示剂显红色的是( )
A.(1)(4)(5) B.(2)(5)(6)
C.(1)(4) D.(2)(3)(6)
解析:本题考查的知识点是外界条件对弱电解质电离平衡的影响.
由电离平衡看出,要使指示剂显红色,必须使平衡向左移动,即应加入,以增加.在题中所给出的试剂中,(1)、(4)是酸性物质,而(2)中的、(5)中的和(6)中的都能与发生反应而消耗.
答案:C
点悟:解此题易错点:将和的电离情况混为一谈.避免此类错误的关键是弄清强酸和弱酸的电离程度的不同,在稀溶液中全部电离成和形式存在.故溶液显酸性.
【拓展延伸探究】
例1 向0.1mol/L的醋酸溶液中加水,电离平衡:将向_____________方向移动(填“左”、“右”或“不移动”);溶液中和的物质的量将_____________(填“增大”、“减小”或“不变”);和将_____________(填“增大”、“减小”或“不变”).
解析:本题考查的知识点是溶液稀释对弱电解质电离平衡的影响.
加水稀释,使溶液浓度减小,电解质电离的程度增大,电离出的离子也增多,但溶液体积也增大,离子浓度反而减小,所以导电性应减弱.
答案:右;增大;减小.
点悟:解此题的关键是应明确“离子浓度”是由“离子的物质的量”和“溶液体积”两个因素共同决定的,即.判断离子浓度的变化必须综合考虑这两个因素的变化.
也可根据勒沙特列原理来解释这个问题:溶液稀释引起的改变是“使单位体积内溶质粒子数量减小”,故平衡将向电离出更多粒子的方向移动,以“减弱”这种改变,但“减弱”并非“抵消”,所以溶液中离子浓度仍应减小(只是减小的程度少一些).
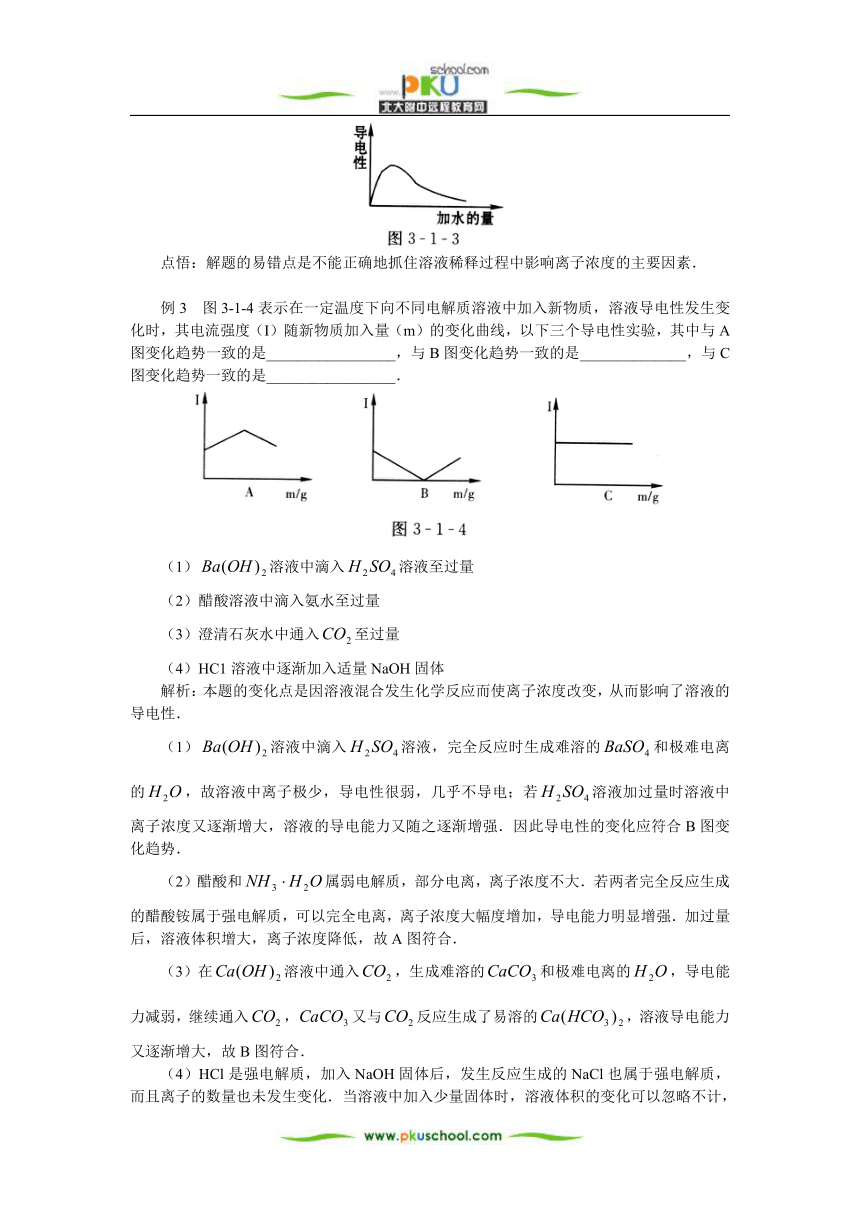
例2 向冰醋酸中不断加水并测其导电性,在右图中画出溶液导电性变化的曲线.
解析:本题的变化点是将溶液中离子浓度与溶液的导电性联系了起来.
冰醋酸是无水乙酸,属于纯净物.由于没有水存在,醋酸未发生电离,因而不能导电.但加入水后,醋酸发生了电离,离子“从无到有”浓度增大,溶液导电性也增强.继续加水稀释,溶液浓度减小,电离程度增大,离子浓度增大的因素强于溶液体积扩大的因素,因而溶液的导电性增强.但稀释一段时间后,溶液体积扩大的作用大于离子数量增加的作用,所以溶液的导电性继而将减弱.
答案:如下图
点悟:解题的易错点是不能正确地抓住溶液稀释过程中影响离子浓度的主要因素.
例3 图3-1-4表示在一定温度下向不同电解质溶液中加入新物质,溶液导电性发生变化时,其电流强度(I)随新物质加入量(m)的变化曲线,以下三个导电性实验,其中与A图变化趋势一致的是_________________,与B图变化趋势一致的是______________,与C图变化趋势一致的是_________________.
(1)溶液中滴入溶液至过量
(2)醋酸溶液中滴入氨水至过量
(3)澄清石灰水中通入至过量
(4)HC1溶液中逐渐加入适量NaOH固体
解析:本题的变化点是因溶液混合发生化学反应而使离子浓度改变,从而影响了溶液的导电性.
(1)溶液中滴入溶液,完全反应时生成难溶的和极难电离的,故溶液中离子极少,导电性很弱,几乎不导电;若溶液加过量时溶液中离子浓度又逐渐增大,溶液的导电能力又随之逐渐增强.因此导电性的变化应符合B图变化趋势.
(2)醋酸和属弱电解质,部分电离,离子浓度不大.若两者完全反应生成的醋酸铵属于强电解质,可以完全电离,离子浓度大幅度增加,导电能力明显增强.加过量后,溶液体积增大,离子浓度降低,故A图符合.
(3)在溶液中通入,生成难溶的和极难电离的,导电能力减弱,继续通入,又与反应生成了易溶的,溶液导电能力又逐渐增大,故B图符合.
(4)HCl是强电解质,加入NaOH固体后,发生反应生成的NaCl也属于强电解质,而且离子的数量也未发生变化.当溶液中加入少量固体时,溶液体积的变化可以忽略不计,故反应前后导电能力几乎不变,C图符合.
答案:(2);(1)(3);(4)
点悟:解题的关键点是弄清溶液混合,因发生反应使物质溶解度、电离程度的变化以及溶液体积改变引起的溶液中离子浓度的变化.
想一想,若向盐酸中逐渐加入等物质的量浓度、等体积的NaOH溶液,其导电性应如何变化?
【命题趋势分析】
(一)利用勒沙特列原理解释“稀释促进电离”的原因
因为稀释后,单位体积溶液内溶质的微粒数目(分子和离子的总和)减少.根据勒沙特列原理:为了减弱这种改变,平衡向着溶质微粒数目增加的方向移动——向着电离的方向移动,所以电离程度增大.
(二)将理论与实际应用相结合
外加试剂可改变溶液中离子的浓度,对电离平衡有所影响.
如:氨水中存在着平衡,向该平衡体系中加入盐酸,可使减小,平衡将向右移动;若加入NaOH(固),增大,平衡就会向左移动.
所以,实验室可采用向浓氨水中加入强碱的方法来制取氨气.
【同步达纲练习】
1.下列叙述正确的是( )
A.氯化钠溶液在电流作用下电离成钠离子和氯离子
B.溶于水后能电离出氢离子的化合物都是酸
C.硫酸钡难溶于水,但硫酸钡属于强电解质
D.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
2.下列各组物质中,全都是强电解质的一组是( )
A. B.
C. D.
3.下列物质中导电性能最差的是( )
A.熔融的氢氧化钠 B.石墨棒
C.盐酸溶液 D.固态氯化钾
4.下列说法正确的是( )
A.固态共价化合物不导电,熔融的共价化合物可以导电
B.强电解质溶液的导电性一定比弱电解质溶液的导电性强
C.离子晶体肯定是强电解质,具有极性键的化合物也有可能是强电解质
D.电解质溶液的导电性主要决定于电离出来的离子的多少.离子数目多,导电能力强;离子数目少,导电能力弱.
5.在的极稀溶液和熔融状态下都存在的离子是( )
A. B.
C. D.
6.甲酸的下列性质中,可以证明它是弱电解质的是( )
A.1mol/L的甲酸溶液的为0.01mol/L
B.甲酸能与水以任意比例互溶
C.10mL 1mol/L的甲酸恰好与10mL 1mol/L的NaOH溶液完全反应
D.在相同条件下,甲酸溶液的导电性比盐酸的弱
7.把质量为2.8g的KOH固体分别加入下列100mL溶液中,使溶液的导电能力增强的是( )
A.含的自来水 B.0.50mol/L的盐酸
C.0.50mol/L的醋酸 D.0.50mol/L的溶液
8.下列电离方程式中,正确的是( )
A.
B.
C.
D.
9.下列物质的水溶液中,存在电离平衡的是( )
A. B.
C. D.
10.下列说法正确的是( )
A.强、弱电解质的导电性只由它的浓度决定
B.强、弱电解质的导电性没有本质的区别
C.强电解质的导电能力强,弱电解质的导电能力弱
D.导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多
11.下列叙述中错误的是( )
A.离子键和强极性键组成的化合物一般是强电解质
B.较弱极性键组成的极性化合物一般是弱电解质
C.具有强极性键的化合物一定是强电解质
D.具有离子键的难溶强电解质不存在电离平衡
12.在25℃时,相同浓度的下列酸溶液中酸性最弱的是( )
A.0.10mol/L的溶液 B.0.10mol/L的HCOOH溶液
C.0.10mol/L的 D.0.10mol/L的溶液
13.将一定体积的0.1mol/L醋酸溶液蒸发掉1/2体积的水(假设没有挥发).下列叙述中正确的是( )
A.溶液中减小
B.电离程度减小
C.溶液导电能力增强
D.中和此溶液所需0.1mol/L NaOH溶液的体积减小
14.欲使某弱酸HX的电离程度增大、溶液中减小的措施有( )
A.加水稀释 B.加NaX
C.加热 D.加镁粉
15.下列物质加入到氢硫酸溶液中,会使溶液中硫离子浓度增大的是( )
A.溶液 B.氨气
C.稀 D.
16.的A、B两种酸溶液各1mL,分别加水稀释至1000mL,其与溶液体积的关系如图所示,下列说法中正确的是( )
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸的电离度比B酸的电离度增大得多
C.若,则A是强酸,B是弱酸
D.若A、B都是弱酸,则
17.某温度下,在醋酸溶液中存在着如下平衡:
当向溶液中加水稀释时,醋酸的电离程度都增大,试用电离常数的有关知识来解释这一改变.
18.在稀氨水中有如下平衡:,试分析当外界条件改变时,稀氨水的电离平衡和电离程度的影响.
(1)加入少量NaOH溶液,平衡向______________(填“正”、“逆”,下同)方向移动,电离程度__________(填“增大”、“减小”,下同);
(2)加少量,平衡向___________方向移动,电离程度________;
(3)加适量水,平衡向________方向移动,电离程度______________;
(4)降温,平衡向____________方向移动,电离程度__________.
19.(1)体积为20mL,溶液浓度为0.50mol/L的盐酸和醋酸溶液,跟足量Mg反应时,反应速率大的是________(填“前者”、“后者”),产生的体积同为________mL;与NaOH溶液发生中和反应时,耗用NaOH溶液体积_______(填“相同”、“不同”).
(2)体积为10mL,浓度同为0.50mol/L的盐酸和醋酸溶液,跟足量Mg反应时,反应速率大的是______(填“前者”、“后者”),产生的体积_______(填“相同”、“不同”);与NaOH溶液发生中和反应时,耗用NaOH溶液体积______(填“相同”、“不同”).
20.在饱和食盐水中通入氯化氢,可以看到______的现象,这是因为_________.
参考答案
【同步达纲练习】
1.C(点拨:电离是电解质在水分子的作用下离解成自由移动的离子的过程,不需要通电)
2.A(点拨:是中强酸,酸性比碳酸等强,但它在水溶液中仍然存在电离平衡,仍然只能发生部分电离,故属于弱电解质)
3.D(点拨:固态氯化钾中的离子不能自由移动,所以氯化钾在固态时不能导电)
4.C(点拨:极稀的强电解质溶液中离子浓度有可能比较浓的弱电解质溶液中离子浓度小,所以导电性也可能弱)
5.A(点拨:稀溶液中应全部电离生成,在熔融状态下就电离生成、)
6.AD(点拨:弱电解质在水溶液中只能部分电离,故其溶液中离子浓度总是比溶液浓度小,导电性也比同浓度的强酸溶液弱)
7.AC(点拨:自来水中所含的是极少量的,反应后绝大部分KOH剩余.KOH是强电解质,所以溶液离子浓度大大提高)
8.D(点拨:B中电离后应生成和)
9.B(点拨:只有是弱酸,在水溶液中才存在电离平衡)
10.B(点拨:D选项未明确指出两种溶液的体积,所以离子数目的多少不能确定)
11.C(点拨:具有强极性键的化合物一般是强电解质,但也有例外,如HF就是弱酸,属于弱电解质)
12.D(点拨:是中强酸,HCOOH,的酸性都有比碳酸强)
13.BC(点拨:浓缩后,醋酸的电离程度减小,但溶液体积减小更多,故离子浓度增大)
14.AD(点拨:加入NaX会抑制HX的电离)
15.B(点拨:A中可与反应生成CuS沉淀)
16.CD(点拨:将强酸稀释n倍,其将减小为原来的1/n;而将弱酸稀释n倍,由于稀释促进了电离,其将大于为原来的1/n)
17.该温度下,醋酸在溶液中电离达到平衡时,溶液中各离子的浓度之间存在如下关系:
,当加水将溶液体积稀释到原来的n倍时,、均减小,但由于醋酸的电离常数K不变,所以应大于原来的1/n,而应小于原来的1/n.故发生电离的醋酸分子更多了,即醋酸的电离程度增大.
18.(1)逆,减小;(2)逆,减小;(3)正,增大;(4)逆,减小
(点拨:加少量NaOH溶液,溶液中增大,稀氨水的电离平衡向逆方向移动,氨水的电离程度减小.加入少量,溶液中增大,稀氨水的电离平衡向逆方向移动,氨水的电离程度减小.加入适量水,氨水的浓度变小,溶液中和离子互相碰撞而结合成分子的机会减小,电离程度增大,平衡向正方向移动.因为氨水的电离过程是吸热过程,所以降温后平衡向逆方向移动)
19.(1)前者 112 相同
(2)后者 不同 不同
20.有白色食盐晶体析出;通入HCl,,增大而使溶解平衡向生成NaCl固体的方向移动
教学内容:电离平衡
【基础知识导引】
1.为什么NaC1熔融时能导电,但液态HC1却不能导电?为什么相同物质的量浓度的盐酸和醋酸溶液做导电性实验时,盐酸的灯泡比较亮?
2.向稀醋酸溶液中滴入石蕊试液,溶液呈红色,加热后溶液颜色加深,为什么?
【重点难点解析】
重点讲解
1.强电解质和弱电解质
根据电解质在水溶液里电离能力的大小又可将电解质分为强电解质和弱电解质.能完全电离的电解质叫做强电解质,如强酸、强碱和绝大多数盐,其电离方程式用“”表示,例如:,.只能部分电离的电解质叫做弱电解质,如弱酸、弱碱等.其电离过程可逆,故电离方程式用“”表示.例如:,
弱电解质在水溶液中发生电离的“部分”大小是有差异的,这体现了弱电解质的相对强弱,可用特定的方法定量地表示不同弱电解质在相同条件下的电离程度的差异.
2.弱电解质电离平衡的实质
溶液中弱电解质的电离和离子的重新结合这两种过程是同时存在的(可逆反应),在一定条件下,当两者的速率相等时,就达到了平衡状态,这称为电离平衡.
平衡时,溶液里离子的浓度和分子浓度都保持不变.如:氨水中存在着平衡:,溶液中既有离子,又有电解质分子存在,而且溶液中、、保持不变.
电离平衡是相对的、有条件的,当外界条件改变时,平衡就会发生移动.
3.影响弱电解质电离程度大小的因素
决定因素:弱电解质的相对强弱.
弱电解质的相对强弱电离度的大小.
弱电解质的相对强弱与弱电解质分子结构有关,取决于其分子中共价键的极性强弱,是该电解质分子和“本性”.
影响因素:
(1)浓度的影响:同一弱电解质,通常是溶液越稀,电离度越大.
(2)温度的影响:升高温度,电解质的电离程度增大.
(3)外加试剂的影响:外加试剂改变了溶液中离子的浓度,也会对电离平衡有所影响.
4.弱电解质电离程度大小的表示方法——电离平衡常数
与化学平衡一样,在一定条件下,弱电解质的电离达到平衡时,溶液中各组分浓度之间也存在着一定的关系,可以用电离常数来表示.
如:对于反应AB,.K值越大,表示该电解质电离程度越大,所以可以用K的大小来判断弱电解质的相对强弱.
电离平衡常数与化学平衡常数一样,只受温度的影响;电离常数越大,表示该弱电解质的电离程度越大,电离能力越强.
难点突破
1.物质溶解度大小与电离能力强弱
强、弱电解质是根据电解质在水溶液中能否全部电离来区分的.
这里的“在水溶液中”,应理解为“已经溶解于水的”,不管溶解度是大还是小,若已溶于水的那部分电解质能完全电离,就是强电解质;若已溶解在水中那部分电解质只能部分电离就是弱电解质.换言之,电解质的强弱是指电解质电离能力的大小,与电解质的溶解度无关.
例如,、等难溶性盐,虽然它们的溶解度很小,但溶解的那一部分可以完全电离,所以它们是强电解质.
2.溶液导电能力大小的判断
电解质溶液导电是由于其中存在可以自由移动的离子,其导电能力的强弱与溶液中的自由移动的离子浓度、离子所带的电荷数和温度有关,若温度相同,关键取决于离子浓度的大小,而离子浓度的大小由电解质溶液的浓度和电解质的电离程度共同决定.所以我们不能武断地说:强电解质溶液的导电性就一定强.
解决此类问题时,需要将有关电解质的基本概念、外界因素对弱电解质电离程度的影响、溶液混合时可能发生的化学反应、溶液体积的变化等因素综合考虑,这样才能正确判断溶液中离子浓度的大小,才能正确判断溶液的导电能力的强弱.
【难题巧解点拨】
例1 强电解质和弱电解质的本质区别在于( )
A.物质的量浓度相同时,溶液导电能力的强和弱
B.物质的量浓度相同时,溶液离子浓度的大和小
C.水溶液中是否存在着电离平衡
D.电离程度的大小
解析:本题考查的知识点是有关强、弱电解质的基础知识.
强、弱电解质的电离能力不同,所以当物质的量浓度相同时,溶液中的离子浓度不同,溶液的导电性也不同.而弱电解质之所以在水溶液中电离程度较小,就是因为存在着电离平衡,其电离过程可逆,只能部分电离.
答案:C
点悟:解此题的关键点是明确题目的要求——“本质区别”
理清弱电解质“在水溶液中存在电离平衡”与“电解质电离程度大小”、“溶液离子浓度大小”、“溶液导电性能力大小”之间的因果关系.
解此题时还容易出现的错误是不能正确区分“溶液浓度”和“离子浓度”两个概念.
例2 下列三种酸溶液:0.50mol/L氢溴酸溶液40mL、0.50mol/L硫酸溶液20mL、0.50mol/L醋酸溶液80mL分别与锌粉反应产生氢气由快到慢的顺序是_________________________.
解析:本题考查的知识点是影响化学反应速率的因素和电解质的电离程度的比较.
三种酸溶液分别与锌粉反应,实质上都是酸电离出的与金属锌反应,故产生氢气的速度决定于酸溶液中的大小,而与溶液的物质的量浓度、酸的电离有关.氢溴酸是一元强酸,在水溶液中完全电离,溶液中;硫酸是二元强酸,溶液中;醋酸是一元弱酸,在其水溶液中只有少量电离,故溶液中远低于0.50mol/L.
答案:硫酸>氢溴酸>醋酸
点悟:解决此题的关键点是理清“反应速率——离子浓度——电解质溶液浓度和电离程度”之间的关系.
解题易错点是受题中设置的迷惑性信息(40mL、20mL、80mL等溶液体积)的误导,错误地以溶液中离子的物质的量来衡量反应的速率.
例3 化合物HIn的水溶液中因存在以下电离平衡,故用作酸碱指示剂.
HIn(溶液)
红色 黄色
浓度为0.02mol/L的下列各溶液:(1)盐酸,(2)石灰水;(3)NaC1溶液,(4)溶液,(5),(6)氨水.其中能使指示剂显红色的是( )
A.(1)(4)(5) B.(2)(5)(6)
C.(1)(4) D.(2)(3)(6)
解析:本题考查的知识点是外界条件对弱电解质电离平衡的影响.
由电离平衡看出,要使指示剂显红色,必须使平衡向左移动,即应加入,以增加.在题中所给出的试剂中,(1)、(4)是酸性物质,而(2)中的、(5)中的和(6)中的都能与发生反应而消耗.
答案:C
点悟:解此题易错点:将和的电离情况混为一谈.避免此类错误的关键是弄清强酸和弱酸的电离程度的不同,在稀溶液中全部电离成和形式存在.故溶液显酸性.
【拓展延伸探究】
例1 向0.1mol/L的醋酸溶液中加水,电离平衡:将向_____________方向移动(填“左”、“右”或“不移动”);溶液中和的物质的量将_____________(填“增大”、“减小”或“不变”);和将_____________(填“增大”、“减小”或“不变”).
解析:本题考查的知识点是溶液稀释对弱电解质电离平衡的影响.
加水稀释,使溶液浓度减小,电解质电离的程度增大,电离出的离子也增多,但溶液体积也增大,离子浓度反而减小,所以导电性应减弱.
答案:右;增大;减小.
点悟:解此题的关键是应明确“离子浓度”是由“离子的物质的量”和“溶液体积”两个因素共同决定的,即.判断离子浓度的变化必须综合考虑这两个因素的变化.
也可根据勒沙特列原理来解释这个问题:溶液稀释引起的改变是“使单位体积内溶质粒子数量减小”,故平衡将向电离出更多粒子的方向移动,以“减弱”这种改变,但“减弱”并非“抵消”,所以溶液中离子浓度仍应减小(只是减小的程度少一些).
例2 向冰醋酸中不断加水并测其导电性,在右图中画出溶液导电性变化的曲线.
解析:本题的变化点是将溶液中离子浓度与溶液的导电性联系了起来.
冰醋酸是无水乙酸,属于纯净物.由于没有水存在,醋酸未发生电离,因而不能导电.但加入水后,醋酸发生了电离,离子“从无到有”浓度增大,溶液导电性也增强.继续加水稀释,溶液浓度减小,电离程度增大,离子浓度增大的因素强于溶液体积扩大的因素,因而溶液的导电性增强.但稀释一段时间后,溶液体积扩大的作用大于离子数量增加的作用,所以溶液的导电性继而将减弱.
答案:如下图
点悟:解题的易错点是不能正确地抓住溶液稀释过程中影响离子浓度的主要因素.
例3 图3-1-4表示在一定温度下向不同电解质溶液中加入新物质,溶液导电性发生变化时,其电流强度(I)随新物质加入量(m)的变化曲线,以下三个导电性实验,其中与A图变化趋势一致的是_________________,与B图变化趋势一致的是______________,与C图变化趋势一致的是_________________.
(1)溶液中滴入溶液至过量
(2)醋酸溶液中滴入氨水至过量
(3)澄清石灰水中通入至过量
(4)HC1溶液中逐渐加入适量NaOH固体
解析:本题的变化点是因溶液混合发生化学反应而使离子浓度改变,从而影响了溶液的导电性.
(1)溶液中滴入溶液,完全反应时生成难溶的和极难电离的,故溶液中离子极少,导电性很弱,几乎不导电;若溶液加过量时溶液中离子浓度又逐渐增大,溶液的导电能力又随之逐渐增强.因此导电性的变化应符合B图变化趋势.
(2)醋酸和属弱电解质,部分电离,离子浓度不大.若两者完全反应生成的醋酸铵属于强电解质,可以完全电离,离子浓度大幅度增加,导电能力明显增强.加过量后,溶液体积增大,离子浓度降低,故A图符合.
(3)在溶液中通入,生成难溶的和极难电离的,导电能力减弱,继续通入,又与反应生成了易溶的,溶液导电能力又逐渐增大,故B图符合.
(4)HCl是强电解质,加入NaOH固体后,发生反应生成的NaCl也属于强电解质,而且离子的数量也未发生变化.当溶液中加入少量固体时,溶液体积的变化可以忽略不计,故反应前后导电能力几乎不变,C图符合.
答案:(2);(1)(3);(4)
点悟:解题的关键点是弄清溶液混合,因发生反应使物质溶解度、电离程度的变化以及溶液体积改变引起的溶液中离子浓度的变化.
想一想,若向盐酸中逐渐加入等物质的量浓度、等体积的NaOH溶液,其导电性应如何变化?
【命题趋势分析】
(一)利用勒沙特列原理解释“稀释促进电离”的原因
因为稀释后,单位体积溶液内溶质的微粒数目(分子和离子的总和)减少.根据勒沙特列原理:为了减弱这种改变,平衡向着溶质微粒数目增加的方向移动——向着电离的方向移动,所以电离程度增大.
(二)将理论与实际应用相结合
外加试剂可改变溶液中离子的浓度,对电离平衡有所影响.
如:氨水中存在着平衡,向该平衡体系中加入盐酸,可使减小,平衡将向右移动;若加入NaOH(固),增大,平衡就会向左移动.
所以,实验室可采用向浓氨水中加入强碱的方法来制取氨气.
【同步达纲练习】
1.下列叙述正确的是( )
A.氯化钠溶液在电流作用下电离成钠离子和氯离子
B.溶于水后能电离出氢离子的化合物都是酸
C.硫酸钡难溶于水,但硫酸钡属于强电解质
D.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
2.下列各组物质中,全都是强电解质的一组是( )
A. B.
C. D.
3.下列物质中导电性能最差的是( )
A.熔融的氢氧化钠 B.石墨棒
C.盐酸溶液 D.固态氯化钾
4.下列说法正确的是( )
A.固态共价化合物不导电,熔融的共价化合物可以导电
B.强电解质溶液的导电性一定比弱电解质溶液的导电性强
C.离子晶体肯定是强电解质,具有极性键的化合物也有可能是强电解质
D.电解质溶液的导电性主要决定于电离出来的离子的多少.离子数目多,导电能力强;离子数目少,导电能力弱.
5.在的极稀溶液和熔融状态下都存在的离子是( )
A. B.
C. D.
6.甲酸的下列性质中,可以证明它是弱电解质的是( )
A.1mol/L的甲酸溶液的为0.01mol/L
B.甲酸能与水以任意比例互溶
C.10mL 1mol/L的甲酸恰好与10mL 1mol/L的NaOH溶液完全反应
D.在相同条件下,甲酸溶液的导电性比盐酸的弱
7.把质量为2.8g的KOH固体分别加入下列100mL溶液中,使溶液的导电能力增强的是( )
A.含的自来水 B.0.50mol/L的盐酸
C.0.50mol/L的醋酸 D.0.50mol/L的溶液
8.下列电离方程式中,正确的是( )
A.
B.
C.
D.
9.下列物质的水溶液中,存在电离平衡的是( )
A. B.
C. D.
10.下列说法正确的是( )
A.强、弱电解质的导电性只由它的浓度决定
B.强、弱电解质的导电性没有本质的区别
C.强电解质的导电能力强,弱电解质的导电能力弱
D.导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多
11.下列叙述中错误的是( )
A.离子键和强极性键组成的化合物一般是强电解质
B.较弱极性键组成的极性化合物一般是弱电解质
C.具有强极性键的化合物一定是强电解质
D.具有离子键的难溶强电解质不存在电离平衡
12.在25℃时,相同浓度的下列酸溶液中酸性最弱的是( )
A.0.10mol/L的溶液 B.0.10mol/L的HCOOH溶液
C.0.10mol/L的 D.0.10mol/L的溶液
13.将一定体积的0.1mol/L醋酸溶液蒸发掉1/2体积的水(假设没有挥发).下列叙述中正确的是( )
A.溶液中减小
B.电离程度减小
C.溶液导电能力增强
D.中和此溶液所需0.1mol/L NaOH溶液的体积减小
14.欲使某弱酸HX的电离程度增大、溶液中减小的措施有( )
A.加水稀释 B.加NaX
C.加热 D.加镁粉
15.下列物质加入到氢硫酸溶液中,会使溶液中硫离子浓度增大的是( )
A.溶液 B.氨气
C.稀 D.
16.的A、B两种酸溶液各1mL,分别加水稀释至1000mL,其与溶液体积的关系如图所示,下列说法中正确的是( )
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸的电离度比B酸的电离度增大得多
C.若,则A是强酸,B是弱酸
D.若A、B都是弱酸,则
17.某温度下,在醋酸溶液中存在着如下平衡:
当向溶液中加水稀释时,醋酸的电离程度都增大,试用电离常数的有关知识来解释这一改变.
18.在稀氨水中有如下平衡:,试分析当外界条件改变时,稀氨水的电离平衡和电离程度的影响.
(1)加入少量NaOH溶液,平衡向______________(填“正”、“逆”,下同)方向移动,电离程度__________(填“增大”、“减小”,下同);
(2)加少量,平衡向___________方向移动,电离程度________;
(3)加适量水,平衡向________方向移动,电离程度______________;
(4)降温,平衡向____________方向移动,电离程度__________.
19.(1)体积为20mL,溶液浓度为0.50mol/L的盐酸和醋酸溶液,跟足量Mg反应时,反应速率大的是________(填“前者”、“后者”),产生的体积同为________mL;与NaOH溶液发生中和反应时,耗用NaOH溶液体积_______(填“相同”、“不同”).
(2)体积为10mL,浓度同为0.50mol/L的盐酸和醋酸溶液,跟足量Mg反应时,反应速率大的是______(填“前者”、“后者”),产生的体积_______(填“相同”、“不同”);与NaOH溶液发生中和反应时,耗用NaOH溶液体积______(填“相同”、“不同”).
20.在饱和食盐水中通入氯化氢,可以看到______的现象,这是因为_________.
参考答案
【同步达纲练习】
1.C(点拨:电离是电解质在水分子的作用下离解成自由移动的离子的过程,不需要通电)
2.A(点拨:是中强酸,酸性比碳酸等强,但它在水溶液中仍然存在电离平衡,仍然只能发生部分电离,故属于弱电解质)
3.D(点拨:固态氯化钾中的离子不能自由移动,所以氯化钾在固态时不能导电)
4.C(点拨:极稀的强电解质溶液中离子浓度有可能比较浓的弱电解质溶液中离子浓度小,所以导电性也可能弱)
5.A(点拨:稀溶液中应全部电离生成,在熔融状态下就电离生成、)
6.AD(点拨:弱电解质在水溶液中只能部分电离,故其溶液中离子浓度总是比溶液浓度小,导电性也比同浓度的强酸溶液弱)
7.AC(点拨:自来水中所含的是极少量的,反应后绝大部分KOH剩余.KOH是强电解质,所以溶液离子浓度大大提高)
8.D(点拨:B中电离后应生成和)
9.B(点拨:只有是弱酸,在水溶液中才存在电离平衡)
10.B(点拨:D选项未明确指出两种溶液的体积,所以离子数目的多少不能确定)
11.C(点拨:具有强极性键的化合物一般是强电解质,但也有例外,如HF就是弱酸,属于弱电解质)
12.D(点拨:是中强酸,HCOOH,的酸性都有比碳酸强)
13.BC(点拨:浓缩后,醋酸的电离程度减小,但溶液体积减小更多,故离子浓度增大)
14.AD(点拨:加入NaX会抑制HX的电离)
15.B(点拨:A中可与反应生成CuS沉淀)
16.CD(点拨:将强酸稀释n倍,其将减小为原来的1/n;而将弱酸稀释n倍,由于稀释促进了电离,其将大于为原来的1/n)
17.该温度下,醋酸在溶液中电离达到平衡时,溶液中各离子的浓度之间存在如下关系:
,当加水将溶液体积稀释到原来的n倍时,、均减小,但由于醋酸的电离常数K不变,所以应大于原来的1/n,而应小于原来的1/n.故发生电离的醋酸分子更多了,即醋酸的电离程度增大.
18.(1)逆,减小;(2)逆,减小;(3)正,增大;(4)逆,减小
(点拨:加少量NaOH溶液,溶液中增大,稀氨水的电离平衡向逆方向移动,氨水的电离程度减小.加入少量,溶液中增大,稀氨水的电离平衡向逆方向移动,氨水的电离程度减小.加入适量水,氨水的浓度变小,溶液中和离子互相碰撞而结合成分子的机会减小,电离程度增大,平衡向正方向移动.因为氨水的电离过程是吸热过程,所以降温后平衡向逆方向移动)
19.(1)前者 112 相同
(2)后者 不同 不同
20.有白色食盐晶体析出;通入HCl,,增大而使溶解平衡向生成NaCl固体的方向移动
