化学能与热能(第1、2课时)[下学期]
文档属性
| 名称 | 化学能与热能(第1、2课时)[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 46.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-23 15:25:00 | ||
图片预览







文档简介
课件28张PPT。1 化学能与热能☆生活中哪些事实说明了在化学 反应中伴随着能量的变化?☆能量是什么?有哪些形式的能量?思考:一、化学能与热能的相互转化 爱因斯坦的质能方程E=mc2中,E表示的是物质的总能量,包括物质对外表现出的的动能和势能之和,再加上物质静止质量对应的能量。物质在静止时的能量E也不等于零 。一、化学能与热能的相互转化能量守恒定律:自然界一切物质都具有能量,能量有各种不同形式,能够从一种形式转化为另一种形式,从一个物体传递给另一个物体,而在转化和传递中能量的总数量不变。 化学能可以转化为热能,或借助一定的装置转化为电能。化学物质中的化学能转化为其他形式的能量,是人类生存和发展的动力之源。
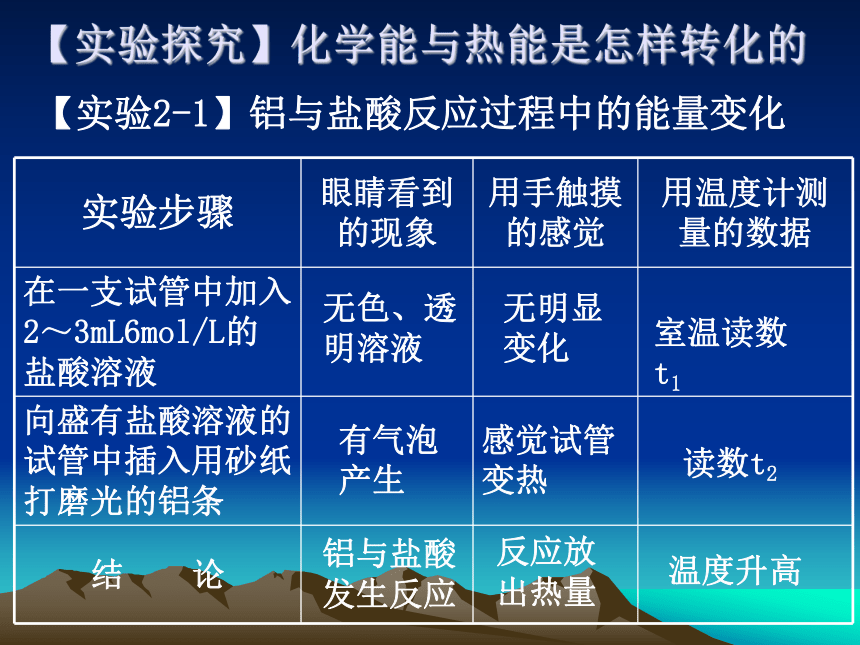
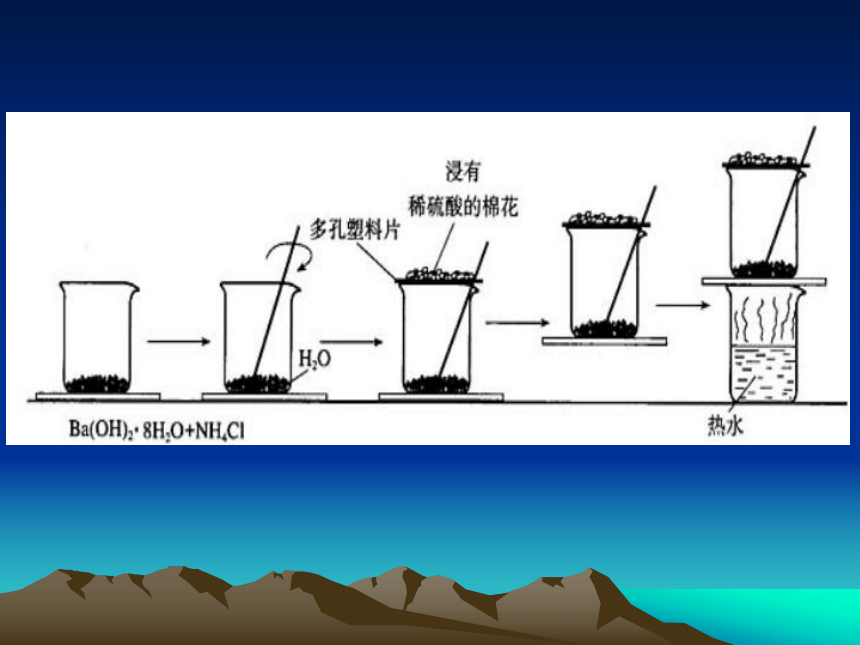
一、化学能与热能的相互转化【实验探究】化学能与热能是怎样转化的【实验2-1】铝与盐酸反应过程中的能量变化无色、透明溶液无明显变化有气泡产生感觉试管变热读数t2铝与盐酸发生反应反应放出热量温度升高室温读数t1反应过程中放出热量的反应。2Al+6HCl=2AlCl3+3H2↑ 说明金属与酸反应放出热量。 结论: 在一个小烧杯里,加入约20 g 已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有1~2滴水的玻璃片上。然后再加入约10 g NH4Cl晶体,并立即用玻璃棒迅速搅拌,使二者充分反应。【实验2-2】常温下氢氧化钡晶体与氯化铵晶体
反应过程中能量的变化 有刺激性气味的气体产
生,该气体能使湿润的
红色石蕊试纸变蓝有NH3气生成感觉烧杯变凉反应吸热 玻璃片粘到了烧杯底部体系温度降低,使水结成冰 玻璃片脱离上面烧杯底部 冰融化 混合物成糊状 有水生成 Ba(OH)2· 8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O 结论:反应过程中吸收能量的反应。【实验2-3】酸碱中和反应过程中能量的变化 HNO3与NaOH发生中和反应时放热 HCl与NaOH发生中和反应时放热 HCl与KOH发生中和反应时放热 酸与碱发生中和反应时放出热量? 室温室温室温t1t2t3【讨论】为什么强酸与强碱发生反应时都 会放出热量?【本质分析】
三个反应的化学方程式和离子方程式分别为:
HNO3+NaOH=NaNO3+H2O,H+ + OH- = H2O
HCl+NaOH=NaCl+H2O,H+ + OH- = H2O
HCl+KOH=KCl+H2O,H+ + OH- = H2O
三个反应的本质相同,都是 H+ + OH- = H2O
所以,可推测:中和反应都放热。中和热: 酸与碱发生中和反应生成1molH2O时所释放的热量。 化学反应中的能量(化学能)变化,通常表现为热量的变化。吸热反应放热反应化学上把有热量放出的化学反应叫做放热反应。化学上把吸收热量的化学反应叫做吸热反应。一、化学能与热能的相互转化 思考:为什么有的化学反应会放出热量,而有的化学反应却需要吸收热量?1.化学反应的特点是:
a.有新物质生成(新化学键的生成);
b.新物质和反应物的能量存在差异;
2.化学反应中能量守恒;
化学反应的过程可看作是能量的“释放”与“贮存”过程反应物的总能量=生成物的总能量 + 放出的热量生成物的总能量=反应物的总能量 + 吸收的热量二、化学键与化学反应中能量变化的关系 分子或化合物里的原子之间通过化学键结合。化学反应的过程是原子重新组合的过程。在反应中,反应物中的化学键断裂,原子之间形成新的化学键,从而生成新的物质。形成化学键时要放出能量,化学键断裂则需要吸收能量。 在相同状态下,同一种化学键形成时所放出的能量与断裂时所吸收的能量相等。例如:1mol H2中含有1mol H—H键。在25℃和101k Pa的条件下,由2mol H原子结合形成1mol H2时,形成1mol H—H键,放出436kJ的能量;而1molH2变成2mol H原子时,要断开1mol H—H键,吸收436kJ的能量。 二、化学键与化学反应中能量变化的关系 化学键的断裂和形成是化学反应中的能量变化的主要原因。H2+Cl2=2HClH2=H—H 436kJ/molCl2=Cl—Cl 242kJ/molHCl=H—Cl 431kJ/mol+热量如:放热◇物质所含的能量越低,该物质就越稳定。◇拆开1mol某种键所需要吸收的能量,叫做键能。◇物质所具有的能量越低,其分子越稳定,化学键断裂时,吸收的能量越多;该分子的化学键形成时,放出的能量越多。物质具有能量越高,其分子越不稳定,化学键断裂时,吸收的能量越小;该分子的化学键形成时,放出的能量越小。三、相变简介水的三态变化
固态(固相,s)
液态(液相,l)
气态(气相,g)
Q+H2O(l)=H2O(g) 液态水 气态水吸收QE2E1H2O(l)=H2O(g) –Q(kJ/mol)例一 :氢气燃烧可以放出大量的热,为什么常温下氢气可以和氧气共存?答:H2中H原子之间和O2中O原子之间有化学键,需要吸收足够能量才会断裂,所以常温下氢气和氧气可以共存。要使氢气开始在氧气中燃烧,需要先点燃,而氢气开始燃烧后产生的热则可以足够使更多的氢分子和氧分子中的化学键断裂,使反应持续下去。例二 近年来,科学家正在探索利用铝粉做燃料的可能性,以期铝能成为一种石油的取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的( )
A、 铝质轻,便于运输、贮存,且安全
B、 铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效控制
C、 在地球上,铝矿资源丰富
D、现代电冶铝的工业技术已为铝作为新能源奠定了重要基础D1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。2、化学键的断裂和形成是化学反应中能量变化的主要原因。3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。4、化学反应中遵循能量守衡原则。小结:
一、化学能与热能的相互转化【实验探究】化学能与热能是怎样转化的【实验2-1】铝与盐酸反应过程中的能量变化无色、透明溶液无明显变化有气泡产生感觉试管变热读数t2铝与盐酸发生反应反应放出热量温度升高室温读数t1反应过程中放出热量的反应。2Al+6HCl=2AlCl3+3H2↑ 说明金属与酸反应放出热量。 结论: 在一个小烧杯里,加入约20 g 已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有1~2滴水的玻璃片上。然后再加入约10 g NH4Cl晶体,并立即用玻璃棒迅速搅拌,使二者充分反应。【实验2-2】常温下氢氧化钡晶体与氯化铵晶体
反应过程中能量的变化 有刺激性气味的气体产
生,该气体能使湿润的
红色石蕊试纸变蓝有NH3气生成感觉烧杯变凉反应吸热 玻璃片粘到了烧杯底部体系温度降低,使水结成冰 玻璃片脱离上面烧杯底部 冰融化 混合物成糊状 有水生成 Ba(OH)2· 8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O 结论:反应过程中吸收能量的反应。【实验2-3】酸碱中和反应过程中能量的变化 HNO3与NaOH发生中和反应时放热 HCl与NaOH发生中和反应时放热 HCl与KOH发生中和反应时放热 酸与碱发生中和反应时放出热量? 室温室温室温t1t2t3【讨论】为什么强酸与强碱发生反应时都 会放出热量?【本质分析】
三个反应的化学方程式和离子方程式分别为:
HNO3+NaOH=NaNO3+H2O,H+ + OH- = H2O
HCl+NaOH=NaCl+H2O,H+ + OH- = H2O
HCl+KOH=KCl+H2O,H+ + OH- = H2O
三个反应的本质相同,都是 H+ + OH- = H2O
所以,可推测:中和反应都放热。中和热: 酸与碱发生中和反应生成1molH2O时所释放的热量。 化学反应中的能量(化学能)变化,通常表现为热量的变化。吸热反应放热反应化学上把有热量放出的化学反应叫做放热反应。化学上把吸收热量的化学反应叫做吸热反应。一、化学能与热能的相互转化 思考:为什么有的化学反应会放出热量,而有的化学反应却需要吸收热量?1.化学反应的特点是:
a.有新物质生成(新化学键的生成);
b.新物质和反应物的能量存在差异;
2.化学反应中能量守恒;
化学反应的过程可看作是能量的“释放”与“贮存”过程反应物的总能量=生成物的总能量 + 放出的热量生成物的总能量=反应物的总能量 + 吸收的热量二、化学键与化学反应中能量变化的关系 分子或化合物里的原子之间通过化学键结合。化学反应的过程是原子重新组合的过程。在反应中,反应物中的化学键断裂,原子之间形成新的化学键,从而生成新的物质。形成化学键时要放出能量,化学键断裂则需要吸收能量。 在相同状态下,同一种化学键形成时所放出的能量与断裂时所吸收的能量相等。例如:1mol H2中含有1mol H—H键。在25℃和101k Pa的条件下,由2mol H原子结合形成1mol H2时,形成1mol H—H键,放出436kJ的能量;而1molH2变成2mol H原子时,要断开1mol H—H键,吸收436kJ的能量。 二、化学键与化学反应中能量变化的关系 化学键的断裂和形成是化学反应中的能量变化的主要原因。H2+Cl2=2HClH2=H—H 436kJ/molCl2=Cl—Cl 242kJ/molHCl=H—Cl 431kJ/mol+热量如:放热◇物质所含的能量越低,该物质就越稳定。◇拆开1mol某种键所需要吸收的能量,叫做键能。◇物质所具有的能量越低,其分子越稳定,化学键断裂时,吸收的能量越多;该分子的化学键形成时,放出的能量越多。物质具有能量越高,其分子越不稳定,化学键断裂时,吸收的能量越小;该分子的化学键形成时,放出的能量越小。三、相变简介水的三态变化
固态(固相,s)
液态(液相,l)
气态(气相,g)
Q+H2O(l)=H2O(g) 液态水 气态水吸收QE2E1H2O(l)=H2O(g) –Q(kJ/mol)例一 :氢气燃烧可以放出大量的热,为什么常温下氢气可以和氧气共存?答:H2中H原子之间和O2中O原子之间有化学键,需要吸收足够能量才会断裂,所以常温下氢气和氧气可以共存。要使氢气开始在氧气中燃烧,需要先点燃,而氢气开始燃烧后产生的热则可以足够使更多的氢分子和氧分子中的化学键断裂,使反应持续下去。例二 近年来,科学家正在探索利用铝粉做燃料的可能性,以期铝能成为一种石油的取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的( )
A、 铝质轻,便于运输、贮存,且安全
B、 铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效控制
C、 在地球上,铝矿资源丰富
D、现代电冶铝的工业技术已为铝作为新能源奠定了重要基础D1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。2、化学键的断裂和形成是化学反应中能量变化的主要原因。3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。4、化学反应中遵循能量守衡原则。小结:
