化学能与热能[下学期]
图片预览






文档简介
课件18张PPT。第一节 化学能与热能江苏省黄中分校高一化学组赵学军阅读课本28—30页,主要注意以下问题。一个化学反应除了遵循质量守恒定律,还遵循哪些规律?
分析反应物和生成物的能量相对大小与放热反 应、吸热反应的关系。
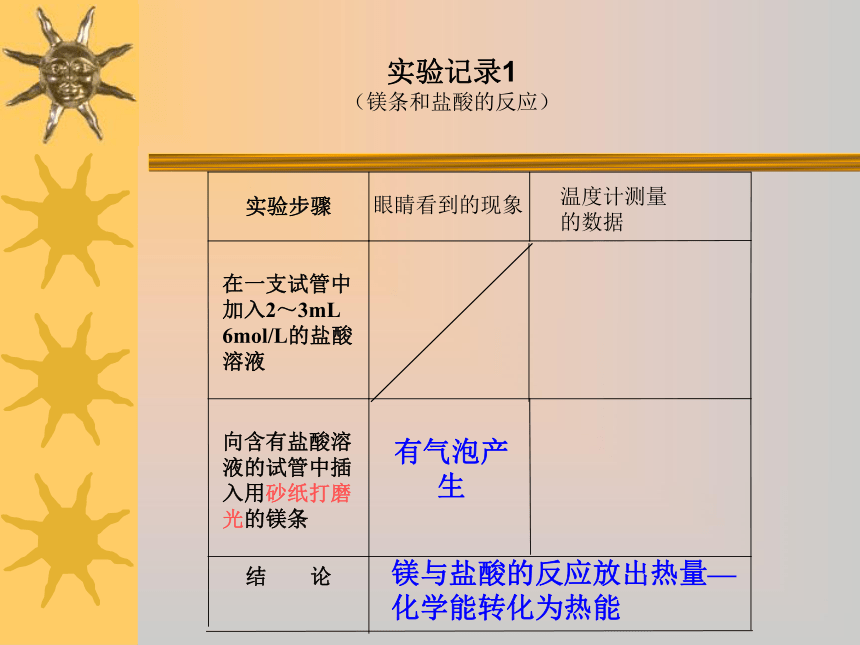
掌握化学键的断裂、形成与能量之间的关系,从而明确化学反应中能量变化的主要原因。在化学反应中不仅有新物质的生成,同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。这一现象说明了什么? 生活中哪些事实说明了在化学反应中伴随着能量的变化?那么是不是所有的化学反应都有热量放出来吗? 下面我们通过几个实验来感受一下化学能与热能的相互转化!思考实验记录1
(镁条和盐酸的反应)有气泡产生镁与盐酸的反应放出热量—化学能转化为热能反应吸收热量,使水结成冰玻璃片黏在烧杯上用手拿起烧杯该反应吸收热量——热能转化为化学能结论有冷的感觉用手触摸烧杯下部有氨气生成有刺激性气味气体产生将20gBa(OH)2?8H2O晶体研细后与10gNH4C l在烧杯中混合,并将烧杯放在滴有几滴水的玻璃片上,立即用玻璃棒快速搅拌混合物得出结论实验现象实验步骤(氢氧化钡晶体和氯化铵晶体的反应)实验记录2根据实验回答下列问题1.该实验的反应原理是: Ba(OH)2 · 8H2O+2NH4Cl==BaCl2+ NH3· H2O + 8 H2O2.实验中玻璃棒的作用是:
___________________________混合反应物,增大接触面积,加快反应速度.结论:化学能可以与热能相互转化,有的化学反应会放出能量,有的化学反应吸收能量。化学上把有热量放出的化学反应叫做放热反应 吸收热量的化学反应叫做吸热反应常见的放热反应:
(1)所有燃烧反应
(2)活泼金属跟水或酸反应
(3)中和反应
(4)大多数化合反应 常见的吸热反应:例题1为什么有的反应放热,有的反应吸热?
能量怎么变化?多了还是少了?思考所以,一个化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。在化学反应中遵循质量守恒,同时也遵循能量守恒
即能量既不会增加也不会减少,只会从一种形式转化为另一种形式。例题2放热反应吸热反应若E反>E生,则反应放热,则为放热反应若E反<E生,则反应吸热,则为吸热反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量所以说化学键的断裂和形成是化学反应中能量变化的主要原因。另外,从微观结构看,化学反应的实质是旧化学键的断裂和新化学键的形成过程。在反应过程中,断开旧化学键需要吸收一定的能量才能克服相邻原子之间的强烈相互作用;而形成新化学键时则要释放一定的能量。
当成键放出的能量大于断键吸收的能量时,反应表现为放出能量;反之,吸收能量。1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。4、化学键的断裂和形成是化学反应中能量变化的主要原因。3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。2、化学反应中遵循能量守衡原则。小结例题1下列属于放热反应的是: ( )
A. Al+稀盐酸
B. Ba(OH)2 · 8H2O+2NH4Cl
C. KClO3受热分解
D. CaO+H2OAD例题2下列说法正确的是 ( )
A. 需要加热方能发生的反应一定是吸热反应
B.放热的反应在常温下一定很容易发生
C.放热反应还是吸热反应主要由反应物与生成物所具有的总能量的相对大小决定
D. 吸热反应发生过程中要不断从外界获得能量,放热反应自始至终不需要外界能量
C
分析反应物和生成物的能量相对大小与放热反 应、吸热反应的关系。
掌握化学键的断裂、形成与能量之间的关系,从而明确化学反应中能量变化的主要原因。在化学反应中不仅有新物质的生成,同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。这一现象说明了什么? 生活中哪些事实说明了在化学反应中伴随着能量的变化?那么是不是所有的化学反应都有热量放出来吗? 下面我们通过几个实验来感受一下化学能与热能的相互转化!思考实验记录1
(镁条和盐酸的反应)有气泡产生镁与盐酸的反应放出热量—化学能转化为热能反应吸收热量,使水结成冰玻璃片黏在烧杯上用手拿起烧杯该反应吸收热量——热能转化为化学能结论有冷的感觉用手触摸烧杯下部有氨气生成有刺激性气味气体产生将20gBa(OH)2?8H2O晶体研细后与10gNH4C l在烧杯中混合,并将烧杯放在滴有几滴水的玻璃片上,立即用玻璃棒快速搅拌混合物得出结论实验现象实验步骤(氢氧化钡晶体和氯化铵晶体的反应)实验记录2根据实验回答下列问题1.该实验的反应原理是: Ba(OH)2 · 8H2O+2NH4Cl==BaCl2+ NH3· H2O + 8 H2O2.实验中玻璃棒的作用是:
___________________________混合反应物,增大接触面积,加快反应速度.结论:化学能可以与热能相互转化,有的化学反应会放出能量,有的化学反应吸收能量。化学上把有热量放出的化学反应叫做放热反应 吸收热量的化学反应叫做吸热反应常见的放热反应:
(1)所有燃烧反应
(2)活泼金属跟水或酸反应
(3)中和反应
(4)大多数化合反应 常见的吸热反应:例题1为什么有的反应放热,有的反应吸热?
能量怎么变化?多了还是少了?思考所以,一个化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。在化学反应中遵循质量守恒,同时也遵循能量守恒
即能量既不会增加也不会减少,只会从一种形式转化为另一种形式。例题2放热反应吸热反应若E反>E生,则反应放热,则为放热反应若E反<E生,则反应吸热,则为吸热反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量所以说化学键的断裂和形成是化学反应中能量变化的主要原因。另外,从微观结构看,化学反应的实质是旧化学键的断裂和新化学键的形成过程。在反应过程中,断开旧化学键需要吸收一定的能量才能克服相邻原子之间的强烈相互作用;而形成新化学键时则要释放一定的能量。
当成键放出的能量大于断键吸收的能量时,反应表现为放出能量;反之,吸收能量。1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。4、化学键的断裂和形成是化学反应中能量变化的主要原因。3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。2、化学反应中遵循能量守衡原则。小结例题1下列属于放热反应的是: ( )
A. Al+稀盐酸
B. Ba(OH)2 · 8H2O+2NH4Cl
C. KClO3受热分解
D. CaO+H2OAD例题2下列说法正确的是 ( )
A. 需要加热方能发生的反应一定是吸热反应
B.放热的反应在常温下一定很容易发生
C.放热反应还是吸热反应主要由反应物与生成物所具有的总能量的相对大小决定
D. 吸热反应发生过程中要不断从外界获得能量,放热反应自始至终不需要外界能量
C
