水的电离和溶液的PH[上学期]
文档属性
| 名称 | 水的电离和溶液的PH[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 816.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-12-04 00:00:00 | ||
图片预览





文档简介
课件19张PPT。第二节水的电离和溶液的PH考点要求 1.水的电离和水的离子积
2.影响水的电离平衡的因素
3.溶液的酸碱性
4.有关pH的简单计算 H2O H++OH- 或 2H2O = H3O+ + OH- 1.水是极弱的电解质一.水的电离2.水的离子积常数KW =C(H+)·C(OH-)
(1)KW只与温度有关
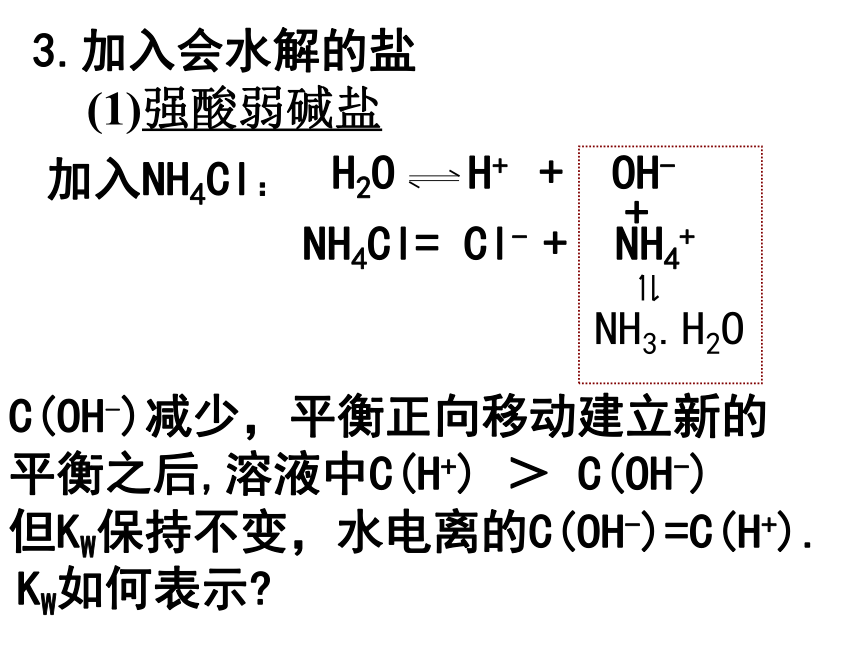
常温(25℃时):KW =1× 10-14(2)Kw不仅适用于纯水,还适用于酸、碱、盐的稀溶液.二.影响水的电离平衡的因素1.加入酸(强、弱)H2O H+ + OH- (正反应吸热)c(H+)____,c(OH-)____,水的电离平衡向____移动,水的电离程度变____,____水的电离。2.加入碱(强、弱)增大减小逆向小抑制减小增大此时溶液中的KW如何变化?如何表示?加入NH4Cl:+NH3.H2O但KW保持不变,水电离的C(OH-)=C(H+).
KW如何表示?(1)强酸弱碱盐C(OH-)减少,平衡正向移动建立新的
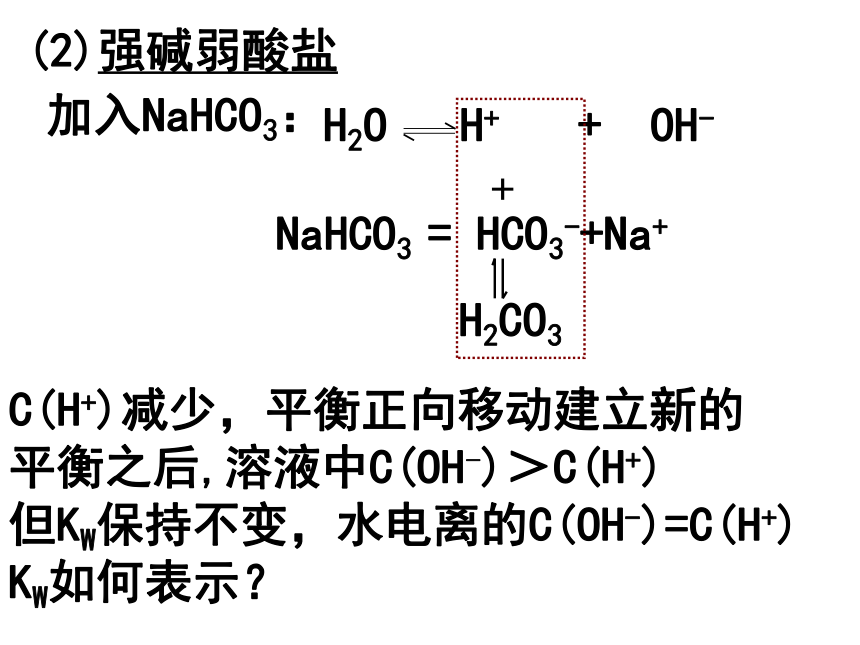
平衡之后,溶液中C(H+) > C(OH-)3.加入会水解的盐加入NaHCO3:NaHCO3 = HCO3-+Na+ C(H+)减少,平衡正向移动建立新的
平衡之后,溶液中C(OH-)>C(H+)但KW保持不变,水电离的C(OH-)=C(H+)
KW如何表示? (2)强碱弱酸盐加入NaCl:NaCl = Na+ + Cl-Na+和Cl-不与水电离生成的H+ 和 OH-反应 所以,强酸强碱盐不影响水的电离平衡。
C(OH-)和C(H+)不变,KW也不变。(3)强酸强碱盐(4)温度① 升温平衡向哪个方向移动?
② 水的电离程度如何变化?
③ c(H+)、c(OH-)如何变化?
④ Kw如何变化?
E.NH4Cl F. NaOH D.NaHSO4B.NaCl C. Na2CO3 A.HCl 1.常温下,某溶液中由水电离产生的C(H+)=10-6 mol/l,则此溶液有可能是( ).由水电离产生的C(H+)=10-9 mol/l,则此溶液有可能是( )ADFCE练习: 2.常温的某无色溶液中,由水的电离产生的C(H+)=1×10-12 mol/l,则下列各组离子肯定能共存的是( )
A.Cu2+ NO3- SO42- Fe3+
B.Cl- S2- Na+ K+
C.SO32- NH4+ K+ Mg2+
D.Cl- Na+ NO3- SO42-D3.常温时,在PH=8的CH3COONa和NaOH两种溶液中,设由水电离产生的 C(OH-)分别为Amol/l与Bmol/l,则A和B的关系为( )
A、A< B B、A=10-2B
C、B=10-2A D、A=BC A.前者大 B.后者大
C.相等 D.不能肯定 4.加热稀NaOH溶液(忽略溶液的蒸发),则NaOH溶液的PH加热前与加热后相比( )加热稀H2SO4溶液(忽略溶液的蒸发),则H2SO4溶液的PH加热前与加热后相比( )
AC知识归纳: 能水解的盐(可能是强酸弱碱盐或强碱弱酸盐等)1.常温时,某溶液中由水电离产生的C(H+) >1×10-7 mol/l 时,溶液是 能抑制水的电离的物质(可能是酸或碱或其他特殊的物质,如NaHSO4等)2.常温时,某溶液中由水电离产生C(H+)<1×10-7 mol/l 时,溶液是3.某溶液温度升高,若是强酸,PH若是强碱,PH不变减小二.溶液的酸碱性和pH计算1.溶液的酸碱性(略)2.溶液的PH计算:pH= -lg[H+]PH值的计算稀释混合同类异类强酸与强酸强碱与强碱 强酸和强碱的混合
(酸过量)强酸和强碱的混合
(碱过量)强酸、弱酸有限稀释 强碱、弱碱有限稀释酸、碱无限稀释一、强酸与强酸、强碱与强碱的混合例1:将PH=1和PH=4的盐酸等体积混合,求混合后溶液的PH值。
例2:将PH=11的氢氧化钠溶液和PH=13的Ba(OH)2溶液等体积相混合,求混合后溶液的PH值。 解题关键:把各自溶液中占主导地位的H+或OH-的物质的量相加除以混合后总体积,可得混合溶液的[H+]或[OH-],即可求出PH值。 二、强酸和强碱的混合 例3、60mL0.5mol/LNaOH溶液和40mL0.3mol/LH2SO4溶液相混合(混合前后溶液体积差忽略不计),所得溶液的pH约为( )解题关键:
据H+ +OH-=H2O,求出混合后剩余的[H+]或[OH-],再换算出PH值溶液的主体
(主导因素)4. 0.01mol/L的盐酸溶液稀释1000倍,稀释后溶液的pH值为( )
5. 0.01mol/L的醋酸溶液稀释1000倍,稀释后溶液的pH值的范围( ) 强酸PH=a,加水稀释10n倍,则稀释后PH=a+n;
弱酸PH=a,稀释10n倍,则稀释后a < PH7.将pH=12的氨水稀释1000倍,则稀释后溶液的pH值的范围( )2.强碱PH=b,加水稀释10n倍,则稀释后PH=b-n;弱碱PH=b,加水稀释10n倍,则稀释后:b -n < PH9.当PH=11的氢氧化钠溶液稀释105倍时,计算稀释后溶液的PH值。 解答关键:
⑴抓住溶液的主体——主导因素
⑵引起溶液的酸碱性发生“改变”时,需考虑水的电离
2.影响水的电离平衡的因素
3.溶液的酸碱性
4.有关pH的简单计算 H2O H++OH- 或 2H2O = H3O+ + OH- 1.水是极弱的电解质一.水的电离2.水的离子积常数KW =C(H+)·C(OH-)
(1)KW只与温度有关
常温(25℃时):KW =1× 10-14(2)Kw不仅适用于纯水,还适用于酸、碱、盐的稀溶液.二.影响水的电离平衡的因素1.加入酸(强、弱)H2O H+ + OH- (正反应吸热)c(H+)____,c(OH-)____,水的电离平衡向____移动,水的电离程度变____,____水的电离。2.加入碱(强、弱)增大减小逆向小抑制减小增大此时溶液中的KW如何变化?如何表示?加入NH4Cl:+NH3.H2O但KW保持不变,水电离的C(OH-)=C(H+).
KW如何表示?(1)强酸弱碱盐C(OH-)减少,平衡正向移动建立新的
平衡之后,溶液中C(H+) > C(OH-)3.加入会水解的盐加入NaHCO3:NaHCO3 = HCO3-+Na+ C(H+)减少,平衡正向移动建立新的
平衡之后,溶液中C(OH-)>C(H+)但KW保持不变,水电离的C(OH-)=C(H+)
KW如何表示? (2)强碱弱酸盐加入NaCl:NaCl = Na+ + Cl-Na+和Cl-不与水电离生成的H+ 和 OH-反应 所以,强酸强碱盐不影响水的电离平衡。
C(OH-)和C(H+)不变,KW也不变。(3)强酸强碱盐(4)温度① 升温平衡向哪个方向移动?
② 水的电离程度如何变化?
③ c(H+)、c(OH-)如何变化?
④ Kw如何变化?
E.NH4Cl F. NaOH D.NaHSO4B.NaCl C. Na2CO3 A.HCl 1.常温下,某溶液中由水电离产生的C(H+)=10-6 mol/l,则此溶液有可能是( ).由水电离产生的C(H+)=10-9 mol/l,则此溶液有可能是( )ADFCE练习: 2.常温的某无色溶液中,由水的电离产生的C(H+)=1×10-12 mol/l,则下列各组离子肯定能共存的是( )
A.Cu2+ NO3- SO42- Fe3+
B.Cl- S2- Na+ K+
C.SO32- NH4+ K+ Mg2+
D.Cl- Na+ NO3- SO42-D3.常温时,在PH=8的CH3COONa和NaOH两种溶液中,设由水电离产生的 C(OH-)分别为Amol/l与Bmol/l,则A和B的关系为( )
A、A< B B、A=10-2B
C、B=10-2A D、A=BC A.前者大 B.后者大
C.相等 D.不能肯定 4.加热稀NaOH溶液(忽略溶液的蒸发),则NaOH溶液的PH加热前与加热后相比( )加热稀H2SO4溶液(忽略溶液的蒸发),则H2SO4溶液的PH加热前与加热后相比( )
AC知识归纳: 能水解的盐(可能是强酸弱碱盐或强碱弱酸盐等)1.常温时,某溶液中由水电离产生的C(H+) >1×10-7 mol/l 时,溶液是 能抑制水的电离的物质(可能是酸或碱或其他特殊的物质,如NaHSO4等)2.常温时,某溶液中由水电离产生C(H+)<1×10-7 mol/l 时,溶液是3.某溶液温度升高,若是强酸,PH若是强碱,PH不变减小二.溶液的酸碱性和pH计算1.溶液的酸碱性(略)2.溶液的PH计算:pH= -lg[H+]PH值的计算稀释混合同类异类强酸与强酸强碱与强碱 强酸和强碱的混合
(酸过量)强酸和强碱的混合
(碱过量)强酸、弱酸有限稀释 强碱、弱碱有限稀释酸、碱无限稀释一、强酸与强酸、强碱与强碱的混合例1:将PH=1和PH=4的盐酸等体积混合,求混合后溶液的PH值。
例2:将PH=11的氢氧化钠溶液和PH=13的Ba(OH)2溶液等体积相混合,求混合后溶液的PH值。 解题关键:把各自溶液中占主导地位的H+或OH-的物质的量相加除以混合后总体积,可得混合溶液的[H+]或[OH-],即可求出PH值。 二、强酸和强碱的混合 例3、60mL0.5mol/LNaOH溶液和40mL0.3mol/LH2SO4溶液相混合(混合前后溶液体积差忽略不计),所得溶液的pH约为( )解题关键:
据H+ +OH-=H2O,求出混合后剩余的[H+]或[OH-],再换算出PH值溶液的主体
(主导因素)4. 0.01mol/L的盐酸溶液稀释1000倍,稀释后溶液的pH值为( )
5. 0.01mol/L的醋酸溶液稀释1000倍,稀释后溶液的pH值的范围( ) 强酸PH=a,加水稀释10n倍,则稀释后PH=a+n;
弱酸PH=a,稀释10n倍,则稀释后a < PH
⑴抓住溶液的主体——主导因素
⑵引起溶液的酸碱性发生“改变”时,需考虑水的电离
