盐类水解复习[下学期]
图片预览







文档简介
课件26张PPT。盐类水解的影响因素及利用高考要求:
1.掌握水的电离平衡;
2.巩固盐类水解的概念;
3.掌握影响盐类水解的因素及其利用;
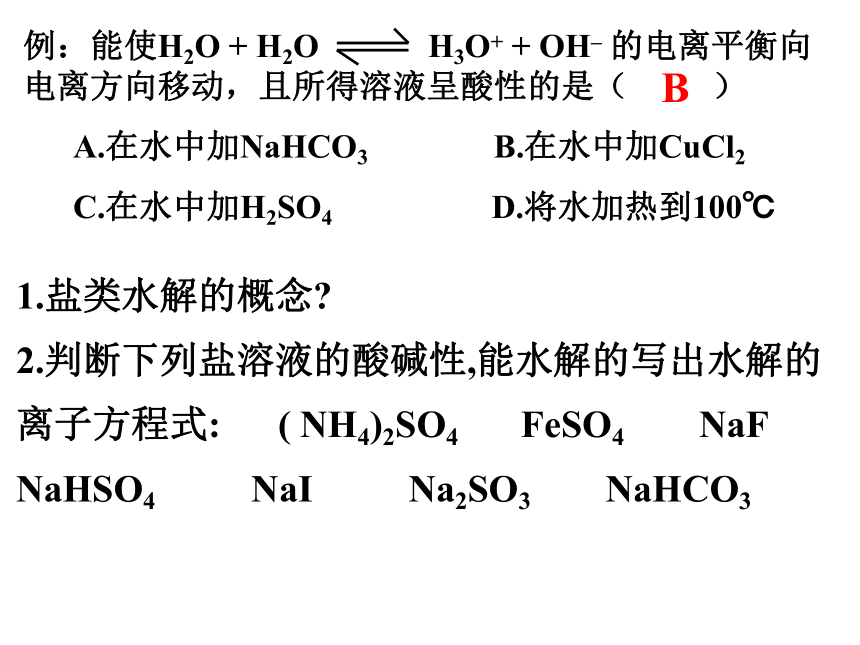
4.能判断溶液中溶液质各粒子的浓度关系B 1.盐类水解的概念?
2.判断下列盐溶液的酸碱性,能水解的写出水解的
离子方程式: ( NH4)2SO4 FeSO4 NaF
NaHSO4 NaI Na2SO3 NaHCO3水解的规律:
1.无弱不水解,有弱才水解;
2.谁弱谁水解,谁强显谁性;
3.越弱越水解,酸碱性越强.例:现有S2--、SO32--、NH4+、Al3+、HPO42--、Na+、SO42--、
AlO2--、Fe3+、HCO3--、Cl—等离子,请按要求填空:
(1)在水溶液中该离子水解呈碱性的是 ;
(2)在水溶液中该离子水解呈酸性的是 ;
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液中
大量存在的离子有 ;
(4)既不能在酸性较强的溶液里大量存在,又能在碱性较强的溶液中
大量存在的离子有 ;S2--、SO32--、 HPO42--、 AlO2--、 HCO3--NH4+、Al3+、 Fe3+Na+、SO42--、 Cl—HPO42--、 HCO3--水解离子方程式书写的注意事项: 1.用可逆符号:
2.多元弱酸根离子 水解.
3.对于沉淀气体符号( ﹑ ).分步-----不能标 盐类水解的影响因素内因:形成盐的弱酸弱碱的相对强弱:
①弱酸强碱盐:
②弱碱强酸盐:
形成盐的弱酸酸性越弱,其酸根离
子越易水解,溶液的碱性越强。越弱越水解。 形成盐的碱碱性越弱,其金属阳离
子越易水解,溶液的酸性越强。外因:符合勒夏特列原理① 温度:
② 浓度:
③酸碱盐的影响稀释促进水解升温促进水解讨论:
1.比较同浓度的下列各组溶液pH值的大小:
提示:变价阳离子,价态越高,越易水解
Na2CO3 ___ CH3COONa ;
B.AlCl3 ___MgCl2
C.NaHCO3 ___ Na2CO3 ;
D.FeCl2 ___FeCl3><<>2.填表:CH3COONa溶液改变下列条件,填写变化情况: CH3COO-+H2O CH3COOH+OH-
向右增大增大减小向右减小减小增大向右减小增大增大向右
减小减小增大向左向左增大增大增大减小减小减小向右
减小减小增大(一)工农业生产和日常生活中的应用: ①明矾能净水,Fe3+盐也能净水,试解释其原
理,写出水解的离子方程式.②热的纯碱溶液去污效果更好.温度高,水解程度大,[OH-]大.③过磷酸钙不宜与草木灰混合施用.K2CO3草木灰水解显碱性,使可溶的磷酸二氢钙[Ca(H2PO4)2]转化为难溶的磷酸一氢钙或磷酸钙.水解原理的应用 (二)溶液的配置和保存
①配置下列溶液应注意那些问题?
FeCl3
FeCl2
AgNO3
SnCl2 ( 加HCl )( 加HCl、 Fe )( 加HNO3 )( 加HCl、 Sn )②Na2CO3 Na2SiO3 Na3PO4等溶液的保存能否在磨口试剂瓶中?并说明原因?加入Fe是为了防止Fe2+氧化成Fe3+:
Fe + 2Fe3+ === 2Fe2+作用同铁(三)判断盐溶液的酸碱性
例.下列盐溶液因水解而显酸性的是( )
A.Na2S B.NaHCO3
C.Na2HPO4 D.NH4Cl(四)比较盐溶液pH值的大小
例.已知一元弱酸的电离程度为:HX>HY>HZ, 则可知它们钾盐的pH大小为 。(五)依据盐溶液PH的不同,判断相应酸(碱)的酸性(碱性)强弱
例.已知物质的量浓度相同的三种盐溶液:NaX,NaY,NaZ,它们的PH依次为:8,9,10,则可知对应酸的酸性强弱顺序为: 。KXHY>HZD(六)比较盐溶液中离子种类的多少
例.下列物质的溶液中所含离子种类最多的是( )
A.Na2S B.Na3PO4 C.Na2CO3 D.AlCl3(七)判断离子在同一溶液中能否大量共存
例.Al3+不能与AlO2-、HCO3-、CO32-等大量共存于同一溶液,这是因为Al3+水解显酸性, AlO2-、HCO3-、CO32-水解显碱性,相遇会发生双水解反应(八)依据盐溶液的pH,可求出溶液中水电离出的?H+?或?OH-?,反之亦然。
例.25℃时某KCN溶液的pH=12,则可知该溶液中水电离出的?OH-?=10-2mol/L。这是因为水解呈碱性的溶液中:?OH-?水=?OH-?碱。B(九)某些活泼金属(如 Mg,Al,Zn等)溶于盐溶液中产生氢气。
例.将镁条插入NH4Cl溶液中,会产生H2和NH3,这是因为NH4Cl水解:
NH4+ + H2O ≒NH3·H2O +H+
使溶液显酸性,镁可置换出氢:
Mg +2H+ =Mg2+ +H2?
同时促进NH4+水解,生成大量NH3·H2O,有部分NH3逸出。(十一)某些无水盐的制备
例.把AlCl3溶液蒸干后再灼烧,最后得到的固体产物主要是Al2O3而不是AlCl3。这是由于加热促进Al3+的水解,又使生成的HCl以气体形式逸散,而使Al3+水解完全生成Al(OH)3,Al(OH)3受热分解生成Al2O3。(十)明矾、FeCl3都是净水剂,这与Al3+、Fe3+水解生成具有强吸附作用的胶体有关。(十二)判断物质的成分
例.水垢的主要成分是CaCO3和Mg(OH)2,基本上不含MgCO3,这是因为MgCO3微溶于水,长时间加热,水解生成了更难溶的Mg(OH)2。(十三)选用试剂鉴别物质
例.现有Al2(SO4)3,HAc,NaCl,BaCl2四种溶液,可以将它们区别开的一种试剂是( )
A.H2SO4 B.AgNO3 C.Na2CO3 D.NaHCO3(十四)除杂或离子分离对试剂的选择
例18.已知pH=5的MgCl2溶液中含有杂质FeCl3,为除去杂质可加入的试剂是( )
A.MgO B.MgCO3 C.NaOH D.NaHCO3(十六)中和滴定中确定终点时对指示剂的选择(十五)制备某些胶体CA练习:
1.浓度均为0.1mol/L的①NaHCO3 ②Na2CO3 ③NaCl
④NaHSO4四种溶液,按pH由小到大的顺序是 ( )
A. ①②③④ B. ④③②①
C. ④③①② D. ②①④③ C2、将10mL0.1mol/L氨水和10mL0.1mol/L盐酸混合后,
溶液里各种离子物质的量浓度的关系是 ( )
A.[Cl--]+[OH--]=[NH4+]+[H+]
B. [Cl--]> [NH4+]> [H+] > [OH-]
C. [H+] > [OH--]> [Cl--]> [NH4+]
D. [Cl--]> [H+] > [NH4+]> [OH-]AB3.下面提到的与盐的水解无关的正确说法是:( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,溶液时往往在FeCl3溶液中加
入少量的盐酸
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与氨态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性
A. ① ③ ⑥ B. ② ③ ⑤ C. ③ ④ ⑤ D.全有关D4.下列各组离子在溶液中能否大量共存? 说明原因.
1. H+ CH3COO- K+ Cl-
2. S2- Al3+ Cl- Na+
3. CO32- NO3- H+ K+
4. Cl- Ca2+ NO3- CO32-
5. Fe2+ H+ Cl- NO3-弱电解质双水解气体沉淀氧化还原(十七)溶液中离子浓度关系 电解质溶液中守恒关系:
电荷守恒. 物料守恒. 质子守恒. 定组成关系守恒.以0.1mol/LNa2S溶液为例:
溶液中多量离子:
微量离子:Na+、 S2-OH- 、H+ 、 HS-1.由于整个溶液不显电性:n∑Min+=m∑Mim-
电荷守恒关系:[Na+]+[H+]=[OH-]+[HS-]+2[S2-]2.考虑硫元素水解前后守恒:
物料守恒关系:[S2-] +[HS-]+[H2S]=0.1mol/L3.考虑钠元素与硫元素形成Na2S的定组成关系:
定组成守恒关系:1/2[Na+]=[S2-]+[HS-]+[H2S]4.考虑盐类水解或电离时由水本身电离出的
[H+]=[OH-]
质子守恒:[OH-]= [H+] +[HS-] +2[H2S]5.水解或电离程度不同,使离子间形成的大小关系不同[Na+] >[S2-]> [OH-]> [HS-]> [H+] 讨论: 1.(1)NH4Cl溶液中存在的平衡有
微粒种类有:
这些微粒种类之间存在的等式关系有
各离子浓度由大到小的
NH4++H2O NH3.H2O+H+
H2O H++OH-分子: NH3.H2O 、H2O
离子: NH4+、OH-、 H+、Cl-
[Cl-]>[NH4+] >[H+]>[ OH-]
电荷: [NH4+] +[H+] =[Cl-] +[ OH-]
物料: [Cl-]= [NH4+]+[NH3.H2O]
2.在硫化钠溶液中存在多种离子和分子,下列关系正确的是( )
A.[Na+]>[S2-]>[OH-]>[HS-]
B.[OH-]=2[HS-]+[H+]+[H2S]
C. [OH-] =[HS-] +[H+] +[H2S]
D. D.[Na+]+[H+]= [OH-] +[HS-] +[S2-]A3.向0.1mol/LNaOH溶液中逐渐加入0.1mol/LCH3COOH
溶液,至溶液中[Na+]=[CH3COO-]。此时溶液的pH值是( )
A .pH=7 B. pH>7 C. pH<7 D.无法确定
4.表示0.1mol/LNaHCO3溶液中有关微粒的关系式,正确的是( )
A.[Na+]>[HCO3-]>[CO32-]>[ H+]>[OH-]
B. [Na+] +[ H+] =[HCO3-]+ [CO32-] +[OH-]
C. [Na+] +[ H+] =[HCO3-]+ 2[CO32-] +[OH-]
D. [Na+] = [HCO3-] + [CO32-] +[H2CO3]
ACD 5. 将pH=3的盐酸和Ph=11的氨水等体积混合后,溶液中离子浓度大小关系是______________________[NH4+]>[Cl-]>[OH-]>[H+]6.0.1mol/LNaOH和0.2mol/LCH3COOH等体积混合后溶
液中各离子浓度由大到小的顺序是
。[CH3COO- ]>[Na+]>[ H+]>[OH-]7.为了使Na2S溶液中[Na+] /[S2-]接近于2.1,可加入的物质是( )
A.盐酸 B.适量的NaOH
C.适量的KOH D.适量的NaHS溶液
C8.0.1mol/L的下列各溶液,其中浓度由小到大的顺序是
①(NH4)2SO4 ② NH4HSO4 ③CH3COONH4
④NH4HCO3 ⑤NH4Cl ⑥ (NH4)2CO3 ④ <③< ⑤< ②<⑥< ①9.物质的量浓度相同的下列物质,其离子浓度的比较中错误 的是( )
A.[PO43-]: Na3PO4>Na2HPO4>NaH2PO4>H3PO4
B.[CO32-]: (NH4)2CO3>Na2CO3>NaHCO3>NH4HCO3
C.[NH4+]: (NH4)2SO4> (NH4)2CO3>NH4HSO4>NH4Cl
D. [S2-]: Na2S>H2S>NaHS>(NH4)2SBD
1.掌握水的电离平衡;
2.巩固盐类水解的概念;
3.掌握影响盐类水解的因素及其利用;
4.能判断溶液中溶液质各粒子的浓度关系B 1.盐类水解的概念?
2.判断下列盐溶液的酸碱性,能水解的写出水解的
离子方程式: ( NH4)2SO4 FeSO4 NaF
NaHSO4 NaI Na2SO3 NaHCO3水解的规律:
1.无弱不水解,有弱才水解;
2.谁弱谁水解,谁强显谁性;
3.越弱越水解,酸碱性越强.例:现有S2--、SO32--、NH4+、Al3+、HPO42--、Na+、SO42--、
AlO2--、Fe3+、HCO3--、Cl—等离子,请按要求填空:
(1)在水溶液中该离子水解呈碱性的是 ;
(2)在水溶液中该离子水解呈酸性的是 ;
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液中
大量存在的离子有 ;
(4)既不能在酸性较强的溶液里大量存在,又能在碱性较强的溶液中
大量存在的离子有 ;S2--、SO32--、 HPO42--、 AlO2--、 HCO3--NH4+、Al3+、 Fe3+Na+、SO42--、 Cl—HPO42--、 HCO3--水解离子方程式书写的注意事项: 1.用可逆符号:
2.多元弱酸根离子 水解.
3.对于沉淀气体符号( ﹑ ).分步-----不能标 盐类水解的影响因素内因:形成盐的弱酸弱碱的相对强弱:
①弱酸强碱盐:
②弱碱强酸盐:
形成盐的弱酸酸性越弱,其酸根离
子越易水解,溶液的碱性越强。越弱越水解。 形成盐的碱碱性越弱,其金属阳离
子越易水解,溶液的酸性越强。外因:符合勒夏特列原理① 温度:
② 浓度:
③酸碱盐的影响稀释促进水解升温促进水解讨论:
1.比较同浓度的下列各组溶液pH值的大小:
提示:变价阳离子,价态越高,越易水解
Na2CO3 ___ CH3COONa ;
B.AlCl3 ___MgCl2
C.NaHCO3 ___ Na2CO3 ;
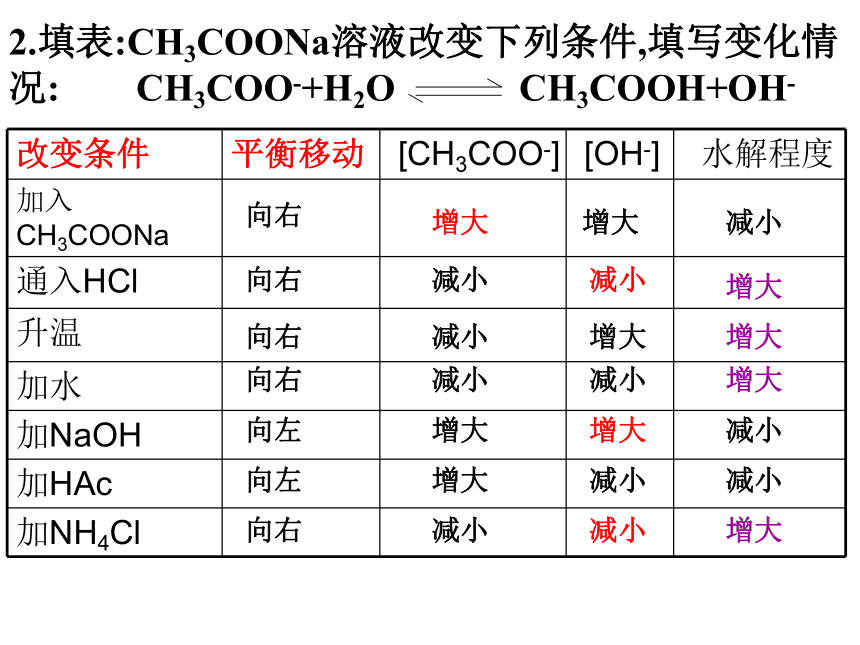
D.FeCl2 ___FeCl3><<>2.填表:CH3COONa溶液改变下列条件,填写变化情况: CH3COO-+H2O CH3COOH+OH-
向右增大增大减小向右减小减小增大向右减小增大增大向右
减小减小增大向左向左增大增大增大减小减小减小向右
减小减小增大(一)工农业生产和日常生活中的应用: ①明矾能净水,Fe3+盐也能净水,试解释其原
理,写出水解的离子方程式.②热的纯碱溶液去污效果更好.温度高,水解程度大,[OH-]大.③过磷酸钙不宜与草木灰混合施用.K2CO3草木灰水解显碱性,使可溶的磷酸二氢钙[Ca(H2PO4)2]转化为难溶的磷酸一氢钙或磷酸钙.水解原理的应用 (二)溶液的配置和保存
①配置下列溶液应注意那些问题?
FeCl3
FeCl2
AgNO3
SnCl2 ( 加HCl )( 加HCl、 Fe )( 加HNO3 )( 加HCl、 Sn )②Na2CO3 Na2SiO3 Na3PO4等溶液的保存能否在磨口试剂瓶中?并说明原因?加入Fe是为了防止Fe2+氧化成Fe3+:
Fe + 2Fe3+ === 2Fe2+作用同铁(三)判断盐溶液的酸碱性
例.下列盐溶液因水解而显酸性的是( )
A.Na2S B.NaHCO3
C.Na2HPO4 D.NH4Cl(四)比较盐溶液pH值的大小
例.已知一元弱酸的电离程度为:HX>HY>HZ, 则可知它们钾盐的pH大小为 。(五)依据盐溶液PH的不同,判断相应酸(碱)的酸性(碱性)强弱
例.已知物质的量浓度相同的三种盐溶液:NaX,NaY,NaZ,它们的PH依次为:8,9,10,则可知对应酸的酸性强弱顺序为: 。KX
例.下列物质的溶液中所含离子种类最多的是( )
A.Na2S B.Na3PO4 C.Na2CO3 D.AlCl3(七)判断离子在同一溶液中能否大量共存
例.Al3+不能与AlO2-、HCO3-、CO32-等大量共存于同一溶液,这是因为Al3+水解显酸性, AlO2-、HCO3-、CO32-水解显碱性,相遇会发生双水解反应(八)依据盐溶液的pH,可求出溶液中水电离出的?H+?或?OH-?,反之亦然。
例.25℃时某KCN溶液的pH=12,则可知该溶液中水电离出的?OH-?=10-2mol/L。这是因为水解呈碱性的溶液中:?OH-?水=?OH-?碱。B(九)某些活泼金属(如 Mg,Al,Zn等)溶于盐溶液中产生氢气。
例.将镁条插入NH4Cl溶液中,会产生H2和NH3,这是因为NH4Cl水解:
NH4+ + H2O ≒NH3·H2O +H+
使溶液显酸性,镁可置换出氢:
Mg +2H+ =Mg2+ +H2?
同时促进NH4+水解,生成大量NH3·H2O,有部分NH3逸出。(十一)某些无水盐的制备
例.把AlCl3溶液蒸干后再灼烧,最后得到的固体产物主要是Al2O3而不是AlCl3。这是由于加热促进Al3+的水解,又使生成的HCl以气体形式逸散,而使Al3+水解完全生成Al(OH)3,Al(OH)3受热分解生成Al2O3。(十)明矾、FeCl3都是净水剂,这与Al3+、Fe3+水解生成具有强吸附作用的胶体有关。(十二)判断物质的成分
例.水垢的主要成分是CaCO3和Mg(OH)2,基本上不含MgCO3,这是因为MgCO3微溶于水,长时间加热,水解生成了更难溶的Mg(OH)2。(十三)选用试剂鉴别物质
例.现有Al2(SO4)3,HAc,NaCl,BaCl2四种溶液,可以将它们区别开的一种试剂是( )
A.H2SO4 B.AgNO3 C.Na2CO3 D.NaHCO3(十四)除杂或离子分离对试剂的选择
例18.已知pH=5的MgCl2溶液中含有杂质FeCl3,为除去杂质可加入的试剂是( )
A.MgO B.MgCO3 C.NaOH D.NaHCO3(十六)中和滴定中确定终点时对指示剂的选择(十五)制备某些胶体CA练习:
1.浓度均为0.1mol/L的①NaHCO3 ②Na2CO3 ③NaCl
④NaHSO4四种溶液,按pH由小到大的顺序是 ( )
A. ①②③④ B. ④③②①
C. ④③①② D. ②①④③ C2、将10mL0.1mol/L氨水和10mL0.1mol/L盐酸混合后,
溶液里各种离子物质的量浓度的关系是 ( )
A.[Cl--]+[OH--]=[NH4+]+[H+]
B. [Cl--]> [NH4+]> [H+] > [OH-]
C. [H+] > [OH--]> [Cl--]> [NH4+]
D. [Cl--]> [H+] > [NH4+]> [OH-]AB3.下面提到的与盐的水解无关的正确说法是:( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,溶液时往往在FeCl3溶液中加
入少量的盐酸
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与氨态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性
A. ① ③ ⑥ B. ② ③ ⑤ C. ③ ④ ⑤ D.全有关D4.下列各组离子在溶液中能否大量共存? 说明原因.
1. H+ CH3COO- K+ Cl-
2. S2- Al3+ Cl- Na+
3. CO32- NO3- H+ K+
4. Cl- Ca2+ NO3- CO32-
5. Fe2+ H+ Cl- NO3-弱电解质双水解气体沉淀氧化还原(十七)溶液中离子浓度关系 电解质溶液中守恒关系:
电荷守恒. 物料守恒. 质子守恒. 定组成关系守恒.以0.1mol/LNa2S溶液为例:
溶液中多量离子:
微量离子:Na+、 S2-OH- 、H+ 、 HS-1.由于整个溶液不显电性:n∑Min+=m∑Mim-
电荷守恒关系:[Na+]+[H+]=[OH-]+[HS-]+2[S2-]2.考虑硫元素水解前后守恒:
物料守恒关系:[S2-] +[HS-]+[H2S]=0.1mol/L3.考虑钠元素与硫元素形成Na2S的定组成关系:
定组成守恒关系:1/2[Na+]=[S2-]+[HS-]+[H2S]4.考虑盐类水解或电离时由水本身电离出的
[H+]=[OH-]
质子守恒:[OH-]= [H+] +[HS-] +2[H2S]5.水解或电离程度不同,使离子间形成的大小关系不同[Na+] >[S2-]> [OH-]> [HS-]> [H+] 讨论: 1.(1)NH4Cl溶液中存在的平衡有
微粒种类有:
这些微粒种类之间存在的等式关系有
各离子浓度由大到小的
NH4++H2O NH3.H2O+H+
H2O H++OH-分子: NH3.H2O 、H2O
离子: NH4+、OH-、 H+、Cl-
[Cl-]>[NH4+] >[H+]>[ OH-]
电荷: [NH4+] +[H+] =[Cl-] +[ OH-]
物料: [Cl-]= [NH4+]+[NH3.H2O]
2.在硫化钠溶液中存在多种离子和分子,下列关系正确的是( )
A.[Na+]>[S2-]>[OH-]>[HS-]
B.[OH-]=2[HS-]+[H+]+[H2S]
C. [OH-] =[HS-] +[H+] +[H2S]
D. D.[Na+]+[H+]= [OH-] +[HS-] +[S2-]A3.向0.1mol/LNaOH溶液中逐渐加入0.1mol/LCH3COOH
溶液,至溶液中[Na+]=[CH3COO-]。此时溶液的pH值是( )
A .pH=7 B. pH>7 C. pH<7 D.无法确定
4.表示0.1mol/LNaHCO3溶液中有关微粒的关系式,正确的是( )
A.[Na+]>[HCO3-]>[CO32-]>[ H+]>[OH-]
B. [Na+] +[ H+] =[HCO3-]+ [CO32-] +[OH-]
C. [Na+] +[ H+] =[HCO3-]+ 2[CO32-] +[OH-]
D. [Na+] = [HCO3-] + [CO32-] +[H2CO3]
ACD 5. 将pH=3的盐酸和Ph=11的氨水等体积混合后,溶液中离子浓度大小关系是______________________[NH4+]>[Cl-]>[OH-]>[H+]6.0.1mol/LNaOH和0.2mol/LCH3COOH等体积混合后溶
液中各离子浓度由大到小的顺序是
。[CH3COO- ]>[Na+]>[ H+]>[OH-]7.为了使Na2S溶液中[Na+] /[S2-]接近于2.1,可加入的物质是( )
A.盐酸 B.适量的NaOH
C.适量的KOH D.适量的NaHS溶液
C8.0.1mol/L的下列各溶液,其中浓度由小到大的顺序是
①(NH4)2SO4 ② NH4HSO4 ③CH3COONH4
④NH4HCO3 ⑤NH4Cl ⑥ (NH4)2CO3 ④ <③< ⑤< ②<⑥< ①9.物质的量浓度相同的下列物质,其离子浓度的比较中错误 的是( )
A.[PO43-]: Na3PO4>Na2HPO4>NaH2PO4>H3PO4
B.[CO32-]: (NH4)2CO3>Na2CO3>NaHCO3>NH4HCO3
C.[NH4+]: (NH4)2SO4> (NH4)2CO3>NH4HSO4>NH4Cl
D. [S2-]: Na2S>H2S>NaHS>(NH4)2SBD
