盐的水解[下学期]
图片预览







文档简介
课件61张PPT。 盐类的水解第一节 以水的电离平衡为基础,
说明HCl、NaOH 的水溶液为什么分别显示酸性和碱性?请思考〖试一试〗用pH试纸检验下列溶液显酸性、碱性、中性?
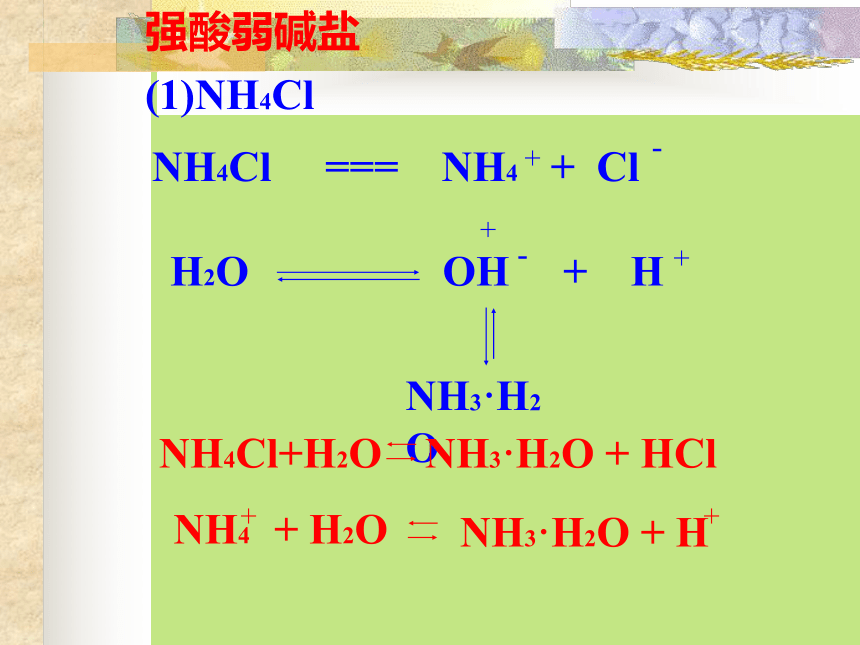
(1)CH3COONa (2)Na2CO3 (3)NH4Cl
(4)Al2(SO4)3 (5)NaCl (6)KNO3 结论:
CH3COONa 、 Na2CO3 的溶液显碱性
NH4Cl、 Al2(SO4)3 的溶液显酸性
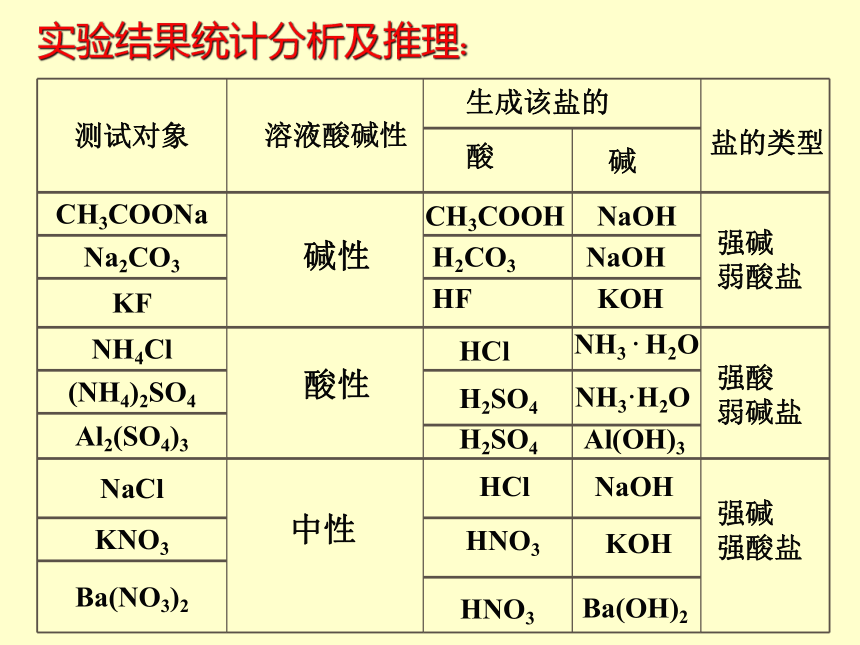
NaCl 、KNO3 的溶液显中性实验结果统计分析及推理:碱性酸性中性生成该盐的酸碱CH3COOH NaOH
H2CO3 NaOH
HF KOHHClNH3 · H2O
H2SO4NH3·H2O
H2SO4Al(OH)3
HClNaOHHNO3
KOH
HNO3
Ba(OH)2
盐的类型强碱
弱酸盐强酸
弱碱盐强碱
强酸盐 请思考CH3COONa是什么类型的电解质?它在水中以什么形式存在?
其水溶液中存在哪些微粒?
这些微粒能相互反应吗?
若反应,结果怎么样?
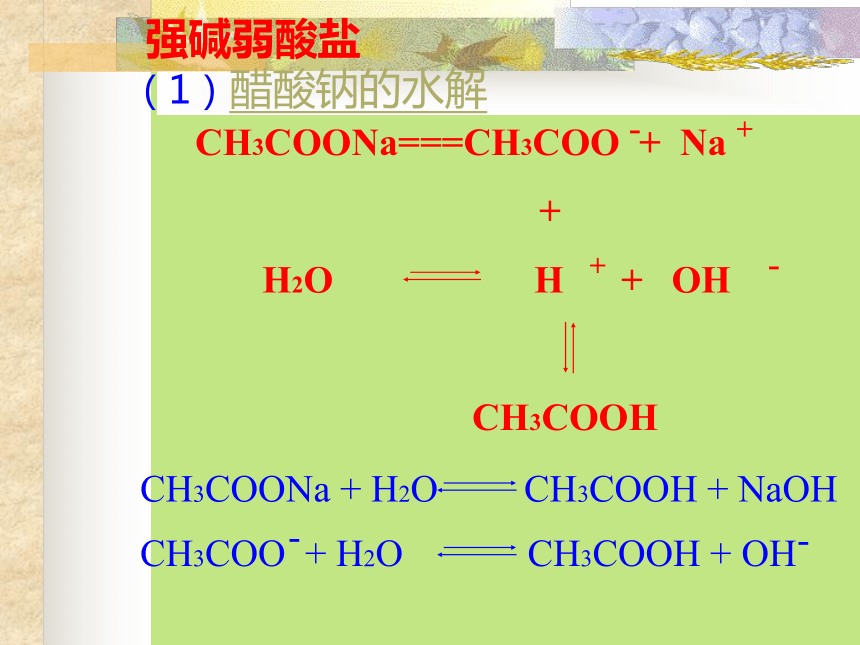
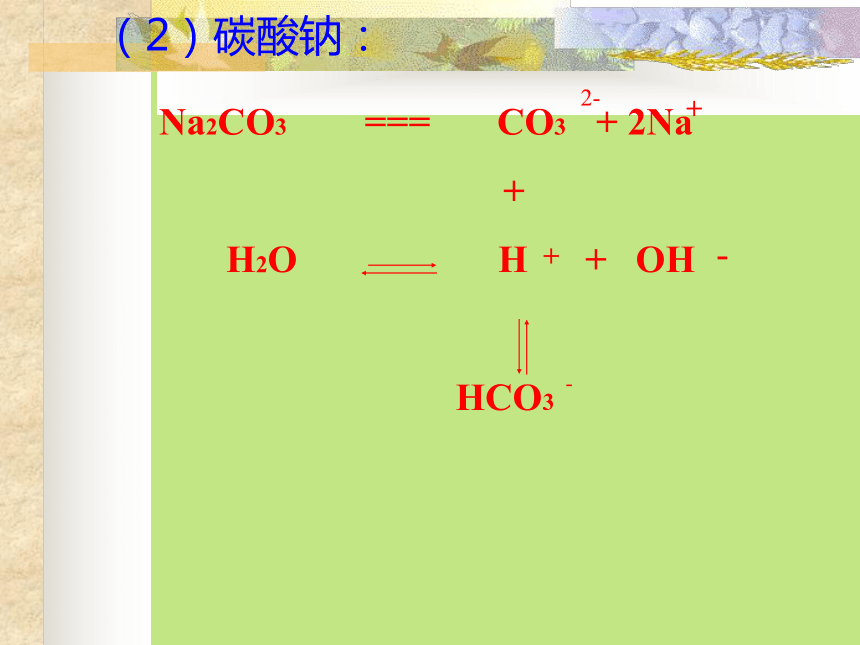
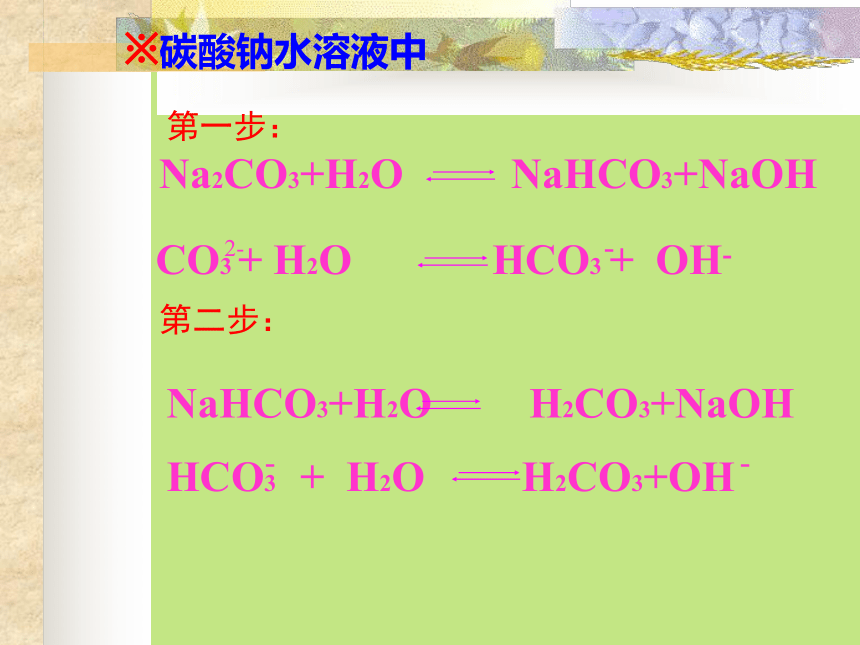
强碱弱酸盐(1)醋酸钠的水解 (2)碳酸钠: 第一步:2--第二步:※碳酸钠水溶液中强酸弱碱盐(1)NH4Cl(2)Al2(SO4)3一. 盐类的水解 在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。水解的条件:生成弱电解质。水解的实质:破坏了水的电离平衡。水解反应与中和反应的关系:酸+碱 盐+水中和水解对概念的理解二. 盐类水解的规律水解水解
不水解
强烈
水解弱碱
阳离子弱酸
阴离子无
阴、
阳离子
弱碱
弱酸
无
弱酸、
弱碱
酸性碱性中性
具体判断
谁弱谁水解谁强显谁性都强不水解。◎盐类水解的规律:
※有弱才水解,
※无弱不水解,
※越弱越水解,
※谁强显谁性。课堂练习:1. 下列溶液PH小于7的是A、 溴化钾 B、 硫酸铜 C、 硫化钠 D、 硝酸钡2. 下列溶液能使酚酞指示剂显红色的是A 、碳酸钾 B、 硫酸氢钠 C、 碳酸氢钠 D、 氯化铁3.下列离子在水溶液中不会发生水解的是A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
4.? 氯化铵溶液中离子浓度从大到小排列正确的是:
A NH4+ 、H + 、OH-、Cl_ B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _ D Cl、 NH4+ 、 OH- 、H +
4、下列盐,属于强酸弱碱盐的是____,属于强碱弱酸盐的是_____,属于强碱强酸盐的是_____,属于弱碱弱酸盐的是____。
NaCl、CH3COONa、K2CO3、Ba(NO3)2、
CH3COONH4、AlCl3、NaF、 Na2S、NH4NO3 、
CuSO4 、MgCl2、Na3PO4、NH4HCO3、K2SO45、下列离子能发生水解的弱酸根离子有:___,
弱碱阳离子有:_____。
(1)CO32-、 (2) SO42-、 (3) NO3-、 (4)F-、 (5) Cl-、 (6)I-、 (7) Br-、 (8)S2- (9) ClO4-、 (10) HS-、(11)HCO3-、 (12) CH3COO-、(13) Ba2+、 (14)Na+ (15) Cu2+、 (16)Al3+、 (17) K+、 (18) NH4+、 (19) Fe3+、 (20)Mg2+、 ( 21)Zn2+、 (22) SO32-、(23)H2PO4- (24)Ag+1、4、8、10、11、12、22、2315、16、18、19、20、21、246、下列盐溶液PH值小于7的有:_____,PH值等于7的有:_____,PH值大于7的有:__。
(1)Na2CO3、 (2) KNO3、 (3)CaCl2
(4) CuSO4 (5) CH3COOK(6)NH4NO3、
(7)AlCl3、 (8)BaCl2、 (9)NaHSO4、
(10)NaHCO3 (11)NaF、 (12)FeSO4
(13)MgSO4 (14)Na2S盐类水解盐类水解第二节复习
1、怎样判断盐类物质是否发生水解?
2、盐类溶液的酸碱性怎样判断?练习:
1、在水中加入下列物质,可使水的电离平衡正向移动的是( )
A、NaCl B、Na2CO3
C、NH4Cl D、NaHSO4
2、下列物质的水溶液,由于水解而呈酸性的是( )
A、NaHSO4 B、NaHCO3
C、HCl D、AlCl3BDD盐类水解方程式的书写例1、书写下列物质水解的方程式:
NaF、Na2CO3、NH4Cl、CuCl2 例2、书写下列物质水解的方程式:
Al2S3、Mg3N2 三、盐类水解方程式的书写规律 1、盐类水解一般是比较微弱的,通常用“ ”表示,同时无沉淀和气体产生。
2、多元弱酸的酸根离子水解是分步进行的,第一步水解程度比第二水解程度大,故相同物质的量浓度的Na2CO3和NaHCO3溶液,Na2CO3溶液碱性比NaHCO3强。
3、多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。
4、对于发生双水解的盐类,因水解彻底,故用“=”,同时有沉淀和气体产生。
5、多元弱酸的酸式酸根离子,水解和电离同步进行。练习 书写下列物质水解的方程式:
NaCIO、 NaHCO3、 FeCl2
Fe2(SO4)3、 FeCl3、 CH3COOK
NH4NO3、 Na2SiO3 、 Al2(SO4)3
NH4HCO3
四、影响盐类水解的因素影响盐类水解的主要因素是盐本身的性质。另外还受外在因素影响:
1、温度:盐的水解反应是吸热反应,升高温度水解程度增大。
2、浓度:盐的浓度越小,一般水解程度越大。加水稀释盐的溶液,可以促进水解。
3、溶液的酸、碱性:盐类水解后,溶液会呈不同的酸、碱性,因此控制溶液的酸、碱性,可以促进或抑制盐的水解,故在盐溶液中加入酸或碱都能影响盐的水解。 思考: Na2CO3溶液中加入NaOH或HCI会使水解平衡如何移动?要使钠离子的浓度是碳酸根离子浓度的2倍,应采取什么措施?巩固练习相同浓度的下列溶液中,[CO32-]的大小关系依次为( )
①Na2CO3 ②NaHCO3 ③H2CO3
④(NH4)2CO3 ⑤NH4HCO3① > ④ > ② > ⑤ > ③盐类水解及应用第三节复习:1、影响盐类水解的因素有哪些?
2、盐类水解的规律?
3、写出下列物质水解反应的离子方程式?
CH3COONa、NH4Cl、Na2CO3、AlCl3有弱才水解,越弱越水解
谁弱谁水解,谁强显谁性
都强不水解, 溶液显中性。五、盐类水解的应用: 思考判断下列水溶液的酸碱性
(1)NaHCO3(2)KCl(3)Cu(NO3)2
(4)KClO (5)NaF五盐类水解的应用 (一)判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑盐的水解。
如:相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaClO、NaAc、Na2SO4、NaHCO3、NaOH 、(NH4)2SO4、NaHSO4等溶液,PH值由大到小的顺序为:
NaOH>NaClO>Na2CO3>NaHCO3>NaAc
>Na2SO4>(NH4)2SO4>NaHSO4 1)弱酸根离子对应的弱酸越弱,水解程度越大,
碱性越强。 常见的弱酸比较:
H2SO3 > H3PO4 >HF >HCOOH > CH3COOH
> H2CO3 > H2S > HCIO > HCN2)弱碱离子对应的弱碱越弱,水解程度越大,
酸性越强。3)酸式盐溶液酸碱性比较:
电离作用大于水解作用的离子: HSO3- 、 H2PO4-
水解作用大于电离作用:其余弱酸的酸式酸根离子判断下列盐溶液的酸碱性
A:Na2HPO4 B: KHSO4 C: KH2PO4
D :NaHCO3 E: NaHS F:NaHSO4
显酸性的有:
显碱性的有: B C FA D E五、盐类水解的应用(二)比较盐溶液中各离子浓度的相对大小时,当盐中含有易水解的离子,需考虑盐的水解。
练:25℃时,在浓度均为1mo/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中[NH4+]分别为a、b、c(单位为moI/L),则下列判断正确的是( )
A.a=b=c B.c>a>b
C.b>a>c D.a>c>b B1.多元弱酸盐和多元弱酸溶液
CH3COONa溶液:
[Na +] >[CHCOO -] >[OH -] >[H +]Na 2S溶液S2-+H2O HS-+OH-
HS-+H2O OH- + H 2S[Na +] > [S2- ] >[OH -] > [HS- ] >[H +]
H 2S: H 2S H + + HS-
HS- H + + S2-[H +] > [HS- ] > [S2- ] >[OH -] NaHCO3: HCO3- +H20 H2CO3+ OH-
H3PO4: H3PO4 H+ + H2PO4-
H2PO4- H+ + HPO42-
HPO42- H+ + PO43-
[Na+] >[HCO3- ] > [OH-] > [H+]
[H+] >[H2PO4- ] >[HPO42- ] >[PO43- ] > [OH-]
2.混合液:
NH4Cl~ NH3·H2O(1:1)[NH4 +] >[CI -] >[OH -] >[H +]HAC~NaAC(1:1)3.物料守恒(原子守恒)
Na 2S溶液: Na 2S=2 Na+ + S2-
S2-+H2O HS-+OH-
HS-+H2O OH- + H 2S
[Na+]=2[S2- ]+ 2[ HS-]+2[H 2S]Na2CO3
[Na+] = 2[CO3- ] +2[HCO3- ] +2 [H2CO3 ]
NaCI~ NH4Cl
[Cl-]=[NaCl]+[NH4Cl]= [Na+] +[NH4+ ]+ [NH3·H2O]4.电荷守恒(原子守恒)
Na 2S溶液:[Na +] + [H +]=2[S2- ] +[OH -] +[HS- ]
NaHCO3:[Na+] + [H+]=[HCO3- ] + 2[CO3- ]+[OH-]
NaCI~ NH4Cl:
[NH4+ ]+ [H+]= [OH-] + [Cl-]5.水电离的H +和OH -守恒
Na 2S溶液:[OH - ]= [HS- ] +2[H 2S]+ [H + ]
Na2CO3 [OH - ]= [HCO3- ] + 2 [H2CO3 ]+[H + ]
Na3PO4:: [OH - ]= [HPO42- ]+ 2[H2PO4- ] +3[H3PO4 ] +[H+]
五、盐类水解的应用(三)判断溶液中离子能否大量共存。当有弱碱阳离子和弱酸阴离子之间能发出双水解,则不能在溶液中大量共存。
如:Al3+、 Fe3+与HCO3-、CO32-、SiO32-等,不能在溶液中大量共存。
Al2S3、CaC2、Mg3N2、 在水溶液中发生双水解,只能用干法制取。(四)解释某些实验现象及在生产、生活中的应用
1.配制易水解的盐溶液时,需考虑抑制盐的水解,如在配制强酸弱碱盐溶液时,需滴加几滴对应的强酸,来抑制盐的水解。 思考:热水配制CuCl2溶液,应该出现什么现象?热水:升温能够促进水解实验现象:溶液出现浑浊原因:CuCl2+2H2O Cu(OH)2+2HCl-Q
或Cu2++2H2O Cu(OH)2+2H+ -Q配制CuCl2溶液,为防止出现浑浊,应加少量的
_______ 稀盐酸思考:用热水配制硫酸铁溶液时,为什么会产生混浊?怎样才能用热水配制出澄清的硫酸铁溶液?[小结]:配制易水解的金属盐溶液应加少量的______________配制Fe2(SO4)3溶液,要先加少量的稀H2SO4。 同种酸。2.某些试剂的实验室存放,需要考虑盐的水解。
如:Na2CO3、Na2SiO3等水解呈碱性,不能存 放在磨口玻璃塞的试剂瓶中;
NH4F水解应会产生HF,会腐蚀玻璃 , 不能存放在玻璃瓶中。3.加热蒸发可水解的盐溶液 例:把FeCl3溶液蒸干灼烧,最后得到的固体产物是Fe2O3.为什么? FeCl3+3H2O Fe(OH)3+3HCl⑴加热促进水解 ⑵HCl挥发思考:Al2(SO4)3溶液加热蒸发后得到固体是什么?尽管Al3+水解生成Al(OH)3和H2SO4,但由于H2SO4是高沸点酸,不易挥发,加热最终只是把水蒸去,因此仍得Al2(SO4)3固体。3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O4.某些活泼金属与水解显酸性盐溶液的反应【实验】 把Mg粉放入NH4Cl溶液实验现象:剧烈反应有气体放出,有刺激性气味[思考]检验NH3方法?检验结果:湿润的红色的石蕊试纸变蓝,说明刺激性气味的气体是NH3 。用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒NH4++H2O NH3?H2O + H+Mg+ 2H+ = Mg2+ + H2↑5.热纯碱水去油污能力强: 在碱性条件下去油污能力强[生活常识] 为什么用肥皂洗衣服时用温水比冷水洗得干净一些? 肥皂主要成分:硬脂酸钠(C17H35COONa)
硬脂酸(C17H35COOH)是一种一元弱酸C17H35COO-+H2O C17H35COOH+OH- -Q农业谚语 :
“灰混粪,粪混灰,灰粪相混损肥分。” 思考:为什么会损肥分? [实验] 饱和K2CO3(草木灰的主要成分)溶液和NH4Cl晶体混合 6.草木灰不宜与铵态氮肥混合施用: 草木灰的成分:K2CO3,水解呈碱性铵态氮肥——铵盐,水解呈酸性。
NH4++H2O NH3·H2O+ H+, 混施后,OH-与H+中和成水,使两种盐的水解平衡强烈地向右移动,以至生成大量的NH3·H2O,进一步分解成NH3逸出了,从而降低了肥效。灭火器原理塑料筒里面放入的什么是药品?外筒放入的是什么药品?泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。 药品:Al2(SO4)3溶液、NaHCO3溶液7.泡沫灭火器的原理应用双水解Al3++3H2O Al(OH)3+3H+,
HCO3-+H2O H2CO3 +OH-,
总式:Al3++3HCO3- = Al(OH)3↓+3CO2↑;当矾与碱放入水中时,它们之间会发生化学变化,产生大量CO2和絮状物。与面合在一起时,絮状物Al(OH)3与面产生膜状物,将CO2气体包住。油条放入热油锅中, CO2受热膨胀,使油条胀大。这就是炸油条要放矾、碱的原因。但其间的配比一定要掌握好,明矾多了,水解产生的Al(OH)3就多,使油条遇热产生硬、脆、多泡现象,而且耗油量大。若碱放多了,则会使油条颜色发黄,增加其苦涩味。矾与碱之比以2.5:3.5较为合适。 炸油条或油饼时必须要放明矾与纯碱8.选择制备盐的途径时,需考虑盐的水解。如制备Al2S3时,因无法在溶液中制取,会完全水解,只能由干法直接反应制取。
加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入HCl气体,以抑制FeCl3的水解,才能得到其固体。
练:要制得较纯的FeS沉淀,在FeCl2溶液中加入的试剂是( )
A.Na2S B.NaHS C.H2S D.(NH4)2S 9.溶液中,某些离子的除杂,需考虑盐的水解。
练:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( )
A.氧化镁 B.氢氧化钠
C.碳酸钠 D. 碳酸镁 9.鉴别溶液时可考虑盐类的水解
如:鉴别NaCI和NaCN两种溶液练习:1、盐碱地(含较多NaCl、Na2CO3)不利于作物生长,产生碱性的原因(用离子方程式表示)_______________________, 施用适量石膏可降低盐碱地的碱性,表示其反应原理的离子方程式__________________. CO32-+H2O HCO3-+OH-Ca2+ + CO32- = CaCO3↓2、(上海高考)在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质的固体的是( )
A. AlCl3 B. NaHCO3 C. MgSO4 D. KMnO4C3、SnCl2溶液易水解,实验室应如何保存?实验室保存SnCl2是向其中加入少量的稀盐酸
(抑制水解)和少量的金属锡(+2价的锡
不稳定,这样可以防止被氧化) Sn4+ + Sn = 2Sn2+
SnCl2+2H2O Sn(OH)2+2HCl4、下列溶液加入金属镁可以产生H2的是( )
CH3COOH B. NaHCO3
C. NH4Cl D. NaClOAC5、下列离子方程式正确的是( )
A. Fe3++3H2O Fe(OH)3↓+3H+
B. NH4++H2O = NH3·H2O+ H+
C. CO32-+H2O H2CO3+OH-
D. HCO3-+H2O H2CO3 +OH-D6、为什么不能从溶液中直接制取Al2S3?因Al3+、S2-均能水解,Al3+水解使溶液呈酸性,S2-水解使溶液呈碱性。如Al3+、S2-在同一溶液中,它们将相互促进水解而使水解完全,从而得不到Al2S3。 再见练习:
1、将AlCl3溶液加热蒸干之后灼烧,最后得到的固体物质是什么?
2、实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是
A、防止硫酸铁分解 B、抑制硫酸铁水解
C、提高硫酸铁的溶解度 D、提高溶液的PH值
说明HCl、NaOH 的水溶液为什么分别显示酸性和碱性?请思考〖试一试〗用pH试纸检验下列溶液显酸性、碱性、中性?
(1)CH3COONa (2)Na2CO3 (3)NH4Cl
(4)Al2(SO4)3 (5)NaCl (6)KNO3 结论:
CH3COONa 、 Na2CO3 的溶液显碱性
NH4Cl、 Al2(SO4)3 的溶液显酸性
NaCl 、KNO3 的溶液显中性实验结果统计分析及推理:碱性酸性中性生成该盐的酸碱CH3COOH NaOH
H2CO3 NaOH
HF KOHHClNH3 · H2O
H2SO4NH3·H2O
H2SO4Al(OH)3
HClNaOHHNO3
KOH
HNO3
Ba(OH)2
盐的类型强碱
弱酸盐强酸
弱碱盐强碱
强酸盐 请思考CH3COONa是什么类型的电解质?它在水中以什么形式存在?
其水溶液中存在哪些微粒?
这些微粒能相互反应吗?
若反应,结果怎么样?
强碱弱酸盐(1)醋酸钠的水解 (2)碳酸钠: 第一步:2--第二步:※碳酸钠水溶液中强酸弱碱盐(1)NH4Cl(2)Al2(SO4)3一. 盐类的水解 在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。水解的条件:生成弱电解质。水解的实质:破坏了水的电离平衡。水解反应与中和反应的关系:酸+碱 盐+水中和水解对概念的理解二. 盐类水解的规律水解水解
不水解
强烈
水解弱碱
阳离子弱酸
阴离子无
阴、
阳离子
弱碱
弱酸
无
弱酸、
弱碱
酸性碱性中性
具体判断
谁弱谁水解谁强显谁性都强不水解。◎盐类水解的规律:
※有弱才水解,
※无弱不水解,
※越弱越水解,
※谁强显谁性。课堂练习:1. 下列溶液PH小于7的是A、 溴化钾 B、 硫酸铜 C、 硫化钠 D、 硝酸钡2. 下列溶液能使酚酞指示剂显红色的是A 、碳酸钾 B、 硫酸氢钠 C、 碳酸氢钠 D、 氯化铁3.下列离子在水溶液中不会发生水解的是A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
4.? 氯化铵溶液中离子浓度从大到小排列正确的是:
A NH4+ 、H + 、OH-、Cl_ B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _ D Cl、 NH4+ 、 OH- 、H +
4、下列盐,属于强酸弱碱盐的是____,属于强碱弱酸盐的是_____,属于强碱强酸盐的是_____,属于弱碱弱酸盐的是____。
NaCl、CH3COONa、K2CO3、Ba(NO3)2、
CH3COONH4、AlCl3、NaF、 Na2S、NH4NO3 、
CuSO4 、MgCl2、Na3PO4、NH4HCO3、K2SO45、下列离子能发生水解的弱酸根离子有:___,
弱碱阳离子有:_____。
(1)CO32-、 (2) SO42-、 (3) NO3-、 (4)F-、 (5) Cl-、 (6)I-、 (7) Br-、 (8)S2- (9) ClO4-、 (10) HS-、(11)HCO3-、 (12) CH3COO-、(13) Ba2+、 (14)Na+ (15) Cu2+、 (16)Al3+、 (17) K+、 (18) NH4+、 (19) Fe3+、 (20)Mg2+、 ( 21)Zn2+、 (22) SO32-、(23)H2PO4- (24)Ag+1、4、8、10、11、12、22、2315、16、18、19、20、21、246、下列盐溶液PH值小于7的有:_____,PH值等于7的有:_____,PH值大于7的有:__。
(1)Na2CO3、 (2) KNO3、 (3)CaCl2
(4) CuSO4 (5) CH3COOK(6)NH4NO3、
(7)AlCl3、 (8)BaCl2、 (9)NaHSO4、
(10)NaHCO3 (11)NaF、 (12)FeSO4
(13)MgSO4 (14)Na2S盐类水解盐类水解第二节复习
1、怎样判断盐类物质是否发生水解?
2、盐类溶液的酸碱性怎样判断?练习:
1、在水中加入下列物质,可使水的电离平衡正向移动的是( )
A、NaCl B、Na2CO3
C、NH4Cl D、NaHSO4
2、下列物质的水溶液,由于水解而呈酸性的是( )
A、NaHSO4 B、NaHCO3
C、HCl D、AlCl3BDD盐类水解方程式的书写例1、书写下列物质水解的方程式:
NaF、Na2CO3、NH4Cl、CuCl2 例2、书写下列物质水解的方程式:
Al2S3、Mg3N2 三、盐类水解方程式的书写规律 1、盐类水解一般是比较微弱的,通常用“ ”表示,同时无沉淀和气体产生。
2、多元弱酸的酸根离子水解是分步进行的,第一步水解程度比第二水解程度大,故相同物质的量浓度的Na2CO3和NaHCO3溶液,Na2CO3溶液碱性比NaHCO3强。
3、多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。
4、对于发生双水解的盐类,因水解彻底,故用“=”,同时有沉淀和气体产生。
5、多元弱酸的酸式酸根离子,水解和电离同步进行。练习 书写下列物质水解的方程式:
NaCIO、 NaHCO3、 FeCl2
Fe2(SO4)3、 FeCl3、 CH3COOK
NH4NO3、 Na2SiO3 、 Al2(SO4)3
NH4HCO3
四、影响盐类水解的因素影响盐类水解的主要因素是盐本身的性质。另外还受外在因素影响:
1、温度:盐的水解反应是吸热反应,升高温度水解程度增大。
2、浓度:盐的浓度越小,一般水解程度越大。加水稀释盐的溶液,可以促进水解。
3、溶液的酸、碱性:盐类水解后,溶液会呈不同的酸、碱性,因此控制溶液的酸、碱性,可以促进或抑制盐的水解,故在盐溶液中加入酸或碱都能影响盐的水解。 思考: Na2CO3溶液中加入NaOH或HCI会使水解平衡如何移动?要使钠离子的浓度是碳酸根离子浓度的2倍,应采取什么措施?巩固练习相同浓度的下列溶液中,[CO32-]的大小关系依次为( )
①Na2CO3 ②NaHCO3 ③H2CO3
④(NH4)2CO3 ⑤NH4HCO3① > ④ > ② > ⑤ > ③盐类水解及应用第三节复习:1、影响盐类水解的因素有哪些?
2、盐类水解的规律?
3、写出下列物质水解反应的离子方程式?
CH3COONa、NH4Cl、Na2CO3、AlCl3有弱才水解,越弱越水解
谁弱谁水解,谁强显谁性
都强不水解, 溶液显中性。五、盐类水解的应用: 思考判断下列水溶液的酸碱性
(1)NaHCO3(2)KCl(3)Cu(NO3)2
(4)KClO (5)NaF五盐类水解的应用 (一)判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑盐的水解。
如:相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaClO、NaAc、Na2SO4、NaHCO3、NaOH 、(NH4)2SO4、NaHSO4等溶液,PH值由大到小的顺序为:
NaOH>NaClO>Na2CO3>NaHCO3>NaAc
>Na2SO4>(NH4)2SO4>NaHSO4 1)弱酸根离子对应的弱酸越弱,水解程度越大,
碱性越强。 常见的弱酸比较:
H2SO3 > H3PO4 >HF >HCOOH > CH3COOH
> H2CO3 > H2S > HCIO > HCN2)弱碱离子对应的弱碱越弱,水解程度越大,
酸性越强。3)酸式盐溶液酸碱性比较:
电离作用大于水解作用的离子: HSO3- 、 H2PO4-
水解作用大于电离作用:其余弱酸的酸式酸根离子判断下列盐溶液的酸碱性
A:Na2HPO4 B: KHSO4 C: KH2PO4
D :NaHCO3 E: NaHS F:NaHSO4
显酸性的有:
显碱性的有: B C FA D E五、盐类水解的应用(二)比较盐溶液中各离子浓度的相对大小时,当盐中含有易水解的离子,需考虑盐的水解。
练:25℃时,在浓度均为1mo/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中[NH4+]分别为a、b、c(单位为moI/L),则下列判断正确的是( )
A.a=b=c B.c>a>b
C.b>a>c D.a>c>b B1.多元弱酸盐和多元弱酸溶液
CH3COONa溶液:
[Na +] >[CHCOO -] >[OH -] >[H +]Na 2S溶液S2-+H2O HS-+OH-
HS-+H2O OH- + H 2S[Na +] > [S2- ] >[OH -] > [HS- ] >[H +]
H 2S: H 2S H + + HS-
HS- H + + S2-[H +] > [HS- ] > [S2- ] >[OH -] NaHCO3: HCO3- +H20 H2CO3+ OH-
H3PO4: H3PO4 H+ + H2PO4-
H2PO4- H+ + HPO42-
HPO42- H+ + PO43-
[Na+] >[HCO3- ] > [OH-] > [H+]
[H+] >[H2PO4- ] >[HPO42- ] >[PO43- ] > [OH-]
2.混合液:
NH4Cl~ NH3·H2O(1:1)[NH4 +] >[CI -] >[OH -] >[H +]HAC~NaAC(1:1)3.物料守恒(原子守恒)
Na 2S溶液: Na 2S=2 Na+ + S2-
S2-+H2O HS-+OH-
HS-+H2O OH- + H 2S
[Na+]=2[S2- ]+ 2[ HS-]+2[H 2S]Na2CO3
[Na+] = 2[CO3- ] +2[HCO3- ] +2 [H2CO3 ]
NaCI~ NH4Cl
[Cl-]=[NaCl]+[NH4Cl]= [Na+] +[NH4+ ]+ [NH3·H2O]4.电荷守恒(原子守恒)
Na 2S溶液:[Na +] + [H +]=2[S2- ] +[OH -] +[HS- ]
NaHCO3:[Na+] + [H+]=[HCO3- ] + 2[CO3- ]+[OH-]
NaCI~ NH4Cl:
[NH4+ ]+ [H+]= [OH-] + [Cl-]5.水电离的H +和OH -守恒
Na 2S溶液:[OH - ]= [HS- ] +2[H 2S]+ [H + ]
Na2CO3 [OH - ]= [HCO3- ] + 2 [H2CO3 ]+[H + ]
Na3PO4:: [OH - ]= [HPO42- ]+ 2[H2PO4- ] +3[H3PO4 ] +[H+]
五、盐类水解的应用(三)判断溶液中离子能否大量共存。当有弱碱阳离子和弱酸阴离子之间能发出双水解,则不能在溶液中大量共存。
如:Al3+、 Fe3+与HCO3-、CO32-、SiO32-等,不能在溶液中大量共存。
Al2S3、CaC2、Mg3N2、 在水溶液中发生双水解,只能用干法制取。(四)解释某些实验现象及在生产、生活中的应用
1.配制易水解的盐溶液时,需考虑抑制盐的水解,如在配制强酸弱碱盐溶液时,需滴加几滴对应的强酸,来抑制盐的水解。 思考:热水配制CuCl2溶液,应该出现什么现象?热水:升温能够促进水解实验现象:溶液出现浑浊原因:CuCl2+2H2O Cu(OH)2+2HCl-Q
或Cu2++2H2O Cu(OH)2+2H+ -Q配制CuCl2溶液,为防止出现浑浊,应加少量的
_______ 稀盐酸思考:用热水配制硫酸铁溶液时,为什么会产生混浊?怎样才能用热水配制出澄清的硫酸铁溶液?[小结]:配制易水解的金属盐溶液应加少量的______________配制Fe2(SO4)3溶液,要先加少量的稀H2SO4。 同种酸。2.某些试剂的实验室存放,需要考虑盐的水解。
如:Na2CO3、Na2SiO3等水解呈碱性,不能存 放在磨口玻璃塞的试剂瓶中;
NH4F水解应会产生HF,会腐蚀玻璃 , 不能存放在玻璃瓶中。3.加热蒸发可水解的盐溶液 例:把FeCl3溶液蒸干灼烧,最后得到的固体产物是Fe2O3.为什么? FeCl3+3H2O Fe(OH)3+3HCl⑴加热促进水解 ⑵HCl挥发思考:Al2(SO4)3溶液加热蒸发后得到固体是什么?尽管Al3+水解生成Al(OH)3和H2SO4,但由于H2SO4是高沸点酸,不易挥发,加热最终只是把水蒸去,因此仍得Al2(SO4)3固体。3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O4.某些活泼金属与水解显酸性盐溶液的反应【实验】 把Mg粉放入NH4Cl溶液实验现象:剧烈反应有气体放出,有刺激性气味[思考]检验NH3方法?检验结果:湿润的红色的石蕊试纸变蓝,说明刺激性气味的气体是NH3 。用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒NH4++H2O NH3?H2O + H+Mg+ 2H+ = Mg2+ + H2↑5.热纯碱水去油污能力强: 在碱性条件下去油污能力强[生活常识] 为什么用肥皂洗衣服时用温水比冷水洗得干净一些? 肥皂主要成分:硬脂酸钠(C17H35COONa)
硬脂酸(C17H35COOH)是一种一元弱酸C17H35COO-+H2O C17H35COOH+OH- -Q农业谚语 :
“灰混粪,粪混灰,灰粪相混损肥分。” 思考:为什么会损肥分? [实验] 饱和K2CO3(草木灰的主要成分)溶液和NH4Cl晶体混合 6.草木灰不宜与铵态氮肥混合施用: 草木灰的成分:K2CO3,水解呈碱性铵态氮肥——铵盐,水解呈酸性。
NH4++H2O NH3·H2O+ H+, 混施后,OH-与H+中和成水,使两种盐的水解平衡强烈地向右移动,以至生成大量的NH3·H2O,进一步分解成NH3逸出了,从而降低了肥效。灭火器原理塑料筒里面放入的什么是药品?外筒放入的是什么药品?泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。 药品:Al2(SO4)3溶液、NaHCO3溶液7.泡沫灭火器的原理应用双水解Al3++3H2O Al(OH)3+3H+,
HCO3-+H2O H2CO3 +OH-,
总式:Al3++3HCO3- = Al(OH)3↓+3CO2↑;当矾与碱放入水中时,它们之间会发生化学变化,产生大量CO2和絮状物。与面合在一起时,絮状物Al(OH)3与面产生膜状物,将CO2气体包住。油条放入热油锅中, CO2受热膨胀,使油条胀大。这就是炸油条要放矾、碱的原因。但其间的配比一定要掌握好,明矾多了,水解产生的Al(OH)3就多,使油条遇热产生硬、脆、多泡现象,而且耗油量大。若碱放多了,则会使油条颜色发黄,增加其苦涩味。矾与碱之比以2.5:3.5较为合适。 炸油条或油饼时必须要放明矾与纯碱8.选择制备盐的途径时,需考虑盐的水解。如制备Al2S3时,因无法在溶液中制取,会完全水解,只能由干法直接反应制取。
加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入HCl气体,以抑制FeCl3的水解,才能得到其固体。
练:要制得较纯的FeS沉淀,在FeCl2溶液中加入的试剂是( )
A.Na2S B.NaHS C.H2S D.(NH4)2S 9.溶液中,某些离子的除杂,需考虑盐的水解。
练:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( )
A.氧化镁 B.氢氧化钠
C.碳酸钠 D. 碳酸镁 9.鉴别溶液时可考虑盐类的水解
如:鉴别NaCI和NaCN两种溶液练习:1、盐碱地(含较多NaCl、Na2CO3)不利于作物生长,产生碱性的原因(用离子方程式表示)_______________________, 施用适量石膏可降低盐碱地的碱性,表示其反应原理的离子方程式__________________. CO32-+H2O HCO3-+OH-Ca2+ + CO32- = CaCO3↓2、(上海高考)在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质的固体的是( )
A. AlCl3 B. NaHCO3 C. MgSO4 D. KMnO4C3、SnCl2溶液易水解,实验室应如何保存?实验室保存SnCl2是向其中加入少量的稀盐酸
(抑制水解)和少量的金属锡(+2价的锡
不稳定,这样可以防止被氧化) Sn4+ + Sn = 2Sn2+
SnCl2+2H2O Sn(OH)2+2HCl4、下列溶液加入金属镁可以产生H2的是( )
CH3COOH B. NaHCO3
C. NH4Cl D. NaClOAC5、下列离子方程式正确的是( )
A. Fe3++3H2O Fe(OH)3↓+3H+
B. NH4++H2O = NH3·H2O+ H+
C. CO32-+H2O H2CO3+OH-
D. HCO3-+H2O H2CO3 +OH-D6、为什么不能从溶液中直接制取Al2S3?因Al3+、S2-均能水解,Al3+水解使溶液呈酸性,S2-水解使溶液呈碱性。如Al3+、S2-在同一溶液中,它们将相互促进水解而使水解完全,从而得不到Al2S3。 再见练习:
1、将AlCl3溶液加热蒸干之后灼烧,最后得到的固体物质是什么?
2、实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是
A、防止硫酸铁分解 B、抑制硫酸铁水解
C、提高硫酸铁的溶解度 D、提高溶液的PH值
