第三节盐类的水解(第2课时)[上学期]
文档属性
| 名称 | 第三节盐类的水解(第2课时)[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-10-26 19:16:00 | ||
图片预览


文档简介
(共9张PPT)
第三章 电离平衡
第三节 盐类的水解 (第2课时)
课件制作
合川中学 张荣礼
三、盐类的水解离子方程式的书写
1.找出弱的离子,直接书写。
例:写出NaHCO3和Al2(SO4)3水解的离子方程式
2.水解反应是可逆反应,反应物与产物间用“ ”。
3.水解程度通常很小,产物一般不能用“↓”或“↑”。
4.多元弱酸正盐分步水解,第一步水解远大于第二步;其水解离子方程式可以只写第一步。但第一步与第二步水解的离子方程式不能合并。
例:写出Na2CO3水解的离子方程式
5.多元弱碱盐的水解,用总的水解离子方程式表示。
例:写出AlCl3和CuSO4水解的离子方程式
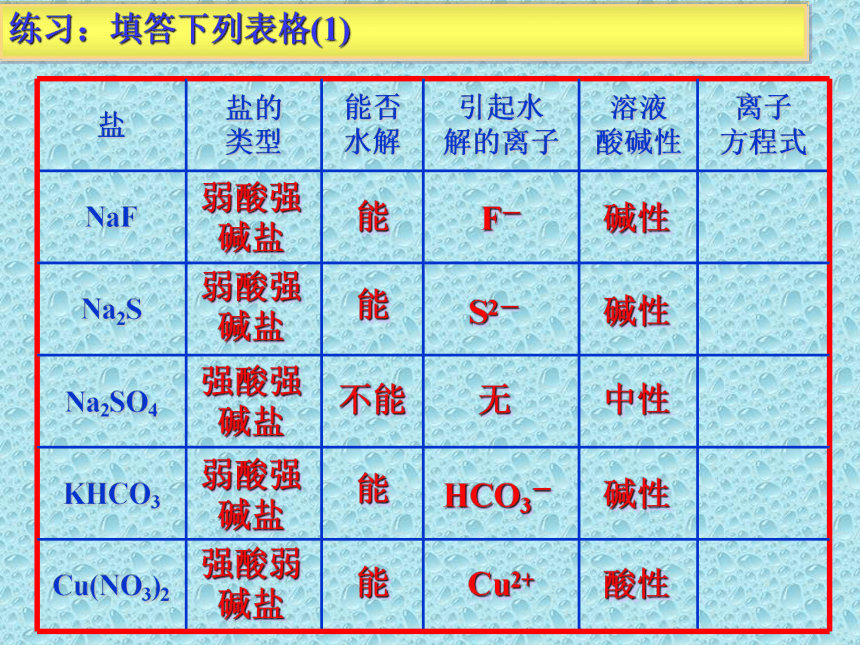
练习:填答下列表格(1)
盐 盐的 类型 能否 水解 引起水 解的离子 溶液 酸碱性 离子 方程式
NaF
Na2S
Na2SO4
KHCO3
Cu(NO3)2
弱酸强碱盐
弱酸强碱盐
弱酸强碱盐
强酸强碱盐
强酸弱碱盐
能
能
能
能
不能
F-
S2-
HCO3-
Cu2+
无
碱性
碱性
碱性
中性
酸性
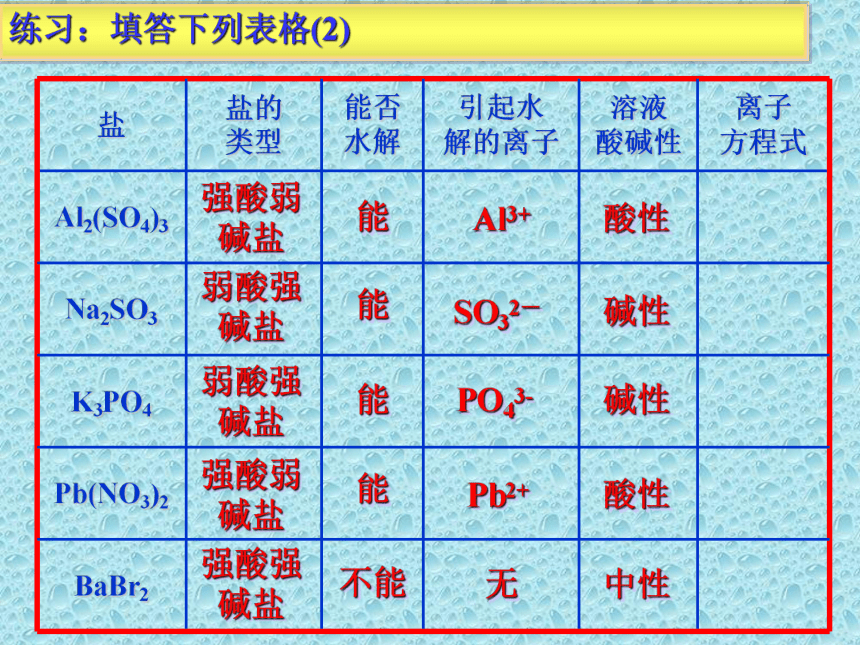
练习:填答下列表格(2)
盐 盐的 类型 能否 水解 引起水 解的离子 溶液 酸碱性 离子 方程式
Al2(SO4)3
Na2SO3
K3PO4
Pb(NO3)2
BaBr2
强酸弱碱盐
弱酸强碱盐
强酸弱碱盐
弱酸强碱盐
强酸强碱盐
能
能
能
不能
能
Al3+
SO32-
Pb2+
无
PO43-
酸性
碱性
酸性
碱性
中性
四、影响盐类水解的因素
1.内因:
盐类本身的性质
2.条件:
(1)温度
温度越高→水解程度越大
原因:
中和(放热)
酸 + 碱 盐 + 水
水解(吸热)
(2)浓度
浓度越稀→水解程度越大
例:NH4++H2O NH3·H2O+H+
(3)酸、碱度
练习:在0.5mol/LAlCl3溶液中存在如下平衡: 请根据条件变化,填答下列表格。
Al3++3H2O Al(OH)3+3H+
条件变化 移动方向 N(H+) C(H+) PH
加热
加水
加HCl(浓)
加NaOH(s)
加NaF(s)
加NH4Cl(s)
正移
增大
增大
减小
正移
增大
减小
增大
逆移
增大
增大
减小
正移
减小
减小
增大
正移
减小
减小
增大
逆移
增大
增大
减小
思考:在Na3PO4晶体中,n(Na+) :n(PO43-)=
3:1
在Na3PO4溶液中,n(Na+) :n(PO43-) 3:1
>
思考:在Na3PO4和Na2SO4溶液中各有多少种离子?是哪些离子?
答:在Na3PO4溶液中各有6种离子; 其离子为:Na+、PO43-、HPO42-、H2PO4-、H+、OH-。
在Na2SO4溶液中各有4种离子; 其离子为:Na+、SO42-、H+、OH-。
浓度均为0.1mol/LNH4Cl、NH4HSO4、CH3COONH4溶液中铵根离子浓度由小到大的顺序为是:
CH3COONH4、NH4Cl、NH4HSO4 ?v{|剉4l銐(�,{2�?鰁 _c
第三章 电离平衡
第三节 盐类的水解 (第2课时)
课件制作
合川中学 张荣礼
三、盐类的水解离子方程式的书写
1.找出弱的离子,直接书写。
例:写出NaHCO3和Al2(SO4)3水解的离子方程式
2.水解反应是可逆反应,反应物与产物间用“ ”。
3.水解程度通常很小,产物一般不能用“↓”或“↑”。
4.多元弱酸正盐分步水解,第一步水解远大于第二步;其水解离子方程式可以只写第一步。但第一步与第二步水解的离子方程式不能合并。
例:写出Na2CO3水解的离子方程式
5.多元弱碱盐的水解,用总的水解离子方程式表示。
例:写出AlCl3和CuSO4水解的离子方程式
练习:填答下列表格(1)
盐 盐的 类型 能否 水解 引起水 解的离子 溶液 酸碱性 离子 方程式
NaF
Na2S
Na2SO4
KHCO3
Cu(NO3)2
弱酸强碱盐
弱酸强碱盐
弱酸强碱盐
强酸强碱盐
强酸弱碱盐
能
能
能
能
不能
F-
S2-
HCO3-
Cu2+
无
碱性
碱性
碱性
中性
酸性
练习:填答下列表格(2)
盐 盐的 类型 能否 水解 引起水 解的离子 溶液 酸碱性 离子 方程式
Al2(SO4)3
Na2SO3
K3PO4
Pb(NO3)2
BaBr2
强酸弱碱盐
弱酸强碱盐
强酸弱碱盐
弱酸强碱盐
强酸强碱盐
能
能
能
不能
能
Al3+
SO32-
Pb2+
无
PO43-
酸性
碱性
酸性
碱性
中性
四、影响盐类水解的因素
1.内因:
盐类本身的性质
2.条件:
(1)温度
温度越高→水解程度越大
原因:
中和(放热)
酸 + 碱 盐 + 水
水解(吸热)
(2)浓度
浓度越稀→水解程度越大
例:NH4++H2O NH3·H2O+H+
(3)酸、碱度
练习:在0.5mol/LAlCl3溶液中存在如下平衡: 请根据条件变化,填答下列表格。
Al3++3H2O Al(OH)3+3H+
条件变化 移动方向 N(H+) C(H+) PH
加热
加水
加HCl(浓)
加NaOH(s)
加NaF(s)
加NH4Cl(s)
正移
增大
增大
减小
正移
增大
减小
增大
逆移
增大
增大
减小
正移
减小
减小
增大
正移
减小
减小
增大
逆移
增大
增大
减小
思考:在Na3PO4晶体中,n(Na+) :n(PO43-)=
3:1
在Na3PO4溶液中,n(Na+) :n(PO43-) 3:1
>
思考:在Na3PO4和Na2SO4溶液中各有多少种离子?是哪些离子?
答:在Na3PO4溶液中各有6种离子; 其离子为:Na+、PO43-、HPO42-、H2PO4-、H+、OH-。
在Na2SO4溶液中各有4种离子; 其离子为:Na+、SO42-、H+、OH-。
浓度均为0.1mol/LNH4Cl、NH4HSO4、CH3COONH4溶液中铵根离子浓度由小到大的顺序为是:
CH3COONH4、NH4Cl、NH4HSO4 ?v{|剉4l銐(�,{2�?鰁 _c
