盐类水解1[上学期]
图片预览





文档简介
课件13张PPT。盐类水解问题2、判断下列盐溶液的酸碱性。 ( NH4)2SO4 FeSO4 KNO3 NaHCO3
酸性碱性酸性 中性一、盐类水解规律有弱才水解,谁弱谁水解,谁强显谁性。3、CH3COOH溶液与NaOH溶液反应,若反应后溶液PH值为7,那么:
A、 CH3COOH与NaOH的质量相等
B、CH3COOH与NaOH的物质的量相等
C、NaOH过量
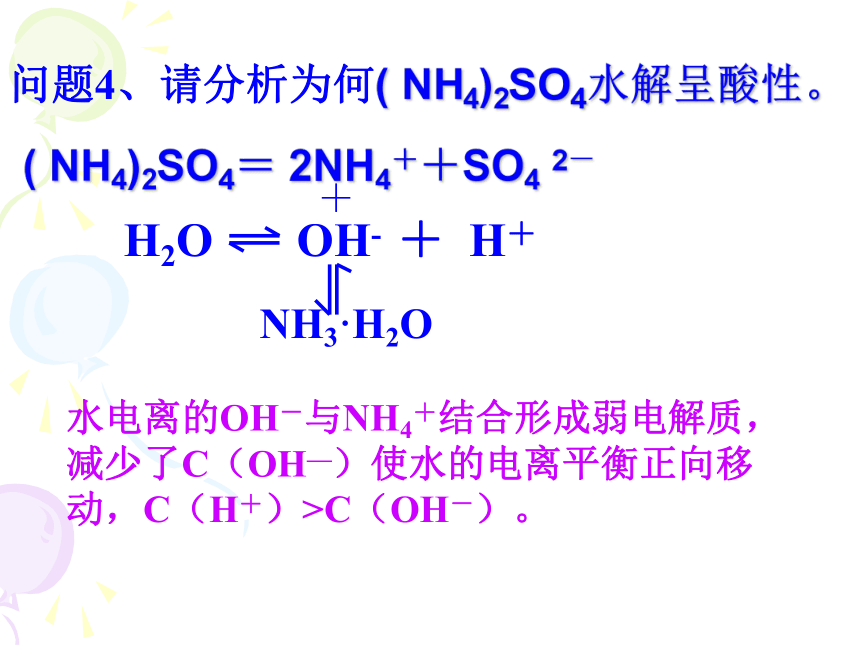
D、CH3COOH过量( NH4)2SO4= 2NH4++SO4 2-+NH3·H2O水电离的OH-与NH4+结合形成弱电解质,减少了C(OH—)使水的电离平衡正向移动,C(H+)>C(OH-)。问题4、请分析为何( NH4)2SO4水解呈酸性。二、盐类水解的实质在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH- 结合生成弱电解质的反应.叫做盐类的水解。水解的条件:生成弱电解质。水解的实质:破坏了水的电离平衡。水解反应与中和反应的关系:中和水解对概念的理解想一想:水解反应过程是吸热反应还是放热反应呢?5、下列物质中的阴离子使水的电离平衡正向移动的是:A、NaCl B、NH4Cl C、AlCl3 D、CH3COOK6、下列方程式中正确的盐类水解的离子方程式的是:-----不能标分步1.用可逆符号:
2.多元弱酸根离子 水解.
3.对于沉淀气体符号三、书写离子方程式的注意事项问题7.影响盐类水解有哪些因素?
填表:CH3COONa溶液中存在以下水解平衡:CH3COONa+H2O CH3COOH+NaOH,改变下列条件,填写变化情况:
向右增大增大向右减小减小向右减小增大向右减小不一定向左向左增大增大增大减小向右减小减小四、影响盐类水解的因素1、内因:盐类的组成:能建立水解平衡的盐一定有“弱”离子,且产生的酸、碱至少有一种“弱” 。
① 温度:
② 浓度:
③外加酸碱盐的影响稀释促进水解升温促进水解2、外因:符合勒夏特列原理8:向盛有碳酸钠溶液的试管中滴入2滴酚酞试液振荡, 现象是 ,原因用离子方程式表示是 。
然后对溶液加热,现象是: 。最后向溶液中再滴入过量的BaCl2溶液, 现象为 ,原因用离子方程式表示是 。溶液变红产生白色沉淀,且红色褪去Ba2++CO32-=BaCO3↓溶液红色变深五、盐类水解的应用1.分析盐溶液的酸碱性;
2.比较盐溶液中离子浓度大小;
练习9、0.1mol/l下列溶液PH值由大到小的顺序是 _________________
①H2SO4 ② NH3.H2O ③ NaOH ④NH4Cl ⑤NaCl ⑥CH3COONa ⑦ HCl ⑧ CH3COOH ⑨Ba(OH)2
10、将10mL0.1mol/L氨水和10mL0.1mol/L盐酸混合后, 溶液里各种离子物质的量浓度的关系是 ( )
A.C(Cl-)+C(OH-)=C(NH4+)+C(H+)
B. C(Cl-)> C(NH4+)> C(H+) > C(OH-)
C.C (H+) > C(OH-)>C (Cl--)>C(NH4+)
D. C(Cl-)> C(H+) >C (NH4+)>C (OH-)AB⑨>③>②>⑥>⑤>④>⑧>⑦>①3.解释某些盐(如FeCl3、明矾等)作净水剂的原理。
?4.某些溶液的配置和保存。
例:如何用热水配制澄清的FeCl3、CuSO4、Na2SiO3
溶液?
5.分析某些盐的固体不能用蒸发方法结晶获得的原因。( 如AlCl3 FeCl3等)
6.分析某些活泼金属(如镁)与强酸弱碱盐(如NH4Cl)溶液反应产生H2的原因。
7.某些肥料不宜混施的原因。
(如草木灰(含K2CO3)不能和铵态氮肥混和使用)
10:推断现象(或产物)并解释原因:
(1)浓NH4Cl溶液中加入Mg条;
(2)FeCl3溶液加热蒸干灼烧后最终产物是什么?
(3)Al2(SO4)3溶液加热蒸干后最终产物是什么?
(4)少量Mg(OH)2不溶于水,溶于浓NH4Cl溶液。
(5)胃酸过多的人吃少量小苏打可中和胃酸。
A、 CH3COOH与NaOH的质量相等
B、CH3COOH与NaOH的物质的量相等
C、NaOH过量
D、CH3COOH过量( NH4)2SO4= 2NH4++SO4 2-+NH3·H2O水电离的OH-与NH4+结合形成弱电解质,减少了C(OH—)使水的电离平衡正向移动,C(H+)>C(OH-)。问题4、请分析为何( NH4)2SO4水解呈酸性。二、盐类水解的实质在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH- 结合生成弱电解质的反应.叫做盐类的水解。水解的条件:生成弱电解质。水解的实质:破坏了水的电离平衡。水解反应与中和反应的关系:中和水解对概念的理解想一想:水解反应过程是吸热反应还是放热反应呢?5、下列物质中的阴离子使水的电离平衡正向移动的是:A、NaCl B、NH4Cl C、AlCl3 D、CH3COOK6、下列方程式中正确的盐类水解的离子方程式的是:-----不能标分步1.用可逆符号:
2.多元弱酸根离子 水解.
3.对于沉淀气体符号三、书写离子方程式的注意事项问题7.影响盐类水解有哪些因素?
填表:CH3COONa溶液中存在以下水解平衡:CH3COONa+H2O CH3COOH+NaOH,改变下列条件,填写变化情况:
向右增大增大向右减小减小向右减小增大向右减小不一定向左向左增大增大增大减小向右减小减小四、影响盐类水解的因素1、内因:盐类的组成:能建立水解平衡的盐一定有“弱”离子,且产生的酸、碱至少有一种“弱” 。
① 温度:
② 浓度:
③外加酸碱盐的影响稀释促进水解升温促进水解2、外因:符合勒夏特列原理8:向盛有碳酸钠溶液的试管中滴入2滴酚酞试液振荡, 现象是 ,原因用离子方程式表示是 。
然后对溶液加热,现象是: 。最后向溶液中再滴入过量的BaCl2溶液, 现象为 ,原因用离子方程式表示是 。溶液变红产生白色沉淀,且红色褪去Ba2++CO32-=BaCO3↓溶液红色变深五、盐类水解的应用1.分析盐溶液的酸碱性;
2.比较盐溶液中离子浓度大小;
练习9、0.1mol/l下列溶液PH值由大到小的顺序是 _________________
①H2SO4 ② NH3.H2O ③ NaOH ④NH4Cl ⑤NaCl ⑥CH3COONa ⑦ HCl ⑧ CH3COOH ⑨Ba(OH)2
10、将10mL0.1mol/L氨水和10mL0.1mol/L盐酸混合后, 溶液里各种离子物质的量浓度的关系是 ( )
A.C(Cl-)+C(OH-)=C(NH4+)+C(H+)
B. C(Cl-)> C(NH4+)> C(H+) > C(OH-)
C.C (H+) > C(OH-)>C (Cl--)>C(NH4+)
D. C(Cl-)> C(H+) >C (NH4+)>C (OH-)AB⑨>③>②>⑥>⑤>④>⑧>⑦>①3.解释某些盐(如FeCl3、明矾等)作净水剂的原理。
?4.某些溶液的配置和保存。
例:如何用热水配制澄清的FeCl3、CuSO4、Na2SiO3
溶液?
5.分析某些盐的固体不能用蒸发方法结晶获得的原因。( 如AlCl3 FeCl3等)
6.分析某些活泼金属(如镁)与强酸弱碱盐(如NH4Cl)溶液反应产生H2的原因。
7.某些肥料不宜混施的原因。
(如草木灰(含K2CO3)不能和铵态氮肥混和使用)
10:推断现象(或产物)并解释原因:
(1)浓NH4Cl溶液中加入Mg条;
(2)FeCl3溶液加热蒸干灼烧后最终产物是什么?
(3)Al2(SO4)3溶液加热蒸干后最终产物是什么?
(4)少量Mg(OH)2不溶于水,溶于浓NH4Cl溶液。
(5)胃酸过多的人吃少量小苏打可中和胃酸。
