微粒浓度大小比较:[上学期]
文档属性
| 名称 | 微粒浓度大小比较:[上学期] | 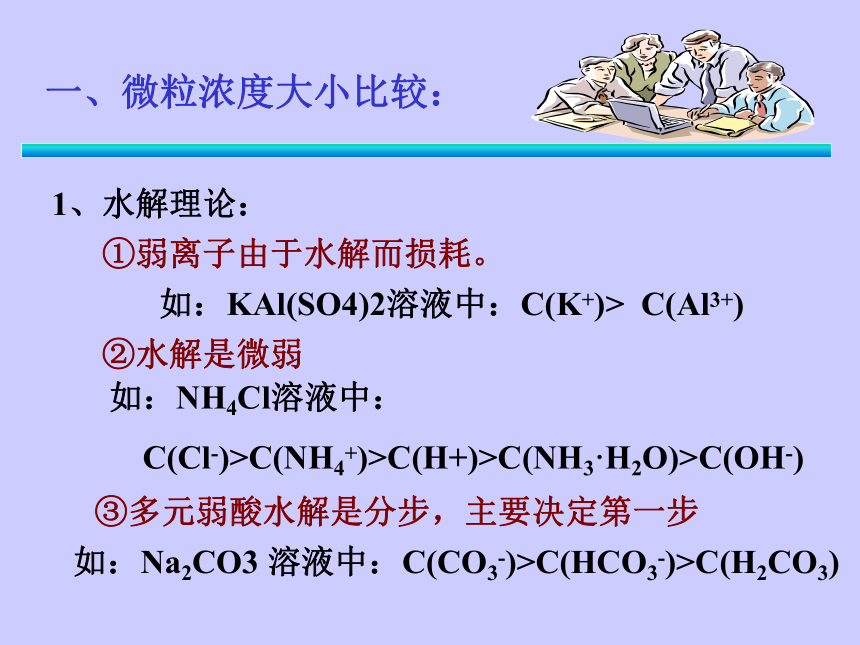 | |
| 格式 | rar | ||
| 文件大小 | 402.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-10-30 17:03:42 | ||
图片预览





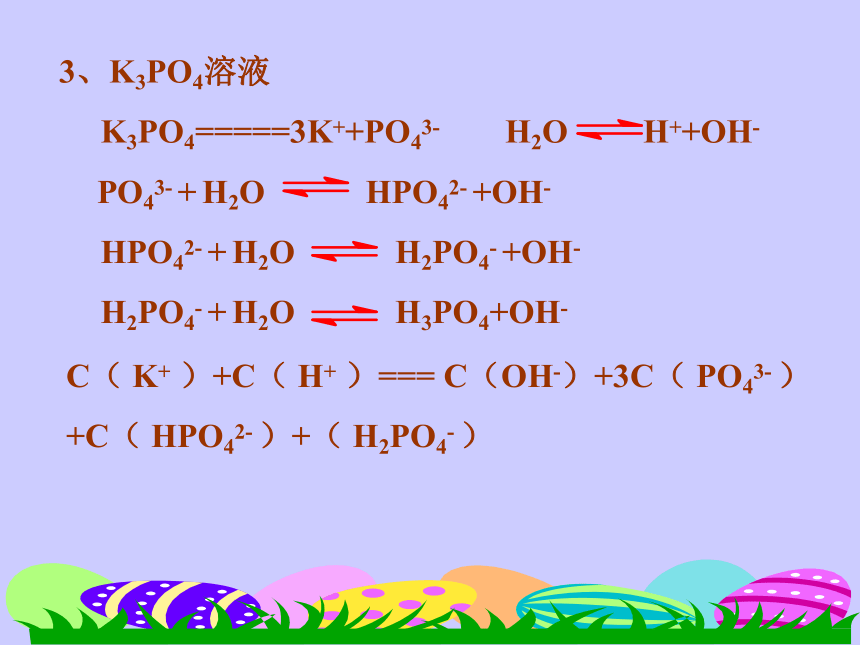
文档简介
课件13张PPT。一、微粒浓度大小比较:1、水解理论:①弱离子由于水解而损耗。如:KAl(SO4)2溶液中:C(K+)> C(Al3+)②水解是微弱③多元弱酸水解是分步,主要决定第一步如:NH4Cl溶液中:
C(Cl-)>C(NH4+)>C(H+)>C(NH3·H2O)>C(OH-)如:Na2CO3 溶液中:C(CO3-)>C(HCO3-)>C(H2CO3)一、微粒浓度大小比较:2、电离理论:②多元弱酸电离是分步,主要决定第一步
①弱电解质电离是微弱的如: NH3·H2O 溶液中:
C(NH3·H2O)>C(OH-) >C(NH4+) >C(H+)
如:H2S溶液中:
C(H2S)>C(H+)>C(HS-)>C(S2-)>C(OH-)3、电荷平衡如:NH4Cl溶液中
阳离子:NH4+ H+
阴离子:Cl- OH-
n(NH4+)+n(H+)=== n(Cl-)+n(OH-)一、微粒浓度大小比较:溶液中阴离子和阳离子所带的电荷总数相等。C(NH4+)+C(H+)=== C(Cl-)+C(OH-)阳离子: Na+ 、H+
阴离子: OH- 、 S2- 、 HS-一、微粒浓度大小比较:C( Na+ )+C( H+ )==C( OH- )+2C( S2-)+C( HS- )一、微粒浓度大小比较:4、物料平衡某原子的原始的浓度等于该元素在溶液中的各种形式存在微粒的浓度和。因此:C(Na+) == 2[C(S2-) + C(HS-) + C(H2S)]3、K3PO4溶液
K3PO4=====3K++PO43- H2O H++OH-
PO43- + H2O HPO42- +OH-
HPO42- + H2O H2PO4- +OH-
H2PO4- + H2O H3PO4+OH-C( K+ )+C( H+ )=== C(OH-)+3C( PO43- )
+C( HPO42- )+( H2PO4- )练习三、离子不能共存的类型:1、因生成沉淀而不能共存:Ag+ + Cl- = AgCl↓
2、因生成气体而不能共存:2H+ + S2- = H2S ↑
3、因生成难电离物质而不能共存:H+ + ClO- = HClO
4、因氧化还原反应而不能共存:
3Fe2+ + 4H+ + NO 3 - = 3Fe3+ + NO↑ + 2H2O
5、因双水解而不能共存:
Al3+ +3HCO3- ===Al(OH)3 ↓+3 CO2 ↑练习1、 在强酸性溶液中能大量共存,并且溶液为无色
透明的离子组是( )
A、NH4+、Al3+、SO42-、NO3-
B、K+、Na+、AlO2-、NO3-
C、K+、Na+、MnO4-、SO42-
D、Na+、K+、NO3-、HSO3-AC练习2、在水电离出的C(H+)=1×10-14mol/L的溶液中,
一定能大量共存的离子组是( )
A、K+、Fe2+、SO32-、MnO4-
B、Na+、Cl-、NO3-、SO42-
C、Al3+、NH4+、Cl-、SO42-、
D、Na+、AlO2-、Br-、Cl-B四、离子方程式书写错误的10种类型:1、没写“↑”:2H+ + S2- = H2S
2、没写“↓”:Ag+ + Cl- = AgCl
3、没写条件:MnO2 + 4H+ + 2Cl- = Mn2+ + Cl2 ↑+ 2H2O
4、没配平:Fe2+ + Cl2 =Fe3+ + 2Cl-
5、该分解的没分解:2H+ + CO32- = H2CO3
6、不该分解的分解了:HCO3- + H2O H2O + CO2↑ + OH-
7、不符合实际情况的:Ca2+ + H2O + CO2 =CaCO3 ↓ + 2H+
8、该写离子的写分子式:CaCl2 + CO32- = CaCO3 ↓ + 2Cl-
9、该写分子式的写离子:AlCl3中加氨水
Al3+ + 3OH- = Al(OH)3 ↓
10、“=”与“ ”乱用:NH3·H2O = NH4+ + OH-
NH4Cl NH4+ + Cl-练习下列离子方程式中,书写正确的是( )
A、Na2CO3溶液和稀H2SO4
Na2CO3 + 2H+ = 2Na+ +CO2 ↑+ H2O
B、Ba(OH)2溶液和稀H2SO4
Ba2+ +2OH- + 2H+ + SO42- = BaSO4 ↓+ 2H2O
C、NH4Cl和Ca(OH)2固体混研
NH4+ + OH- = NH3 ↑+ H2O
D、H2S气体通入CuCl2溶液中
Cu2+ + H2S = CuS ↓+ 2H+BD
C(Cl-)>C(NH4+)>C(H+)>C(NH3·H2O)>C(OH-)如:Na2CO3 溶液中:C(CO3-)>C(HCO3-)>C(H2CO3)一、微粒浓度大小比较:2、电离理论:②多元弱酸电离是分步,主要决定第一步
①弱电解质电离是微弱的如: NH3·H2O 溶液中:
C(NH3·H2O)>C(OH-) >C(NH4+) >C(H+)
如:H2S溶液中:
C(H2S)>C(H+)>C(HS-)>C(S2-)>C(OH-)3、电荷平衡如:NH4Cl溶液中
阳离子:NH4+ H+
阴离子:Cl- OH-
n(NH4+)+n(H+)=== n(Cl-)+n(OH-)一、微粒浓度大小比较:溶液中阴离子和阳离子所带的电荷总数相等。C(NH4+)+C(H+)=== C(Cl-)+C(OH-)阳离子: Na+ 、H+
阴离子: OH- 、 S2- 、 HS-一、微粒浓度大小比较:C( Na+ )+C( H+ )==C( OH- )+2C( S2-)+C( HS- )一、微粒浓度大小比较:4、物料平衡某原子的原始的浓度等于该元素在溶液中的各种形式存在微粒的浓度和。因此:C(Na+) == 2[C(S2-) + C(HS-) + C(H2S)]3、K3PO4溶液
K3PO4=====3K++PO43- H2O H++OH-
PO43- + H2O HPO42- +OH-
HPO42- + H2O H2PO4- +OH-
H2PO4- + H2O H3PO4+OH-C( K+ )+C( H+ )=== C(OH-)+3C( PO43- )
+C( HPO42- )+( H2PO4- )练习三、离子不能共存的类型:1、因生成沉淀而不能共存:Ag+ + Cl- = AgCl↓
2、因生成气体而不能共存:2H+ + S2- = H2S ↑
3、因生成难电离物质而不能共存:H+ + ClO- = HClO
4、因氧化还原反应而不能共存:
3Fe2+ + 4H+ + NO 3 - = 3Fe3+ + NO↑ + 2H2O
5、因双水解而不能共存:
Al3+ +3HCO3- ===Al(OH)3 ↓+3 CO2 ↑练习1、 在强酸性溶液中能大量共存,并且溶液为无色
透明的离子组是( )
A、NH4+、Al3+、SO42-、NO3-
B、K+、Na+、AlO2-、NO3-
C、K+、Na+、MnO4-、SO42-
D、Na+、K+、NO3-、HSO3-AC练习2、在水电离出的C(H+)=1×10-14mol/L的溶液中,
一定能大量共存的离子组是( )
A、K+、Fe2+、SO32-、MnO4-
B、Na+、Cl-、NO3-、SO42-
C、Al3+、NH4+、Cl-、SO42-、
D、Na+、AlO2-、Br-、Cl-B四、离子方程式书写错误的10种类型:1、没写“↑”:2H+ + S2- = H2S
2、没写“↓”:Ag+ + Cl- = AgCl
3、没写条件:MnO2 + 4H+ + 2Cl- = Mn2+ + Cl2 ↑+ 2H2O
4、没配平:Fe2+ + Cl2 =Fe3+ + 2Cl-
5、该分解的没分解:2H+ + CO32- = H2CO3
6、不该分解的分解了:HCO3- + H2O H2O + CO2↑ + OH-
7、不符合实际情况的:Ca2+ + H2O + CO2 =CaCO3 ↓ + 2H+
8、该写离子的写分子式:CaCl2 + CO32- = CaCO3 ↓ + 2Cl-
9、该写分子式的写离子:AlCl3中加氨水
Al3+ + 3OH- = Al(OH)3 ↓
10、“=”与“ ”乱用:NH3·H2O = NH4+ + OH-
NH4Cl NH4+ + Cl-练习下列离子方程式中,书写正确的是( )
A、Na2CO3溶液和稀H2SO4
Na2CO3 + 2H+ = 2Na+ +CO2 ↑+ H2O
B、Ba(OH)2溶液和稀H2SO4
Ba2+ +2OH- + 2H+ + SO42- = BaSO4 ↓+ 2H2O
C、NH4Cl和Ca(OH)2固体混研
NH4+ + OH- = NH3 ↑+ H2O
D、H2S气体通入CuCl2溶液中
Cu2+ + H2S = CuS ↓+ 2H+BD
