广东 选修4 第三章 第三节 盐类的水解 第3、4课时[下学期]
文档属性
| 名称 | 广东 选修4 第三章 第三节 盐类的水解 第3、4课时[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 171.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-06-11 00:00:00 | ||
图片预览






文档简介
课件24张PPT。§ 3-3
盐类水解一、盐的组成与盐溶液酸碱性的关系:二、盐溶液呈不同酸碱性的原因:盐类的水解1、盐类水解的概念:2、水解的条件:3、水解的实质:4、水解反应与中和反应的关系:5、水解的规律:有__才水解;无__不水解;
谁__谁水解;谁__显谁性;
越__越水解;都__双水解。弱弱强弱弱弱在溶液中盐电离出来的弱离子跟水所电离出来的H+ 或OH –结合生成弱电解质的反应,叫做盐类的水解。三、盐类水解方程式的书写:先找“弱”离子。
一般水解程度小,水解产物少。So常用“ ” ;不用“ == ”、“↑”、“↓”;
也不把生成物(如NH3·H2O、H2CO3)写成
分解产物的形式。
多元弱酸盐分步水解,但以第一步水解为主。
多元弱碱盐也分步水解,但常写成一步完成。
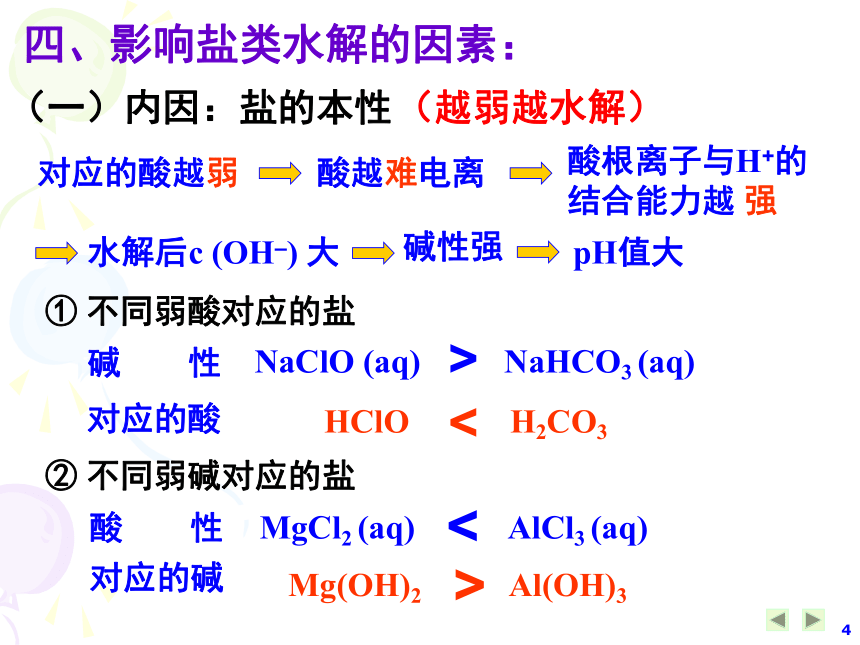
双水解进行到底的,用“ == ”、“↑”、“↓”。Al 3+ + 3HCO3– Al(OH)3↓+ 3CO2↑==四、影响盐类水解的因素:(一)内因:盐的本性(越弱越水解)对应的酸越弱酸越难电离水解后c (OH–) 大pH值大酸根离子与H+的
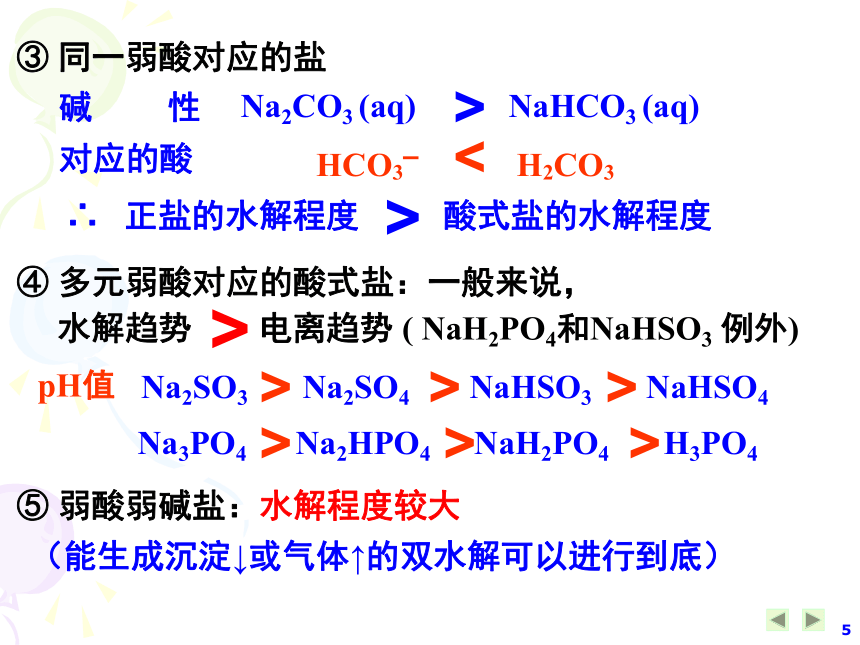
结合能力越 强碱性强① 不同弱酸对应的盐NaClO (aq) NaHCO3 (aq) MgCl2 (aq) AlCl3 (aq) 对应的酸HClO H2CO3<>碱 性② 不同弱碱对应的盐对应的碱酸 性Mg(OH)2 Al(OH)3<>③ 同一弱酸对应的盐Na2CO3 (aq) NaHCO3 (aq) 对应的酸HCO3– H2CO3<>碱 性∴ 正盐的水解程度 酸式盐的水解程度>④ 多元弱酸对应的酸式盐:一般来说,
水解趋势 电离趋势 ( NaH2PO4和NaHSO3 例外)Na3PO4 Na2HPO4 NaH2PO4 H3PO4Na2SO3 Na2SO4 NaHSO3 NaHSO4pH值> > >> > >⑤ 弱酸弱碱盐:水解程度较大>(能生成沉淀↓或气体↑的双水解可以进行到底)四、影响盐类水解的因素:(一)内因:盐的本性(越弱越水解)(二)外因:符合勒夏特列原理1、温度;2、浓度;3、外加酸碱盐的影响1、温度;∵水解反应是吸热反应,
∴升温 水解,降温 水解。促进抑制① CH3COONa的酚酞溶液加热后颜色:加深思考② 能否通过加热蒸发FeCl3溶液的方法得到其晶体?△H > 0升温,促进水解;最后只能得到Fe2O3固体同理,加热AlCl3、MgCl2的溶液也不能得到其晶体。(二)外因:2、浓度;加水稀释盐溶液,可以促进水解。
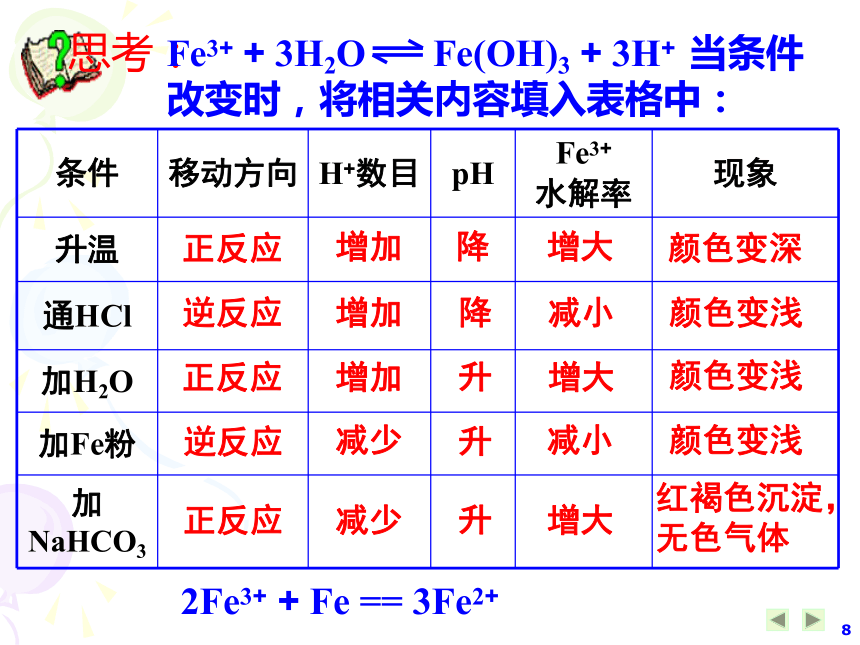
即盐的浓度越小,其水解程度越大。 (与电离过程相同)3、溶液的酸碱性:酸碱盐能够抑制或促进水解 由于盐水解一般会产生H+或OH –,所以凡是能够结合H+或OH –的物质,均会促进盐类的水解。配制FeCl3溶液需要注意什么问题?加入一定量的 ,抑制FeCl3的水解。思考HCl思考:Fe3+ + 3H2O Fe(OH)3 + 3H+ 当条件改变时,将相关内容填入表格中: 正反应增加降增大颜色变深逆反应正反应逆反应正反应增加增加减少减少降升升升减小增大减小增大颜色变浅颜色变浅颜色变浅红褐色沉淀,无色气体2Fe3+ + Fe == 3Fe2+ 五、盐类水解的应用:(考点)(一) 某些盐溶液的配制与保存:FeCl3溶液:加少量 ;FeCl2溶液:加少量 ;NH4F溶液 :铅容器或塑料瓶加相应的酸或碱稀盐酸稀盐酸和铁屑(二) 某些盐的用途(1)用盐作净化剂:明矾、FeCl3 等胶体可吸附不溶性杂质,起到净水作用。(二) 某些盐的用途(1)用盐作净化剂:明矾、FeCl3 等(2)用盐作杀菌剂: Na2FeO4、氯气和绿矾混合 等+6的铁具有强氧化性,其还原产物水解生成Fe(OH)3 胶体具有吸附性。(3)用盐作洗涤剂:Na2CO3、C17H35COONa 等加热,平衡右移,碱性增强,去污效果更好。(二) 某些盐的用途(4)肥料的混用普钙 [ Ca(H2PO4)2 ]、铵态氮肥不能与草木灰混用。K2CO3Ca(H2PO4)2 NH4+ K2CO3(酸性)(酸性)(碱性)NH3↑Ca3(PO4)2 ↓均降低肥效(5)Al2(SO4)3 和 NaHCO3溶液反应:用于泡沫灭火器Al 3+ + 3HCO3– Al(OH)3↓+ 3CO2↑==速度快
耗盐少(三) 判断溶液的酸碱性(相同温度、浓度下)NaHCO3 Na2CO3 NaClO CH3COONH4 Na2SO4 Na2HPO4 NaH2PO4 NaHSO3 NaHSO4 AgNO3(四) 某些盐的无水物,不能用蒸发溶液的方法制取AlCl3溶液蒸干Al(OH)3灼烧Al2O3MgCl2· 6H2OMg(OH)2MgO晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2Fe2O3Fe2O3Fe2(SO4)3Na2CO3Na2CO3CuSO4Na2SO4CaCO3(五) 解释某些现象或事实(1)某些活泼金属 or 不溶性盐溶于盐溶液产生气体Mg + FeCl3或:3Mg + 2Fe3+ + 6H2O 3Mg2+ + 2Fe(OH)3↓+ 3H2↑CaCO3 + NH4Cl(2)弱酸根离子与弱碱阳离子不能大量共存Al3+与AlO2–、CO32– 、 HCO3 –、S2–、HS–Fe3+与AlO2–、CO32– 、HCO3 –双水解 离子不能共存的类型:1、因生成沉淀而不能共存:Ag+ + Cl– == AgCl↓
2、因生成气体而不能共存:2H+ + S2– == H2S ↑
3、因生成难电离物质而不能共存:H+ + ClO– = HClO
4、因氧化还原反应而不能共存:
3Fe2+ + 4H+ + NO3– == 3Fe3+ + NO↑+ 2H2O
5、因双水解而不能共存: Al3+ + 3HCO3 – == Al (OH)3↓+ 3 CO2↑(五) 解释某些现象或事实(3)证明弱酸或弱碱的某些实验要考虑盐的水解。如:证明Cu(OH)2为弱碱,可用什么证明?可用CuCl2溶液能使蓝色石蕊试纸变红(显酸性)证明。(4)除去溶液中某些金属离子,可用加热法促进其
水解,使之转变为氢氧化物沉淀。如:不纯的KNO3溶液中常含杂质Fe3+,可用加热法除杂。(5)向MgCl2和FeCl3的混合溶液中加入 除去FeCl3 。MgO(6)制备纳米材料。如:用TiCl4制备TiO2P611、 在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
A、NH4+、Al3+、SO42–、NO3–
B、K+、Na+、AlO2– 、NO3–
C、K+、Na+、MnO4–、SO42–
D、Na+、K+、NO3–、HSO3–A2、在水电离出的c (H+) = 1×10 – 14mol/L的溶液中,一定能大量共存的离子组是:
A、K+、Fe2+ 、SO32– 、MnO4 –
B、Na+、Cl– 、NO3– 、SO42–
C、Al3+、NH4+、Cl– 、SO42– 、
D、Na+、AlO2–、Br –、Cl–B(六) 比较溶液中微粒浓度的大小:(考点)1、水解理论:① 弱离子由于水解而损耗。如:KAl(SO4)2 溶液中:c (K+) c (Al3+)② 水解是微弱③ 多元弱酸水解是分步,主要决定第一步 如:NH4Cl 溶液中:
c (Cl–) c (NH4+) c (H+) c (NH3·H2O) c (OH–)如:Na2CO3 溶液中:
c (CO3–) c (HCO3–) c (H2CO3)> > > > > > > 2、电离理论:② 多元弱酸电离是分步,主要决定第一步① 弱电解质电离是微弱的如: NH3 · H2O 溶液中:
c (NH3 · H2O) c (OH–) c (NH4+) c (H+) 如:H2S溶液中:
c (H2S) c (H+) c (HS–) c (S2–) c (OH–)(六) 比较溶液中微粒浓度的大小:(考点)> > > > > >>3、电荷守恒 如:NH4Cl 溶液中
阳离子: NH4+ H+
阴离子: Cl– OH–
n ( NH4+ ) + n ( H+ ) == n ( Cl– ) + n ( OH– )溶液中阴离子和阳离子所带的电荷总数相等。c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )(六) 比较溶液中微粒浓度的大小:(考点)3、电荷守恒溶液中阴离子和阳离子所带的电荷总数相等。(六) 比较溶液中微粒浓度的大小:(考点)阳离子: Na+ 、H+
阴离子: OH– 、 S2– 、 HS–又如:Na2S 溶液
Na2S == 2Na+ + S2– H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH– c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( S2–) + c ( HS– )4、物料守恒是指某一成份的原始浓度应该等于该成份在溶液中各种存在形式的浓度之和。(六) 比较溶液中微粒浓度的大小:(考点)如:a mol / L 的Na2CO3 溶液中
Na2CO3 == 2 Na+ + CO32– H2O H+ + OH–
CO32– + H2O HCO3– + OH–
HCO3– + H2O H2CO3 + OH– ∴ c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]c (Na+ ) = 2 a mol / Lc (CO32–) + c (HCO3–) + c (H2CO3) = a mol / L4、物料守恒是指某一成份的原始浓度应该等于该成份在溶液中各种存在形式的浓度之和。(六) 比较溶液中微粒浓度的大小:(考点)如:Na2S 溶液
Na2S == 2 Na+ + S2– H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH– 因此:c (Na+ ) == 2 [ c ( S2–) + c (HS–) + c (H2S) ]
盐类水解一、盐的组成与盐溶液酸碱性的关系:二、盐溶液呈不同酸碱性的原因:盐类的水解1、盐类水解的概念:2、水解的条件:3、水解的实质:4、水解反应与中和反应的关系:5、水解的规律:有__才水解;无__不水解;
谁__谁水解;谁__显谁性;
越__越水解;都__双水解。弱弱强弱弱弱在溶液中盐电离出来的弱离子跟水所电离出来的H+ 或OH –结合生成弱电解质的反应,叫做盐类的水解。三、盐类水解方程式的书写:先找“弱”离子。
一般水解程度小,水解产物少。So常用“ ” ;不用“ == ”、“↑”、“↓”;
也不把生成物(如NH3·H2O、H2CO3)写成
分解产物的形式。
多元弱酸盐分步水解,但以第一步水解为主。
多元弱碱盐也分步水解,但常写成一步完成。
双水解进行到底的,用“ == ”、“↑”、“↓”。Al 3+ + 3HCO3– Al(OH)3↓+ 3CO2↑==四、影响盐类水解的因素:(一)内因:盐的本性(越弱越水解)对应的酸越弱酸越难电离水解后c (OH–) 大pH值大酸根离子与H+的
结合能力越 强碱性强① 不同弱酸对应的盐NaClO (aq) NaHCO3 (aq) MgCl2 (aq) AlCl3 (aq) 对应的酸HClO H2CO3<>碱 性② 不同弱碱对应的盐对应的碱酸 性Mg(OH)2 Al(OH)3<>③ 同一弱酸对应的盐Na2CO3 (aq) NaHCO3 (aq) 对应的酸HCO3– H2CO3<>碱 性∴ 正盐的水解程度 酸式盐的水解程度>④ 多元弱酸对应的酸式盐:一般来说,
水解趋势 电离趋势 ( NaH2PO4和NaHSO3 例外)Na3PO4 Na2HPO4 NaH2PO4 H3PO4Na2SO3 Na2SO4 NaHSO3 NaHSO4pH值> > >> > >⑤ 弱酸弱碱盐:水解程度较大>(能生成沉淀↓或气体↑的双水解可以进行到底)四、影响盐类水解的因素:(一)内因:盐的本性(越弱越水解)(二)外因:符合勒夏特列原理1、温度;2、浓度;3、外加酸碱盐的影响1、温度;∵水解反应是吸热反应,
∴升温 水解,降温 水解。促进抑制① CH3COONa的酚酞溶液加热后颜色:加深思考② 能否通过加热蒸发FeCl3溶液的方法得到其晶体?△H > 0升温,促进水解;最后只能得到Fe2O3固体同理,加热AlCl3、MgCl2的溶液也不能得到其晶体。(二)外因:2、浓度;加水稀释盐溶液,可以促进水解。
即盐的浓度越小,其水解程度越大。 (与电离过程相同)3、溶液的酸碱性:酸碱盐能够抑制或促进水解 由于盐水解一般会产生H+或OH –,所以凡是能够结合H+或OH –的物质,均会促进盐类的水解。配制FeCl3溶液需要注意什么问题?加入一定量的 ,抑制FeCl3的水解。思考HCl思考:Fe3+ + 3H2O Fe(OH)3 + 3H+ 当条件改变时,将相关内容填入表格中: 正反应增加降增大颜色变深逆反应正反应逆反应正反应增加增加减少减少降升升升减小增大减小增大颜色变浅颜色变浅颜色变浅红褐色沉淀,无色气体2Fe3+ + Fe == 3Fe2+ 五、盐类水解的应用:(考点)(一) 某些盐溶液的配制与保存:FeCl3溶液:加少量 ;FeCl2溶液:加少量 ;NH4F溶液 :铅容器或塑料瓶加相应的酸或碱稀盐酸稀盐酸和铁屑(二) 某些盐的用途(1)用盐作净化剂:明矾、FeCl3 等胶体可吸附不溶性杂质,起到净水作用。(二) 某些盐的用途(1)用盐作净化剂:明矾、FeCl3 等(2)用盐作杀菌剂: Na2FeO4、氯气和绿矾混合 等+6的铁具有强氧化性,其还原产物水解生成Fe(OH)3 胶体具有吸附性。(3)用盐作洗涤剂:Na2CO3、C17H35COONa 等加热,平衡右移,碱性增强,去污效果更好。(二) 某些盐的用途(4)肥料的混用普钙 [ Ca(H2PO4)2 ]、铵态氮肥不能与草木灰混用。K2CO3Ca(H2PO4)2 NH4+ K2CO3(酸性)(酸性)(碱性)NH3↑Ca3(PO4)2 ↓均降低肥效(5)Al2(SO4)3 和 NaHCO3溶液反应:用于泡沫灭火器Al 3+ + 3HCO3– Al(OH)3↓+ 3CO2↑==速度快
耗盐少(三) 判断溶液的酸碱性(相同温度、浓度下)NaHCO3 Na2CO3 NaClO CH3COONH4 Na2SO4 Na2HPO4 NaH2PO4 NaHSO3 NaHSO4 AgNO3(四) 某些盐的无水物,不能用蒸发溶液的方法制取AlCl3溶液蒸干Al(OH)3灼烧Al2O3MgCl2· 6H2OMg(OH)2MgO晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2Fe2O3Fe2O3Fe2(SO4)3Na2CO3Na2CO3CuSO4Na2SO4CaCO3(五) 解释某些现象或事实(1)某些活泼金属 or 不溶性盐溶于盐溶液产生气体Mg + FeCl3或:3Mg + 2Fe3+ + 6H2O 3Mg2+ + 2Fe(OH)3↓+ 3H2↑CaCO3 + NH4Cl(2)弱酸根离子与弱碱阳离子不能大量共存Al3+与AlO2–、CO32– 、 HCO3 –、S2–、HS–Fe3+与AlO2–、CO32– 、HCO3 –双水解 离子不能共存的类型:1、因生成沉淀而不能共存:Ag+ + Cl– == AgCl↓
2、因生成气体而不能共存:2H+ + S2– == H2S ↑
3、因生成难电离物质而不能共存:H+ + ClO– = HClO
4、因氧化还原反应而不能共存:
3Fe2+ + 4H+ + NO3– == 3Fe3+ + NO↑+ 2H2O
5、因双水解而不能共存: Al3+ + 3HCO3 – == Al (OH)3↓+ 3 CO2↑(五) 解释某些现象或事实(3)证明弱酸或弱碱的某些实验要考虑盐的水解。如:证明Cu(OH)2为弱碱,可用什么证明?可用CuCl2溶液能使蓝色石蕊试纸变红(显酸性)证明。(4)除去溶液中某些金属离子,可用加热法促进其
水解,使之转变为氢氧化物沉淀。如:不纯的KNO3溶液中常含杂质Fe3+,可用加热法除杂。(5)向MgCl2和FeCl3的混合溶液中加入 除去FeCl3 。MgO(6)制备纳米材料。如:用TiCl4制备TiO2P611、 在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
A、NH4+、Al3+、SO42–、NO3–
B、K+、Na+、AlO2– 、NO3–
C、K+、Na+、MnO4–、SO42–
D、Na+、K+、NO3–、HSO3–A2、在水电离出的c (H+) = 1×10 – 14mol/L的溶液中,一定能大量共存的离子组是:
A、K+、Fe2+ 、SO32– 、MnO4 –
B、Na+、Cl– 、NO3– 、SO42–
C、Al3+、NH4+、Cl– 、SO42– 、
D、Na+、AlO2–、Br –、Cl–B(六) 比较溶液中微粒浓度的大小:(考点)1、水解理论:① 弱离子由于水解而损耗。如:KAl(SO4)2 溶液中:c (K+) c (Al3+)② 水解是微弱③ 多元弱酸水解是分步,主要决定第一步 如:NH4Cl 溶液中:
c (Cl–) c (NH4+) c (H+) c (NH3·H2O) c (OH–)如:Na2CO3 溶液中:
c (CO3–) c (HCO3–) c (H2CO3)> > > > > > > 2、电离理论:② 多元弱酸电离是分步,主要决定第一步① 弱电解质电离是微弱的如: NH3 · H2O 溶液中:
c (NH3 · H2O) c (OH–) c (NH4+) c (H+) 如:H2S溶液中:
c (H2S) c (H+) c (HS–) c (S2–) c (OH–)(六) 比较溶液中微粒浓度的大小:(考点)> > > > > >>3、电荷守恒 如:NH4Cl 溶液中
阳离子: NH4+ H+
阴离子: Cl– OH–
n ( NH4+ ) + n ( H+ ) == n ( Cl– ) + n ( OH– )溶液中阴离子和阳离子所带的电荷总数相等。c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )(六) 比较溶液中微粒浓度的大小:(考点)3、电荷守恒溶液中阴离子和阳离子所带的电荷总数相等。(六) 比较溶液中微粒浓度的大小:(考点)阳离子: Na+ 、H+
阴离子: OH– 、 S2– 、 HS–又如:Na2S 溶液
Na2S == 2Na+ + S2– H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH– c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( S2–) + c ( HS– )4、物料守恒是指某一成份的原始浓度应该等于该成份在溶液中各种存在形式的浓度之和。(六) 比较溶液中微粒浓度的大小:(考点)如:a mol / L 的Na2CO3 溶液中
Na2CO3 == 2 Na+ + CO32– H2O H+ + OH–
CO32– + H2O HCO3– + OH–
HCO3– + H2O H2CO3 + OH– ∴ c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]c (Na+ ) = 2 a mol / Lc (CO32–) + c (HCO3–) + c (H2CO3) = a mol / L4、物料守恒是指某一成份的原始浓度应该等于该成份在溶液中各种存在形式的浓度之和。(六) 比较溶液中微粒浓度的大小:(考点)如:Na2S 溶液
Na2S == 2 Na+ + S2– H2O H+ + OH–
S2– + H2O HS– + OH–
HS– + H2O H2S + OH– 因此:c (Na+ ) == 2 [ c ( S2–) + c (HS–) + c (H2S) ]
