盐类水解的课件[上学期]
文档属性
| 名称 | 盐类水解的课件[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 117.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-06-07 00:00:00 | ||
图片预览






文档简介
课件18张PPT。 以水的电离平衡为基础,说明HCl、NaOH 的水溶液为什么分别显示酸性和碱性?请思考盐类的水解〖试一试〗用pH试纸检验下列溶液显酸性、碱性、中性?
(1)CH3COONa (2)Na2CO3 (3)NH4Cl
(4)Al2(SO4)3 (5)NaCl (6)KNO3
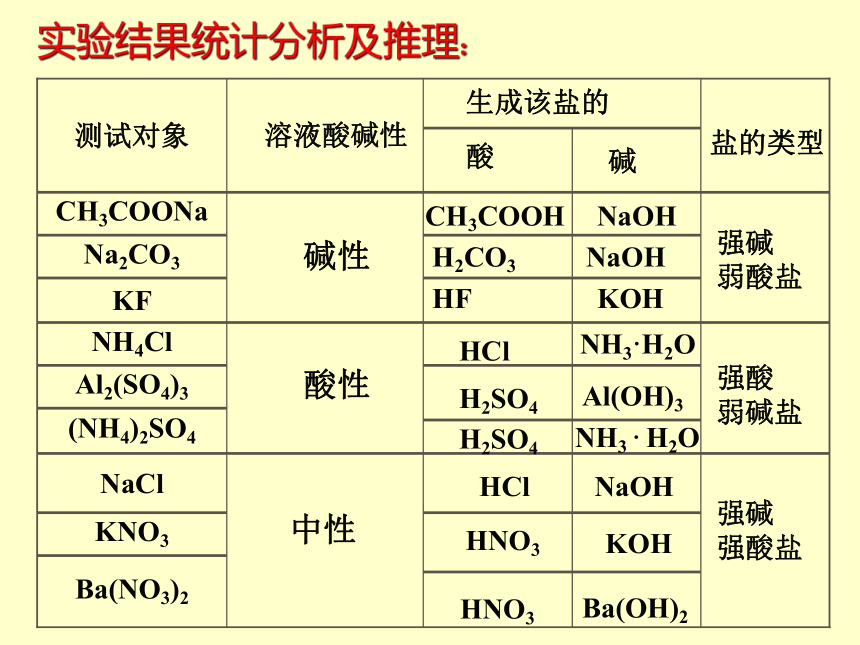
CH3COONa 、 Na2CO3 的溶液显碱性NH4Cl、 Al2(SO4)3 的溶液显酸性NaCl 、KNO3 的溶液显中性结论:探究问题一试用归纳法找出盐的组成与盐的溶液酸碱性的关系?
实验结果统计分析及推理:碱性酸性中性CH3COOH NaOH
H2CO3 NaOH
HF KOHHClNH3 · H2O
H2SO4NH3·H2O
H2SO4Al(OH)3
HClNaOHHNO3
KOH
HNO3
Ba(OH)2
碱强碱
弱酸盐强酸
弱碱盐强碱
强酸盐探究问题二为什么上述不同类型盐溶液的酸碱性不同?请思考CH3COONa是什么类型的电解质?它在水中以什么形式存在?
其水溶液中存在哪些微粒?
这些微粒能相互反应吗?
若反应,结果怎么样?
H2O H+ + OH_
醋酸钠在溶液中的变化:+ CH3COOH CH3COO +H2O CH3COOH+OH_CH3COONa + H2O CH3COOH+NaOH氯化铵在溶液中的变化:+H2O OH- +H+NH3.H2ONH4Cl +H2O NH3.H2O + HClNH4+ +H2O NH3.H2O + H+一. 盐类的水解 ⒈定义:在溶液中__电离出来的离子跟__所电离出来的__或____结合生成________的反应,叫做盐类的水解。盐水H+OH-弱电解质探究问题三⒈从盐的组成角度分析盐类水解的条件、实质是什么?
⒉盐类水解反应与中和反应的关系如何?反应程度如何?结合盐类水解的定义,探究下列问题:①水解的条件:生成弱电解质。②水解的实质:破坏了水的电离平衡,
促进了水的电离。③水解反应与中和反应的关系:酸+碱 盐+水中和水解⒉对概念的理解④中和反应进行的程度较大,是放热反应;水解反应进行的程度较小,是吸热反应。二. 盐类水解的规律水解水解
不水解
弱碱
阳离子弱酸
阴离子无
弱碱
弱酸
无
酸性碱性中性
无弱不水解谁强显谁性同强显中性有弱才水解探究问题四如何书写盐类水解的化学方程式及其离子方程式?三、盐类水解的化学、离子方 程式的书写:⒉盐类水解的程度一般很小,水解产物很少,通常不生成沉淀和气体,不用“↓”、“↑”符号,也不把生成物(如H2CO3、NH3·H2O等)写成分解产物的形式。⒊多元弱酸盐分步水解,以第一步水解为主,水解方程式一般只写第一步;多元弱碱盐的水解不分步书写。课堂练习:1. 下列溶液pH小于7的是A、 溴化钾 B、 硫酸铜 C、 硫化钠 D、 硝酸钡2. 下列溶液能使酚酞指示剂显红色的是A 、碳酸钾 B、 硫酸氢钠 C、 碳酸氢钠 D、 氯化铁3.下列离子在水溶液中不会发生水解的是A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
课堂练习:4.? 氯化铵溶液中离子浓度从大到小排列正确的是:
A NH4+ 、H + 、OH-、Cl_ B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _ D Cl_ 、 NH4+ 、 OH- 、H +思考题:物质的量相同的下列溶液中含微粒种类最
多的是:A.CaCl2 B.CH3COONa C.NH3 D.K2S5.判断下列盐溶液的酸碱性,若能水解的写出水解反应的离子方程式NaNO3、Cu(NO3)2、Na2S、FeCl3、NaClO 这节课在感性认识的基础上,进行理性思考,逻辑推理,科学抽象,形成“盐类的水解”概念,在挖掘概念内涵的基础上,总结归纳出“盐类的水解规律”,并应用规律解决了一些具体问题,盐类水解更深入的应用,下节课再探讨。
课堂小结:
(1)CH3COONa (2)Na2CO3 (3)NH4Cl
(4)Al2(SO4)3 (5)NaCl (6)KNO3
CH3COONa 、 Na2CO3 的溶液显碱性NH4Cl、 Al2(SO4)3 的溶液显酸性NaCl 、KNO3 的溶液显中性结论:探究问题一试用归纳法找出盐的组成与盐的溶液酸碱性的关系?
实验结果统计分析及推理:碱性酸性中性CH3COOH NaOH
H2CO3 NaOH
HF KOHHClNH3 · H2O
H2SO4NH3·H2O
H2SO4Al(OH)3
HClNaOHHNO3
KOH
HNO3
Ba(OH)2
碱强碱
弱酸盐强酸
弱碱盐强碱
强酸盐探究问题二为什么上述不同类型盐溶液的酸碱性不同?请思考CH3COONa是什么类型的电解质?它在水中以什么形式存在?
其水溶液中存在哪些微粒?
这些微粒能相互反应吗?
若反应,结果怎么样?
H2O H+ + OH_
醋酸钠在溶液中的变化:+ CH3COOH CH3COO +H2O CH3COOH+OH_CH3COONa + H2O CH3COOH+NaOH氯化铵在溶液中的变化:+H2O OH- +H+NH3.H2ONH4Cl +H2O NH3.H2O + HClNH4+ +H2O NH3.H2O + H+一. 盐类的水解 ⒈定义:在溶液中__电离出来的离子跟__所电离出来的__或____结合生成________的反应,叫做盐类的水解。盐水H+OH-弱电解质探究问题三⒈从盐的组成角度分析盐类水解的条件、实质是什么?
⒉盐类水解反应与中和反应的关系如何?反应程度如何?结合盐类水解的定义,探究下列问题:①水解的条件:生成弱电解质。②水解的实质:破坏了水的电离平衡,
促进了水的电离。③水解反应与中和反应的关系:酸+碱 盐+水中和水解⒉对概念的理解④中和反应进行的程度较大,是放热反应;水解反应进行的程度较小,是吸热反应。二. 盐类水解的规律水解水解
不水解
弱碱
阳离子弱酸
阴离子无
弱碱
弱酸
无
酸性碱性中性
无弱不水解谁强显谁性同强显中性有弱才水解探究问题四如何书写盐类水解的化学方程式及其离子方程式?三、盐类水解的化学、离子方 程式的书写:⒉盐类水解的程度一般很小,水解产物很少,通常不生成沉淀和气体,不用“↓”、“↑”符号,也不把生成物(如H2CO3、NH3·H2O等)写成分解产物的形式。⒊多元弱酸盐分步水解,以第一步水解为主,水解方程式一般只写第一步;多元弱碱盐的水解不分步书写。课堂练习:1. 下列溶液pH小于7的是A、 溴化钾 B、 硫酸铜 C、 硫化钠 D、 硝酸钡2. 下列溶液能使酚酞指示剂显红色的是A 、碳酸钾 B、 硫酸氢钠 C、 碳酸氢钠 D、 氯化铁3.下列离子在水溶液中不会发生水解的是A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
课堂练习:4.? 氯化铵溶液中离子浓度从大到小排列正确的是:
A NH4+ 、H + 、OH-、Cl_ B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _ D Cl_ 、 NH4+ 、 OH- 、H +思考题:物质的量相同的下列溶液中含微粒种类最
多的是:A.CaCl2 B.CH3COONa C.NH3 D.K2S5.判断下列盐溶液的酸碱性,若能水解的写出水解反应的离子方程式NaNO3、Cu(NO3)2、Na2S、FeCl3、NaClO 这节课在感性认识的基础上,进行理性思考,逻辑推理,科学抽象,形成“盐类的水解”概念,在挖掘概念内涵的基础上,总结归纳出“盐类的水解规律”,并应用规律解决了一些具体问题,盐类水解更深入的应用,下节课再探讨。
课堂小结:
