第三章第三节盐类的水解[上学期]
文档属性
| 名称 | 第三章第三节盐类的水解[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 480.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-12-23 19:45:00 | ||
图片预览



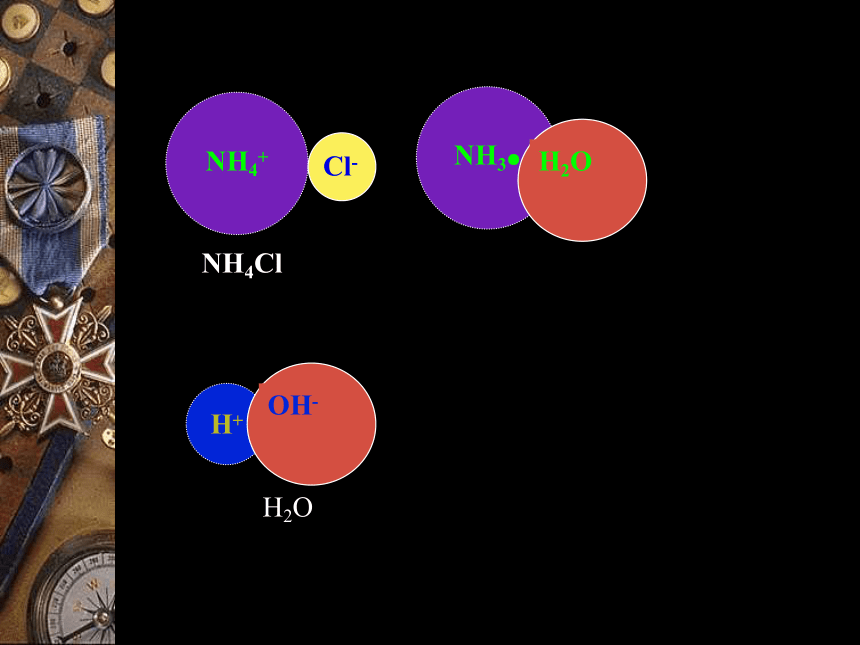
文档简介
课件16张PPT。高中化学第二册
第三章第三节盐的水解 鸡东二中 王慧知 〖试一试〗用pH试纸检验下列溶液显酸性、碱性、中性?
(1)CH3COONa (2)Na2CO3 (3)NH4Cl (4)Al2(SO4)3 (5)NaCl (6)KNO3
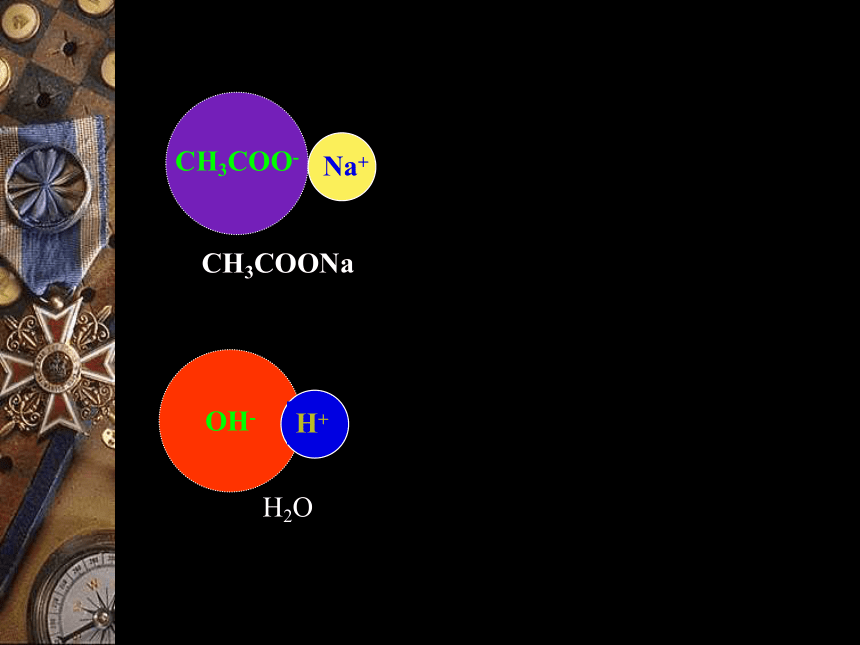
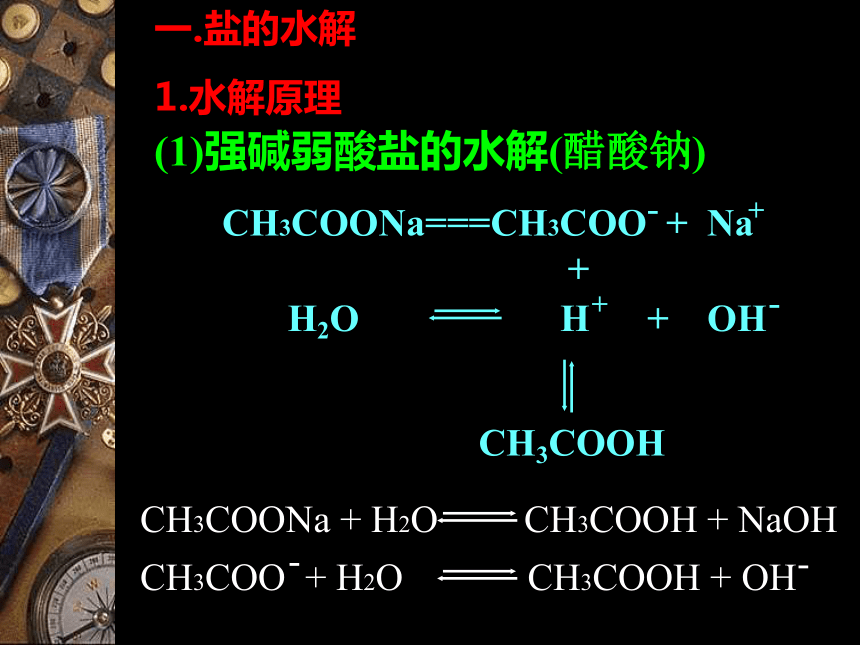
强碱弱酸盐强酸弱碱盐强酸强碱盐碱性酸性中性CH3COO-OH-CH3COONaH2O(1)强碱弱酸盐的水解(醋酸钠)一.盐的水解
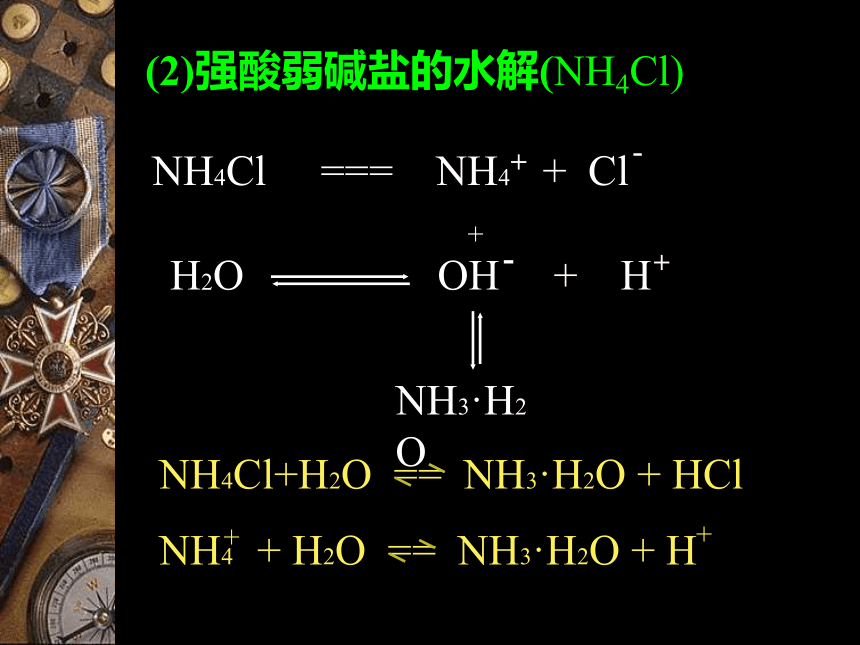
1.水解原理CH3COOH+NH4+H+NH4ClH2ONH3●(2)强酸弱碱盐的水解(NH4Cl)Cl-OH-NaClH2O(3)强酸强碱盐的水解(NaCl)不水解,呈中性
2.定义:在溶液中盐电离出来的离子跟水电离出来的氢离子或氢氧根离子结合成弱电解质的反应,叫做盐的水解。酸 + 碱 盐 + 水 盐的水解反应是中和反应的逆反应,但一般很小,不能进行到底。3 实质:
盐组成中的离子与水作用生成弱电解质,促使水的电离平衡发生移动,使溶液显酸性、碱性或中性。 弱酸的酸根离子 弱酸H2O弱碱的阳离子 弱碱CH3COO-+H2O CH3COOH + OH-显碱性NH4+ +H2O NH3·H2O + H+显酸性强碱弱酸盐的水解(碳酸钠):第一步:第二步:※碳酸钠水解强酸弱碱盐的水解[Al2(SO4)3]Al(OH)32-Al2(SO4)3 === Al + SO4 3+4. 水解规律:(水解情况要根据盐的具体情况来判断)谁弱谁水解强酸强碱盐不水解,显中性强碱弱酸盐水解显碱性强酸弱碱盐水解显酸性谁强显谁性越弱越水解无弱不水解小结NaCl K2SO4AlCl3NaAc Na2CO3CH3COONH4不水解弱碱根(阳离子)水解弱酸根(阴离子)水解阴阳离子都水解中性酸性碱性显强根性是是是否
第三章第三节盐的水解 鸡东二中 王慧知 〖试一试〗用pH试纸检验下列溶液显酸性、碱性、中性?
(1)CH3COONa (2)Na2CO3 (3)NH4Cl (4)Al2(SO4)3 (5)NaCl (6)KNO3
强碱弱酸盐强酸弱碱盐强酸强碱盐碱性酸性中性CH3COO-OH-CH3COONaH2O(1)强碱弱酸盐的水解(醋酸钠)一.盐的水解
1.水解原理CH3COOH+NH4+H+NH4ClH2ONH3●(2)强酸弱碱盐的水解(NH4Cl)Cl-OH-NaClH2O(3)强酸强碱盐的水解(NaCl)不水解,呈中性
2.定义:在溶液中盐电离出来的离子跟水电离出来的氢离子或氢氧根离子结合成弱电解质的反应,叫做盐的水解。酸 + 碱 盐 + 水 盐的水解反应是中和反应的逆反应,但一般很小,不能进行到底。3 实质:
盐组成中的离子与水作用生成弱电解质,促使水的电离平衡发生移动,使溶液显酸性、碱性或中性。 弱酸的酸根离子 弱酸H2O弱碱的阳离子 弱碱CH3COO-+H2O CH3COOH + OH-显碱性NH4+ +H2O NH3·H2O + H+显酸性强碱弱酸盐的水解(碳酸钠):第一步:第二步:※碳酸钠水解强酸弱碱盐的水解[Al2(SO4)3]Al(OH)32-Al2(SO4)3 === Al + SO4 3+4. 水解规律:(水解情况要根据盐的具体情况来判断)谁弱谁水解强酸强碱盐不水解,显中性强碱弱酸盐水解显碱性强酸弱碱盐水解显酸性谁强显谁性越弱越水解无弱不水解小结NaCl K2SO4AlCl3NaAc Na2CO3CH3COONH4不水解弱碱根(阳离子)水解弱酸根(阴离子)水解阴阳离子都水解中性酸性碱性显强根性是是是否
