铝的化合物复习课[上学期]
文档属性
| 名称 | 铝的化合物复习课[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 31.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-09 00:00:00 | ||
图片预览




文档简介
课件17张PPT。 《铝的化合物》专题复习铝的化合物
(复习二)学习目标
1、巩固Al3+、Al(OH)3、和AlO2-的性质。
2、掌握铝盐和碱反应计算的基本方法,提高 分析问题、解决问题的能力。 [讨论1]:所给未知溶液可能是Al3+盐溶液也可能 是AlO2-盐溶液,如何盐酸和氢氧化钠溶 液进行鉴定。 先有沉淀后溶解 Al3+盐 沉淀先无后有 Al3+盐
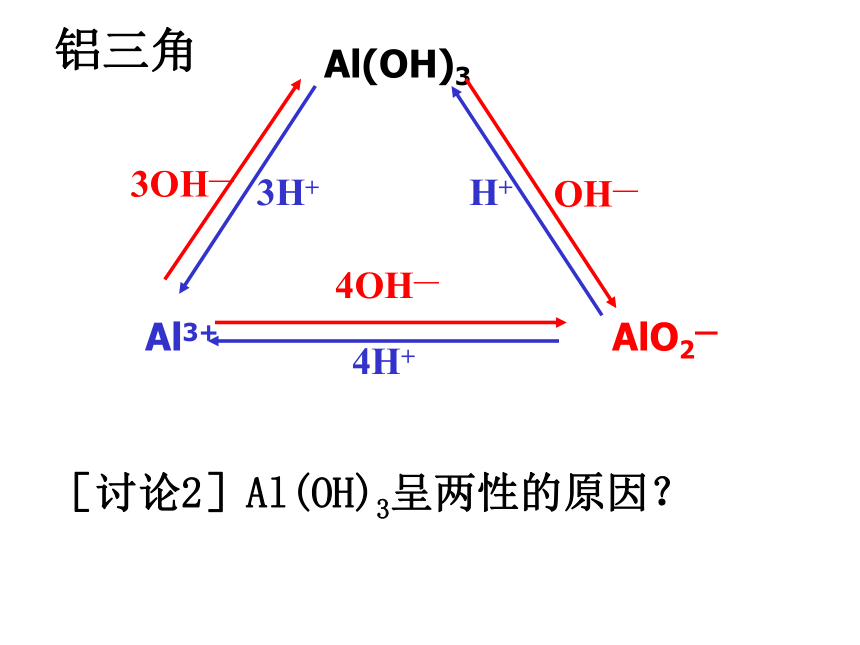
先有沉淀后溶解 AlO2- 盐 沉淀先无后有 AlO2-盐实验结果:A AlO2- 盐 B Al3+盐Al3+ AlO2—Al(OH)33OH— 铝三角OH— 3H+
H+[讨论2]Al(OH)3呈两性的原因? [练习]
1. 在下列物质中,①Al、②Al2O3、③Al(OH)3 ④NaAlO2 ⑤NaHCO3 ⑥ (NH4)2CO3 跟盐酸和氢氧化钠溶液都能反应的是
.
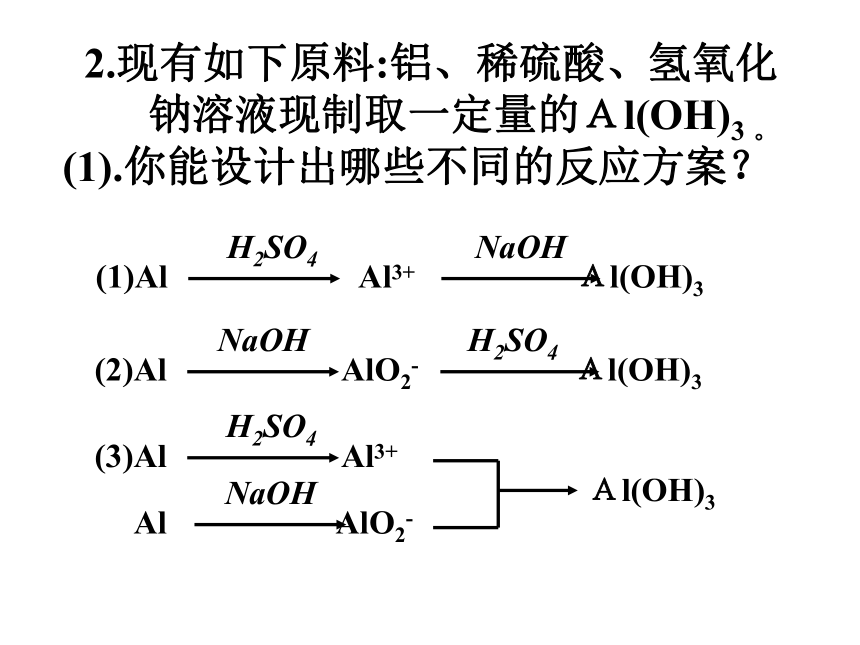
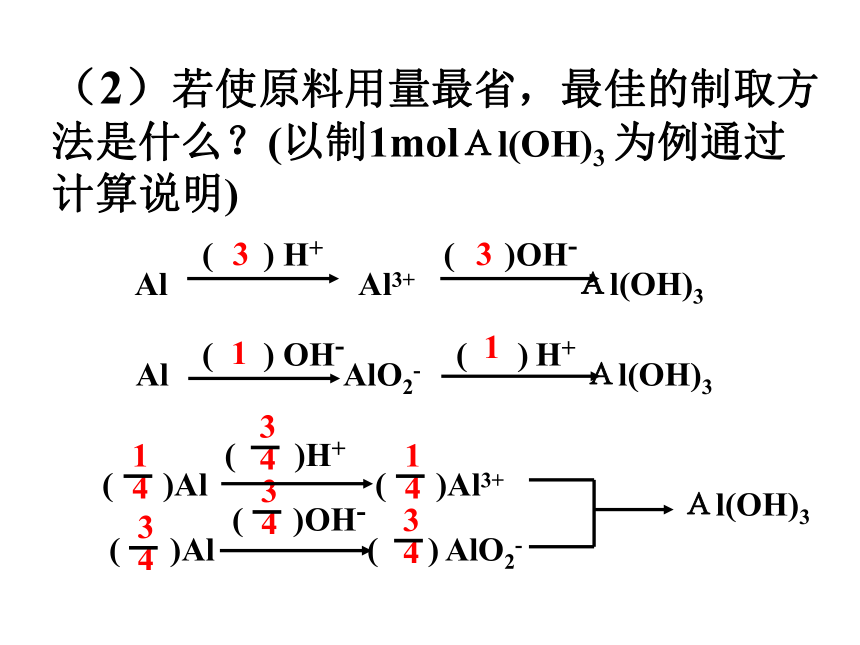
① ② ③ ⑤ ⑥ 2.现有如下原料:铝、稀硫酸、氢氧化 钠溶液现制取一定量的Al(OH)3 。 (1).你能设计出哪些不同的反应方案? (2)若使原料用量最省,最佳的制取方法是什么?(以制1molAl(OH)3 为例通过计算说明) 3. 在某化工生产中要用到一种无色可溶于水的晶体--铝铵矾,其化学成分为NH4Al(SO4)2 ·12H2O 。试回答:
(1)在铝铵矾溶液中滴入石蕊试液,观察到的现象是 ,原因为 。 (2)向该盐溶液中逐滴加入NaOH溶液 将会发生一系列变化。可能产生的现象有哪些? (3).你能画出滴加NaOH溶液过程中 沉淀的生成图像吗?1.向含1 mol KAl(SO4)2的溶液中加入a mol NaOH,由下列条件讨论a的取值。 (1).沉淀量最多时 . (2).无沉淀生成 . (3).生成沉淀后又部分溶解 ; ? 二.有关铝盐和碱反应的计算 ( a≥4 )( a=3 )3 当a= 时,SO42-恰好完全沉淀,此时铝
元素以 的形式存在。 Al(OH)3 变式二:NH4Al(SO4)2和Ba(OH)2反应,当SO42-
恰好完全沉淀时,铝元素以 的形式
存在。2AlO2- 2.向某MgCl2和AlCl3的混合溶液中逐滴加入NaOH溶液,生成沉淀的质量与加入NaOH溶液的体积关系如下:
(1).若V2 = V1,求原混合液中C(Mg2+)与 C(Al3+)之比。 Al3++ 3OH- = Al(OH)3
1 3 V1/4 3V1/4 Mg2+ + 2OH- = Mg(OH)2
1 2 V1/8 V1/4
C(Mg2+) : C(Al3+) = 1 : 2
(2)若已知1L该混合液中含Al3+0.2mol, Cl- 1mol,现只将所含Mg2+全部沉淀,则至少需加入1mol/LNaOH溶液的体积为多少L?[小结] 解题方法
看准条件由过程分析
联系规律从图像入手
确定终态守恒法解题V2
谢谢!
再见!Al3+ Al(OH)3 铝三角3OH- H+ 3H+OH-AlO2-NH3·H2O CO2+H2O
(复习二)学习目标
1、巩固Al3+、Al(OH)3、和AlO2-的性质。
2、掌握铝盐和碱反应计算的基本方法,提高 分析问题、解决问题的能力。 [讨论1]:所给未知溶液可能是Al3+盐溶液也可能 是AlO2-盐溶液,如何盐酸和氢氧化钠溶 液进行鉴定。 先有沉淀后溶解 Al3+盐 沉淀先无后有 Al3+盐
先有沉淀后溶解 AlO2- 盐 沉淀先无后有 AlO2-盐实验结果:A AlO2- 盐 B Al3+盐Al3+ AlO2—Al(OH)33OH— 铝三角OH— 3H+
H+[讨论2]Al(OH)3呈两性的原因? [练习]
1. 在下列物质中,①Al、②Al2O3、③Al(OH)3 ④NaAlO2 ⑤NaHCO3 ⑥ (NH4)2CO3 跟盐酸和氢氧化钠溶液都能反应的是
.
① ② ③ ⑤ ⑥ 2.现有如下原料:铝、稀硫酸、氢氧化 钠溶液现制取一定量的Al(OH)3 。 (1).你能设计出哪些不同的反应方案? (2)若使原料用量最省,最佳的制取方法是什么?(以制1molAl(OH)3 为例通过计算说明) 3. 在某化工生产中要用到一种无色可溶于水的晶体--铝铵矾,其化学成分为NH4Al(SO4)2 ·12H2O 。试回答:
(1)在铝铵矾溶液中滴入石蕊试液,观察到的现象是 ,原因为 。 (2)向该盐溶液中逐滴加入NaOH溶液 将会发生一系列变化。可能产生的现象有哪些? (3).你能画出滴加NaOH溶液过程中 沉淀的生成图像吗?1.向含1 mol KAl(SO4)2的溶液中加入a mol NaOH,由下列条件讨论a的取值。 (1).沉淀量最多时 . (2).无沉淀生成 . (3).生成沉淀后又部分溶解 ; ? 二.有关铝盐和碱反应的计算 ( a≥4 )( a=3 )3
元素以 的形式存在。 Al(OH)3 变式二:NH4Al(SO4)2和Ba(OH)2反应,当SO42-
恰好完全沉淀时,铝元素以 的形式
存在。2AlO2- 2.向某MgCl2和AlCl3的混合溶液中逐滴加入NaOH溶液,生成沉淀的质量与加入NaOH溶液的体积关系如下:
(1).若V2 = V1,求原混合液中C(Mg2+)与 C(Al3+)之比。 Al3++ 3OH- = Al(OH)3
1 3 V1/4 3V1/4 Mg2+ + 2OH- = Mg(OH)2
1 2 V1/8 V1/4
C(Mg2+) : C(Al3+) = 1 : 2
(2)若已知1L该混合液中含Al3+0.2mol, Cl- 1mol,现只将所含Mg2+全部沉淀,则至少需加入1mol/LNaOH溶液的体积为多少L?[小结] 解题方法
看准条件由过程分析
联系规律从图像入手
确定终态守恒法解题V2
谢谢!
再见!Al3+ Al(OH)3 铝三角3OH- H+ 3H+OH-AlO2-NH3·H2O CO2+H2O
