铁和铁的化合物(复习课)[上学期]
文档属性
| 名称 | 铁和铁的化合物(复习课)[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 732.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-24 00:00:00 | ||
图片预览



文档简介
课件14张PPT。铁和铁的化合物
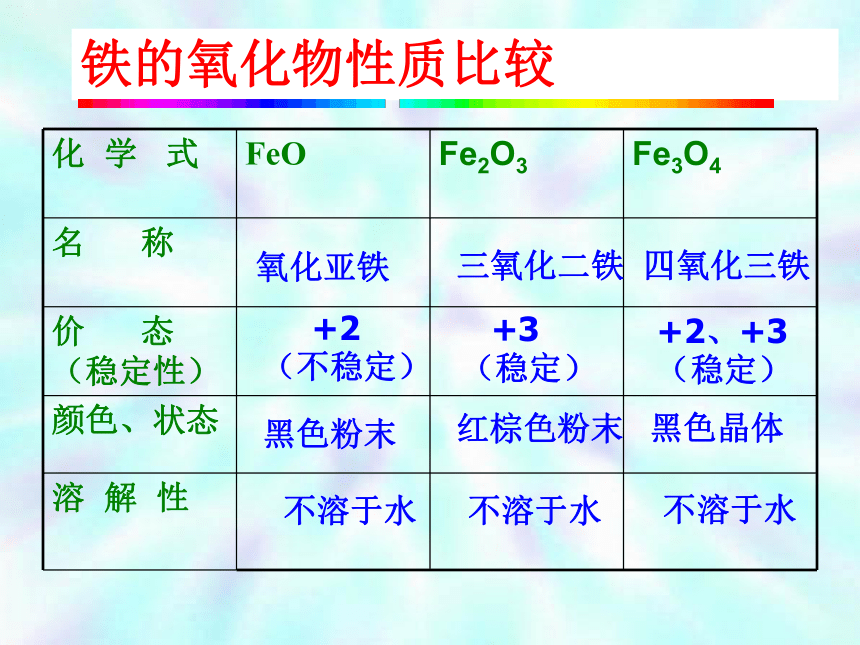
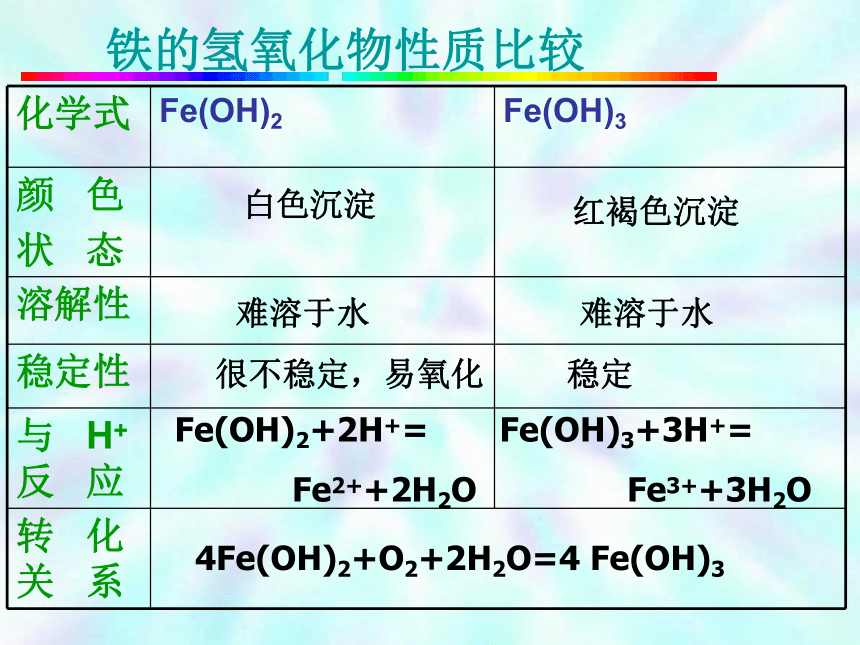
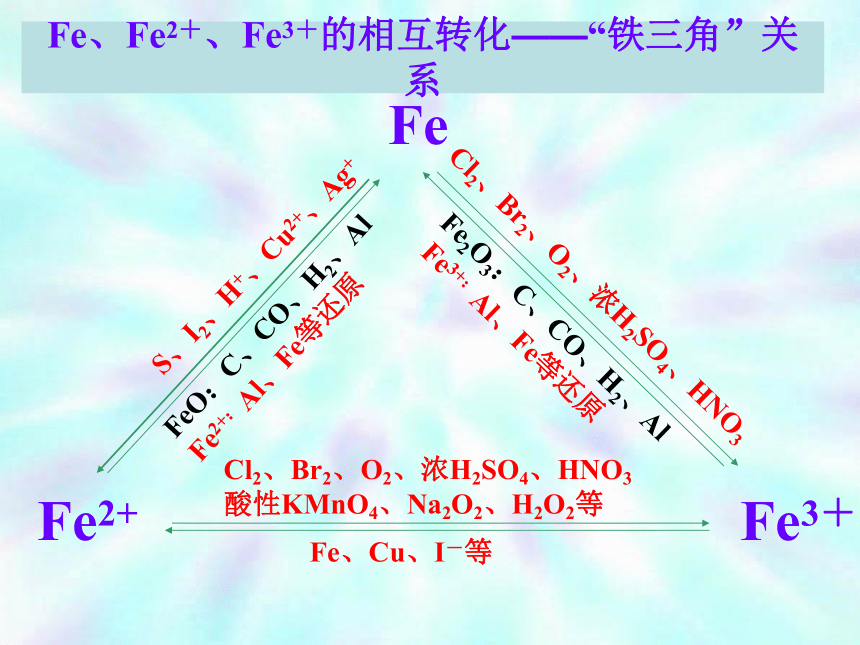
复 习铁的氧化物性质比较4Fe(OH)2+O2+2H2O=4 Fe(OH)3 铁的氢氧化物性质比较Fe、Fe2+、Fe3+的相互转化——“铁三角”关系FeFe3+Fe2+S、I2、H+、Cu2+、Ag+Cl2、Br2、O2、浓H2SO4、HNO3
Fe2O3:C、CO、H2、Al
Fe3+:Al、Fe等还原
FeO:C、CO、H2、Al
Fe2+:Al、Fe等还原Cl2、Br2、O2、浓H2SO4、HNO3
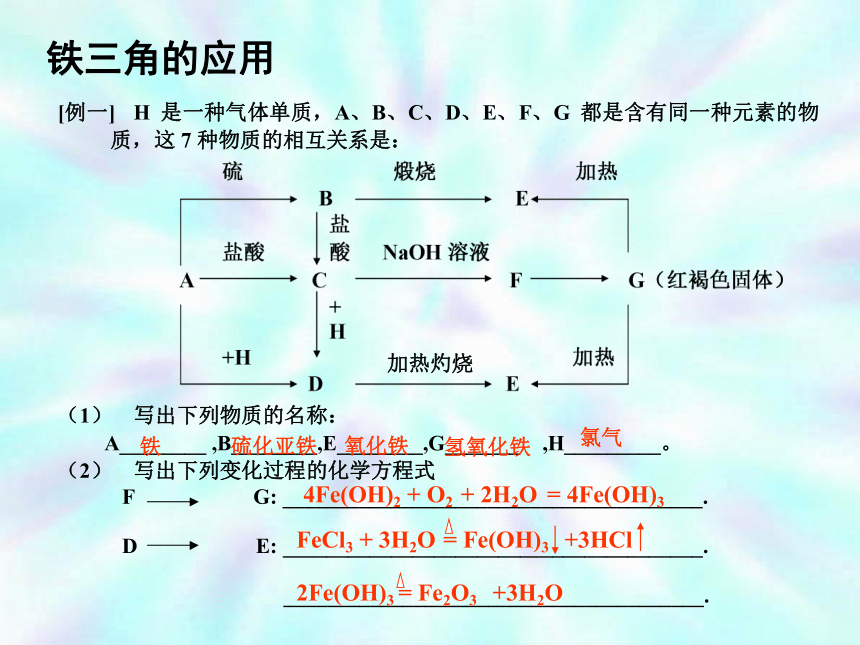
酸性KMnO4、Na2O2、H2O2等Fe、Cu、I-等4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3铁三角的应用 加热灼烧 溶液由浅绿色变为黄棕色,原因为加入盐酸后C(H+)增大,在酸性介质中NO3-可把Fe2+ 氧化为Fe3+故溶液为黄棕色 。练习2用下面的方法可以制得白色的Fe(OH)2沉淀。
方法:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。.在含有Cu(NO3)2、Fe(NO3)3各0.1mol的混合溶液中加入铁粉,经充分搅拌后铁粉完全溶解,过滤,从滤渣中分离出3.2gCu,则溶解的铁粉的质量是( )
A.5.6g B.2.8g C.14g D.8.4g
A练习3:Fe3+: 1. Fe3+在溶液中为棕黄色
2. 加入NaOH 溶液,产生红褐色沉淀。
3. 加入KSCN溶液,溶液变成血红色。Fe2+: 1. Fe2+在溶液中为浅绿色
2. 加入NaOH 溶液,产生白色沉
淀,在空气中马上变为灰绿色,最
终变为红褐色。
3.加入KSCN溶液,无明显现象,然
后滴加氯水,溶液变为血红色
Fe2+ 和 Fe3+的检验方法1.为了除去FeSO4溶液中的CuSO4和Fe2(SO4)3
杂质,可选用的物质是 ( )
A.NaOH B .Mg C .氯水 D .FeD2.向200mL 0.1mol·L Fe(NO3)2溶液中加入适量
NaOH,使Fe2+完全反应,小心加热此混合物,
直至水分蒸干,然后灼烧到质量不再变化,此时
固体的 质量为( )
A.1.44g B.1.6g C.2.82g D.2.98gB课堂练习:3.在Fe2(SO4)3和CuSO4的混合溶液中,加入过量铁粉,反应完毕后剩余固体的质量恰好等于加入铁粉的质量,则原溶液中硫酸铁和硫酸铜的物质的量之比为( ).
(A)2 :7 (B)7 :2
(C)1 :7 (D)7 :lA4. 下列离子方程式书写正确的是( )
A、FeO与稀HNO3反应:FeO + 2H+= Fe2++ H2O
B、Fe与FeCl3反应:Fe + Fe3+= 2Fe2+
C、Fe(OH)3与HI酸反应
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
D、FeCl3与足量H2S溶液反应
2Fe3+ + H2S = 2Fe2+ + S ↓+2H+D5.滴入KSCN溶液后,溶液显红色的是( )
A.(NH4)2Fe(SO4)2溶液
B.NH4Fe(SO4)2溶液
C.Fe与盐酸作用后的溶液
D.Fe与过量稀 HNO3作用后的溶液BD6.要证明某溶液中不含 Fe3+ 而可能含Fe2+ ,
进行如 下实验操作时的最佳顺序为( )
①加入足量氯水 ②加入足量I2水 ③加入
少量KSCN溶液
A. ① ③ B. ③ ② C. ③ ① D. ① ② ③C再见
复 习铁的氧化物性质比较4Fe(OH)2+O2+2H2O=4 Fe(OH)3 铁的氢氧化物性质比较Fe、Fe2+、Fe3+的相互转化——“铁三角”关系FeFe3+Fe2+S、I2、H+、Cu2+、Ag+Cl2、Br2、O2、浓H2SO4、HNO3
Fe2O3:C、CO、H2、Al
Fe3+:Al、Fe等还原
FeO:C、CO、H2、Al
Fe2+:Al、Fe等还原Cl2、Br2、O2、浓H2SO4、HNO3
酸性KMnO4、Na2O2、H2O2等Fe、Cu、I-等4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3铁三角的应用 加热灼烧 溶液由浅绿色变为黄棕色,原因为加入盐酸后C(H+)增大,在酸性介质中NO3-可把Fe2+ 氧化为Fe3+故溶液为黄棕色 。练习2用下面的方法可以制得白色的Fe(OH)2沉淀。
方法:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。.在含有Cu(NO3)2、Fe(NO3)3各0.1mol的混合溶液中加入铁粉,经充分搅拌后铁粉完全溶解,过滤,从滤渣中分离出3.2gCu,则溶解的铁粉的质量是( )
A.5.6g B.2.8g C.14g D.8.4g
A练习3:Fe3+: 1. Fe3+在溶液中为棕黄色
2. 加入NaOH 溶液,产生红褐色沉淀。
3. 加入KSCN溶液,溶液变成血红色。Fe2+: 1. Fe2+在溶液中为浅绿色
2. 加入NaOH 溶液,产生白色沉
淀,在空气中马上变为灰绿色,最
终变为红褐色。
3.加入KSCN溶液,无明显现象,然
后滴加氯水,溶液变为血红色
Fe2+ 和 Fe3+的检验方法1.为了除去FeSO4溶液中的CuSO4和Fe2(SO4)3
杂质,可选用的物质是 ( )
A.NaOH B .Mg C .氯水 D .FeD2.向200mL 0.1mol·L Fe(NO3)2溶液中加入适量
NaOH,使Fe2+完全反应,小心加热此混合物,
直至水分蒸干,然后灼烧到质量不再变化,此时
固体的 质量为( )
A.1.44g B.1.6g C.2.82g D.2.98gB课堂练习:3.在Fe2(SO4)3和CuSO4的混合溶液中,加入过量铁粉,反应完毕后剩余固体的质量恰好等于加入铁粉的质量,则原溶液中硫酸铁和硫酸铜的物质的量之比为( ).
(A)2 :7 (B)7 :2
(C)1 :7 (D)7 :lA4. 下列离子方程式书写正确的是( )
A、FeO与稀HNO3反应:FeO + 2H+= Fe2++ H2O
B、Fe与FeCl3反应:Fe + Fe3+= 2Fe2+
C、Fe(OH)3与HI酸反应
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
D、FeCl3与足量H2S溶液反应
2Fe3+ + H2S = 2Fe2+ + S ↓+2H+D5.滴入KSCN溶液后,溶液显红色的是( )
A.(NH4)2Fe(SO4)2溶液
B.NH4Fe(SO4)2溶液
C.Fe与盐酸作用后的溶液
D.Fe与过量稀 HNO3作用后的溶液BD6.要证明某溶液中不含 Fe3+ 而可能含Fe2+ ,
进行如 下实验操作时的最佳顺序为( )
①加入足量氯水 ②加入足量I2水 ③加入
少量KSCN溶液
A. ① ③ B. ③ ② C. ③ ① D. ① ② ③C再见
