原子结构[下学期]
图片预览






文档简介
课件18张PPT。原子结构Atomic Structure 基态原子:处于最低能量的原子
例如:1s2 2s2 2p6 3s2
激发态原子:基态原子的电子吸收能量后跃迁到较高能级。
例如:1s2 2s2 2p6 3s1 3p1
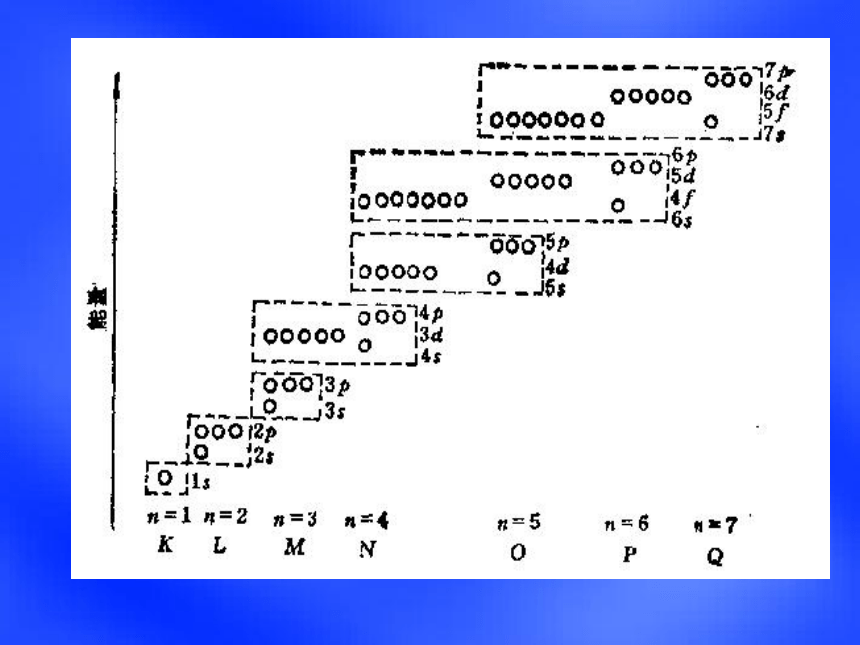
(释放能量)实例:焰火、激光、霓虹灯光玻尔理论能级和能层能层 n
意义:描述电子离核的远近决定电子能量高低
n = 1 2 3 4 5 ……
K L M N O ……
能级
意义:描述同一电子层中不同能量状态的分层
表示原子轨道或电子云的形状
能级: s p d f……
电子云:1)s电子云
(1个轨道)特点:球面对称分布,无方向性2)p电子云 (3个轨道)特点:相交于原点的2个纺锤型曲面3)d电子云4)f电子云特点:5个轨道特点:7个轨道 能量最低原理
核外电子在各轨道上的分布应使原子处于能 量最低的状态
Pauli(泡利)不相容原理:(自旋相反)
1个原子轨道最多容纳2个电子,即电子自旋方向是不同的:顺时针或逆时针 多电子原子中的电子的排布S轨道 1条 最多可容纳2个电子
p轨道 3条 最多可容纳6个电子
d轨道 5条 最多可容纳10个电子
f轨道 7条 最多可容纳14个电子 Hund(洪特)规则:当电子排布在同一能层的不同轨道时,电子将优先单独占据一个的轨道,且自旋平行 多电子原子中的电子的排布洪特规则特例:全充满 p6 d10 f14
半充满 p3 d5 f7
全 空 p0 d0 f0 电子填入轨道的顺序1s2 ,
2s2 2p6 ,
3s2 3p6 ,
4s2 3d10 4p6 ,
5s2 4d10 5p6 ,
6s2 4f14 5d10 6p6
……电子填充的先后顺序(构造原理): 1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p …
电子排布式知原子序数的元素,可按构造原理写出基态原子的电子组态:
1.标出该元素的能层和能级
2.在能级符号右上角标出该能级中的电子数原子核外电子排布式例:钠 Na 1s22s22p63s1简化电子排布式[Ne]3s11、1~36号元素的原子核外电子排布式构造原理是书写基态原子核外电子排布式的依据,也是绘制基态原子电子排布图的主要依据之一。2、1~36号元素原子简化核外电子排布式 从元素周期表中查出铜、银、金的外围电子层排布。它们是否符合构造原理?3、下列符号代表一些能层或能级的能量,请将它们按能量由低到高的顺序排列:
(1)EK EN EL EM ,
(2)E3S E2S E4S E1S ,
(3)E3S E3d E2P E4f 。4、画出下列原子的结构示意图:Be、N、 Na、Ne、Mg 回答下列问题:
在这些元素的原子中,
最外层电子数大于次外层电子数的有 最外层电子数与次外层电子数相等的有 最外层电子数与电子层数相等的有 ;
L层电子数达到最多的有 ,K层与M层电子数相等的有 。5、A元素原子的M电子层比次外层少2个电子。B元素原子核外L层电子数比最外层多7个电子。
(1)A元素的元素符号是
B元素的原子结构示意图为____________
(2)A、B两元素形成化合物的化学式及名称分别是__ _____ _。
例如:1s2 2s2 2p6 3s2
激发态原子:基态原子的电子吸收能量后跃迁到较高能级。
例如:1s2 2s2 2p6 3s1 3p1
(释放能量)实例:焰火、激光、霓虹灯光玻尔理论能级和能层能层 n
意义:描述电子离核的远近决定电子能量高低
n = 1 2 3 4 5 ……
K L M N O ……
能级
意义:描述同一电子层中不同能量状态的分层
表示原子轨道或电子云的形状
能级: s p d f……
电子云:1)s电子云
(1个轨道)特点:球面对称分布,无方向性2)p电子云 (3个轨道)特点:相交于原点的2个纺锤型曲面3)d电子云4)f电子云特点:5个轨道特点:7个轨道 能量最低原理
核外电子在各轨道上的分布应使原子处于能 量最低的状态
Pauli(泡利)不相容原理:(自旋相反)
1个原子轨道最多容纳2个电子,即电子自旋方向是不同的:顺时针或逆时针 多电子原子中的电子的排布S轨道 1条 最多可容纳2个电子
p轨道 3条 最多可容纳6个电子
d轨道 5条 最多可容纳10个电子
f轨道 7条 最多可容纳14个电子 Hund(洪特)规则:当电子排布在同一能层的不同轨道时,电子将优先单独占据一个的轨道,且自旋平行 多电子原子中的电子的排布洪特规则特例:全充满 p6 d10 f14
半充满 p3 d5 f7
全 空 p0 d0 f0 电子填入轨道的顺序1s2 ,
2s2 2p6 ,
3s2 3p6 ,
4s2 3d10 4p6 ,
5s2 4d10 5p6 ,
6s2 4f14 5d10 6p6
……电子填充的先后顺序(构造原理): 1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p …
电子排布式知原子序数的元素,可按构造原理写出基态原子的电子组态:
1.标出该元素的能层和能级
2.在能级符号右上角标出该能级中的电子数原子核外电子排布式例:钠 Na 1s22s22p63s1简化电子排布式[Ne]3s11、1~36号元素的原子核外电子排布式构造原理是书写基态原子核外电子排布式的依据,也是绘制基态原子电子排布图的主要依据之一。2、1~36号元素原子简化核外电子排布式 从元素周期表中查出铜、银、金的外围电子层排布。它们是否符合构造原理?3、下列符号代表一些能层或能级的能量,请将它们按能量由低到高的顺序排列:
(1)EK EN EL EM ,
(2)E3S E2S E4S E1S ,
(3)E3S E3d E2P E4f 。4、画出下列原子的结构示意图:Be、N、 Na、Ne、Mg 回答下列问题:
在这些元素的原子中,
最外层电子数大于次外层电子数的有 最外层电子数与次外层电子数相等的有 最外层电子数与电子层数相等的有 ;
L层电子数达到最多的有 ,K层与M层电子数相等的有 。5、A元素原子的M电子层比次外层少2个电子。B元素原子核外L层电子数比最外层多7个电子。
(1)A元素的元素符号是
B元素的原子结构示意图为____________
(2)A、B两元素形成化合物的化学式及名称分别是__ _____ _。
