二氧化硫[下学期]
图片预览







文档简介
课件27张PPT。 随着人们生活水平的日益提高,城市工业化步伐的大步前进,环境污染已经成为全世界最为关注的问题之一,某些工厂排出的废气不经过处理直接排放到空气中,严重造成了大气污染,使得某些地区雨水酸性严重超标,形成酸雨。 1872年美国化学家Smith首先提出酸雨一词,引起全世界关注。1985年,几场酸雨过后,我国四川奉节县9万多亩松树全部枯死,重庆南山2.7万亩马尾松死亡过半。左侧图片摄于1908年右侧图片摄于1968年酸雨腐蚀前后认识酸雨 阅读书本128页(二)酸雨形成的主要原因是:
大气中SO2过多大气中SO2有三个来源:
主要:化石燃料(如煤)的燃烧,
含硫矿石的冶炼.
硫酸 磷肥 纸浆等工厂废气.
气体
无色
有刺激性
有毒
-10℃ 易液化
比空气大
易溶于水
在常温、常压下,
1体积水大约能溶解40体积的SO2 。
状态:
颜色:
气味:
毒性:
沸点:
密度:
溶解度:
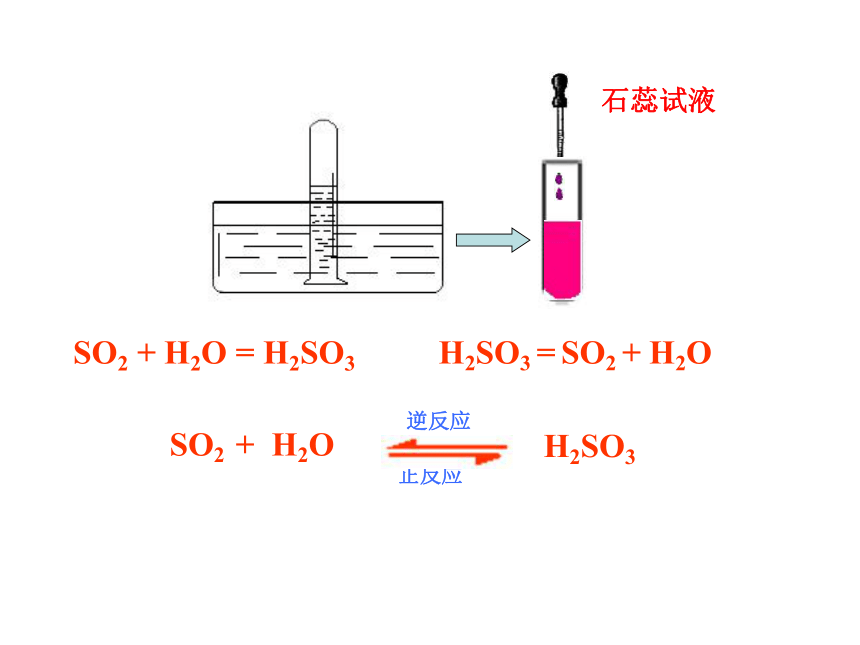
1. 物理性质:SO2 + H2O = H2SO3H2SO3 = SO2 + H2O 石蕊试液认识 SO2:氧化还原角度
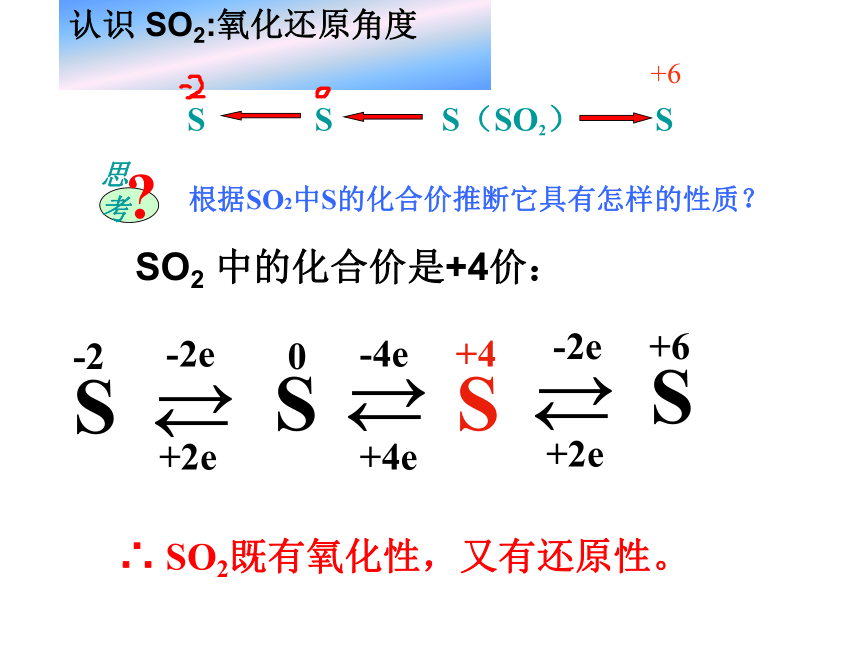
SO2 中的化合价是+4价:∴ SO2既有氧化性,又有还原性。
SO2 中的化合价是+4价:被还原剂还原②SO2的氧化性——与H2S 的反应:SO2 + 2 H2S = 3 S ↓ + 2 H2O SO2 中的化合价是+4价:被氧化剂氧化SO2的还原性 a. 与O2的反应: SO3 :无色固体, 熔点(16.8℃)和沸点(44.8℃) 都比较低。SO3 + H2O = H2SO4 + Q
SO3 也是酸酐,是酸性氧化物。b. 与卤素单质的反应: SO2 + I2 + 2 H2O = H2SO4 + 2HI(两种气体生成两种强酸)SO2+X2+2H2O=H2SO4+2HX X=Cl、Br、IC. 与强氧化物反应:——氧化产物为SO3、H2SO4或硫酸盐 2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl
2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4常见的氧化剂除Cl2、Br2、I2、 O2还有KMnO4/H+、 HNO3、Fe3+ 等,SO2能使溴水和酸性KMnO4溶液褪色。⑶ SO2 的漂白性:实验现象:品红溶液(有机物)中通二氧化硫
观察颜色变化 SO2 与某些有色物质化合生成
无色 物质,但是这些无色物质不稳定,
容易分解而恢复原来的颜色 。——化合漂白漂白机理:除了SO2,还有哪些物质具有漂白性? Cl2 , Na2O2 , O3 ,活性炭,
……它们的漂白机理有何不同?Cl2 ,Na2O2 , O3 ——— 氧化漂白活性炭 ——— 吸附漂白SO2—— 化合漂白不稳定课堂习题 二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将 [ ]
A 、和氯气单独通过时相同 B、和二氧化硫单独通过时相同
C、是二者作用效果之和 D、可能失去漂白性D下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
B D思考: 总结二氧化硫的功与过?功:二氧化硫的用途⑵可以漂白白纸浆、毛、丝、草编制品等。 ⑶杀灭霉菌和细菌。⑷作食物和干果的防腐剂。⑴制造硫酸:禁止SO2漂白黑木耳二氧化硫形成酸雨的可能途径有那些? 或者过:造成大气污染形成酸雨过:可造成大气污染减少SO2污染的方法:
①减少煤的燃烧:改用其他的燃料.
②煤的脱硫:往煤中加生石灰.
CaO+SO2=CaSO3,2CaSO3+O2=2CaSO4
③工厂尾气的净化:可用碱液吸收.
常见碱液:NH3·H2O、NaOH等
.
SO2的制备
工业制法:
燃烧硫或煅烧金属硫化物制取SO2。
了解 SO2 实验室制法
反应原理:
反应装置:
净化装置:
检验还原性装置:
检验氧化性装置:
收集装置:
尾气吸收装置:了解 SO2注意:因为Na2SO3是粉未状的固体,易溶于水,
故不能用启普发生器制SO2
三氧化硫 1、 SO3的物理性质
SO3是无色易挥发的晶体,熔点为16.8℃,沸点为44.8℃。
2、 SO3的化学性质
(1)具有酸性氧化物的通性
SO3+H2O=H2SO4
SO3+2NaHSO3=Na2SO4+2SO2+H2O(温度较高时,除去SO2中混有的SO3气体)
注:SO3极易吸收水分,在空气中强烈冒烟,溶于水剧烈反应生成H2SO4及一系列水合物, 同时放出大量的热。 (2)强氧化性
5SO3+2P=5SO2+P2O5
2KI+SO3=K2SO3+I2
大气中SO2过多大气中SO2有三个来源:
主要:化石燃料(如煤)的燃烧,
含硫矿石的冶炼.
硫酸 磷肥 纸浆等工厂废气.
气体
无色
有刺激性
有毒
-10℃ 易液化
比空气大
易溶于水
在常温、常压下,
1体积水大约能溶解40体积的SO2 。
状态:
颜色:
气味:
毒性:
沸点:
密度:
溶解度:
1. 物理性质:SO2 + H2O = H2SO3H2SO3 = SO2 + H2O 石蕊试液认识 SO2:氧化还原角度
SO2 中的化合价是+4价:∴ SO2既有氧化性,又有还原性。
SO2 中的化合价是+4价:被还原剂还原②SO2的氧化性——与H2S 的反应:SO2 + 2 H2S = 3 S ↓ + 2 H2O SO2 中的化合价是+4价:被氧化剂氧化SO2的还原性 a. 与O2的反应: SO3 :无色固体, 熔点(16.8℃)和沸点(44.8℃) 都比较低。SO3 + H2O = H2SO4 + Q
SO3 也是酸酐,是酸性氧化物。b. 与卤素单质的反应: SO2 + I2 + 2 H2O = H2SO4 + 2HI(两种气体生成两种强酸)SO2+X2+2H2O=H2SO4+2HX X=Cl、Br、IC. 与强氧化物反应:——氧化产物为SO3、H2SO4或硫酸盐 2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl
2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4常见的氧化剂除Cl2、Br2、I2、 O2还有KMnO4/H+、 HNO3、Fe3+ 等,SO2能使溴水和酸性KMnO4溶液褪色。⑶ SO2 的漂白性:实验现象:品红溶液(有机物)中通二氧化硫
观察颜色变化 SO2 与某些有色物质化合生成
无色 物质,但是这些无色物质不稳定,
容易分解而恢复原来的颜色 。——化合漂白漂白机理:除了SO2,还有哪些物质具有漂白性? Cl2 , Na2O2 , O3 ,活性炭,
……它们的漂白机理有何不同?Cl2 ,Na2O2 , O3 ——— 氧化漂白活性炭 ——— 吸附漂白SO2—— 化合漂白不稳定课堂习题 二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将 [ ]
A 、和氯气单独通过时相同 B、和二氧化硫单独通过时相同
C、是二者作用效果之和 D、可能失去漂白性D下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
B D思考: 总结二氧化硫的功与过?功:二氧化硫的用途⑵可以漂白白纸浆、毛、丝、草编制品等。 ⑶杀灭霉菌和细菌。⑷作食物和干果的防腐剂。⑴制造硫酸:禁止SO2漂白黑木耳二氧化硫形成酸雨的可能途径有那些? 或者过:造成大气污染形成酸雨过:可造成大气污染减少SO2污染的方法:
①减少煤的燃烧:改用其他的燃料.
②煤的脱硫:往煤中加生石灰.
CaO+SO2=CaSO3,2CaSO3+O2=2CaSO4
③工厂尾气的净化:可用碱液吸收.
常见碱液:NH3·H2O、NaOH等
.
SO2的制备
工业制法:
燃烧硫或煅烧金属硫化物制取SO2。
了解 SO2 实验室制法
反应原理:
反应装置:
净化装置:
检验还原性装置:
检验氧化性装置:
收集装置:
尾气吸收装置:了解 SO2注意:因为Na2SO3是粉未状的固体,易溶于水,
故不能用启普发生器制SO2
三氧化硫 1、 SO3的物理性质
SO3是无色易挥发的晶体,熔点为16.8℃,沸点为44.8℃。
2、 SO3的化学性质
(1)具有酸性氧化物的通性
SO3+H2O=H2SO4
SO3+2NaHSO3=Na2SO4+2SO2+H2O(温度较高时,除去SO2中混有的SO3气体)
注:SO3极易吸收水分,在空气中强烈冒烟,溶于水剧烈反应生成H2SO4及一系列水合物, 同时放出大量的热。 (2)强氧化性
5SO3+2P=5SO2+P2O5
2KI+SO3=K2SO3+I2
