硫酸[下学期]
图片预览






文档简介
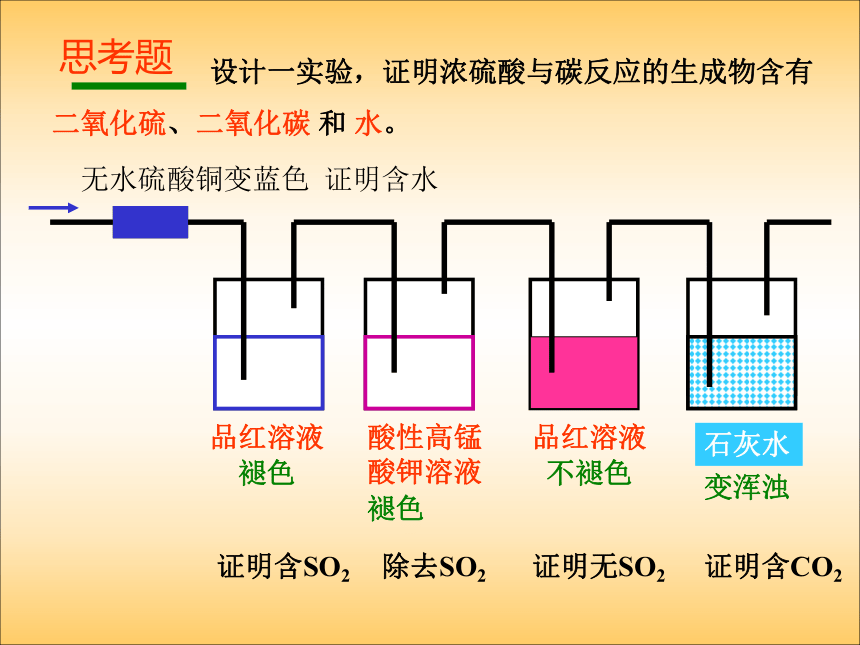
课件15张PPT。三 氧化硫 SO3 设计一实验,证明浓硫酸与碳反应的生成物含有
二氧化硫、二氧化碳 和 水。无水硫酸铜品红溶液品红溶液酸性高锰酸钾溶液石灰水证明含SO2除去SO2证明无SO2证明含CO2证明含水思考题变蓝色褪色褪色不褪色变浑浊 【练习】lL 0.1mol/L 的 NaOH 溶液吸收 0.08 mol SO2, 求所
得溶液中溶质的成分及物质的量。x设生成 的NaHSO3 及 Na2SO3 的物质的量分别为 x、yx NaOH + SO2 = NaHSO3 2NaOH + SO2 = Na2SO3 + H2Oyyx +2y = (0.1mol/L)(1L) x + y = 0.08molx = 0.06 moly = 0.02 mol答: NaHSO3的物质的量为0.06mol, Na2SO3的物质的量为
0.02mol。x2y【解法一】 【练习】lL 0.1mol/L 的 NaOH 溶液吸收 0.08 mol SO2, 求所
得溶液中溶质的成分及物质的量。 NaOH + SO2 = NaHSO3 2NaOH + SO2 = Na2SO3 + H2O 列比例,可求得 NaHSO3的物质的量为0.06mol, Na2SO3
的物质的量为 0.02mol。【解法二】由题意,知反应物 NaOH 和 SO2 的物质的量的比为 5:4 ,
生成物为NaHSO3 及 Na2SO3 ,可得化学方程式:5NaOH + 4SO2 = 3NaHSO3 + Na2SO3 + H2O设NaHSO3 和Na2SO3物质的量分别为 x、y5mol4mol3mol1mol(1L) (0.1mol/L)0. 08molxy 亚硫酸和亚硫酸盐1. 亚硫酸⑴ 弱酸性2. 亚硫酸盐⑵ 不稳定性⑶ 还原性2H2SO3 + O2 = 2H2SO42Na2SO3 + O2 = 2Na2SO4亚硫酸和
亚硫酸盐
比
二氧化硫
有更强的
还原性 三 氧 化 硫物理性质⑴ 无色易挥发晶体2. 化学性质⑵ 熔点为16.8℃, 沸点为44.8℃SO3 + H2O = H2SO4标准状况下
1mol SO3
所占的体积
为22.4L。
此话对否?⑴ 酸性氧化物通性SO3 + 2NaOH = Na2SO4 +H2O⑵ 强氧化性保护环境
就 是
保护人类自身环境污染大气污染土壤污染水污染食品污染固体废弃物
污染放射线污染噪声污染大气污染二氧化硫氮的氧化物碳的氧化物碳氢化合物粉尘煤烟 二 氧 化 硫
是大气的主要污染物 ⑴ 使人发生呼吸道疾病 ⑵ 会使植物枯死 ⑶ 形成酸雨三大罪状酸雨:pH < 5.6的降水形成原因:SO3 + H2O = H2SO4SO2 + H2O = H2SO32H2SO3 + O2 = 2H2SO4 二氧化硫主要来源于煤和石油的燃烧,
金属矿物的冶炼。酸雨的危害:湖泊水质酸化,毒害水中生物。 挪威、瑞典的四万个湖泊已成了无鱼的死湖。使土壤酸化,破坏农田、损害农作物、森林。欧洲学者惊呼:森林正在快速地在中欧消失。腐蚀建筑物、金属制品、名胜古迹。重庆城区的电线平均十年就要更换线材,
重庆电视塔建成三年就锈迹斑驳。环境污染的治理控制废物的排放将废物回收利用保护环境,人人有责!作业 课本70页 第3 题 *资料79页 第1题2000年11月29日同学们再见
二氧化硫、二氧化碳 和 水。无水硫酸铜品红溶液品红溶液酸性高锰酸钾溶液石灰水证明含SO2除去SO2证明无SO2证明含CO2证明含水思考题变蓝色褪色褪色不褪色变浑浊 【练习】lL 0.1mol/L 的 NaOH 溶液吸收 0.08 mol SO2, 求所
得溶液中溶质的成分及物质的量。x设生成 的NaHSO3 及 Na2SO3 的物质的量分别为 x、yx NaOH + SO2 = NaHSO3 2NaOH + SO2 = Na2SO3 + H2Oyyx +2y = (0.1mol/L)(1L) x + y = 0.08molx = 0.06 moly = 0.02 mol答: NaHSO3的物质的量为0.06mol, Na2SO3的物质的量为
0.02mol。x2y【解法一】 【练习】lL 0.1mol/L 的 NaOH 溶液吸收 0.08 mol SO2, 求所
得溶液中溶质的成分及物质的量。 NaOH + SO2 = NaHSO3 2NaOH + SO2 = Na2SO3 + H2O 列比例,可求得 NaHSO3的物质的量为0.06mol, Na2SO3
的物质的量为 0.02mol。【解法二】由题意,知反应物 NaOH 和 SO2 的物质的量的比为 5:4 ,
生成物为NaHSO3 及 Na2SO3 ,可得化学方程式:5NaOH + 4SO2 = 3NaHSO3 + Na2SO3 + H2O设NaHSO3 和Na2SO3物质的量分别为 x、y5mol4mol3mol1mol(1L) (0.1mol/L)0. 08molxy 亚硫酸和亚硫酸盐1. 亚硫酸⑴ 弱酸性2. 亚硫酸盐⑵ 不稳定性⑶ 还原性2H2SO3 + O2 = 2H2SO42Na2SO3 + O2 = 2Na2SO4亚硫酸和
亚硫酸盐
比
二氧化硫
有更强的
还原性 三 氧 化 硫物理性质⑴ 无色易挥发晶体2. 化学性质⑵ 熔点为16.8℃, 沸点为44.8℃SO3 + H2O = H2SO4标准状况下
1mol SO3
所占的体积
为22.4L。
此话对否?⑴ 酸性氧化物通性SO3 + 2NaOH = Na2SO4 +H2O⑵ 强氧化性保护环境
就 是
保护人类自身环境污染大气污染土壤污染水污染食品污染固体废弃物
污染放射线污染噪声污染大气污染二氧化硫氮的氧化物碳的氧化物碳氢化合物粉尘煤烟 二 氧 化 硫
是大气的主要污染物 ⑴ 使人发生呼吸道疾病 ⑵ 会使植物枯死 ⑶ 形成酸雨三大罪状酸雨:pH < 5.6的降水形成原因:SO3 + H2O = H2SO4SO2 + H2O = H2SO32H2SO3 + O2 = 2H2SO4 二氧化硫主要来源于煤和石油的燃烧,
金属矿物的冶炼。酸雨的危害:湖泊水质酸化,毒害水中生物。 挪威、瑞典的四万个湖泊已成了无鱼的死湖。使土壤酸化,破坏农田、损害农作物、森林。欧洲学者惊呼:森林正在快速地在中欧消失。腐蚀建筑物、金属制品、名胜古迹。重庆城区的电线平均十年就要更换线材,
重庆电视塔建成三年就锈迹斑驳。环境污染的治理控制废物的排放将废物回收利用保护环境,人人有责!作业 课本70页 第3 题 *资料79页 第1题2000年11月29日同学们再见
