硫酸[下学期]
图片预览





文档简介
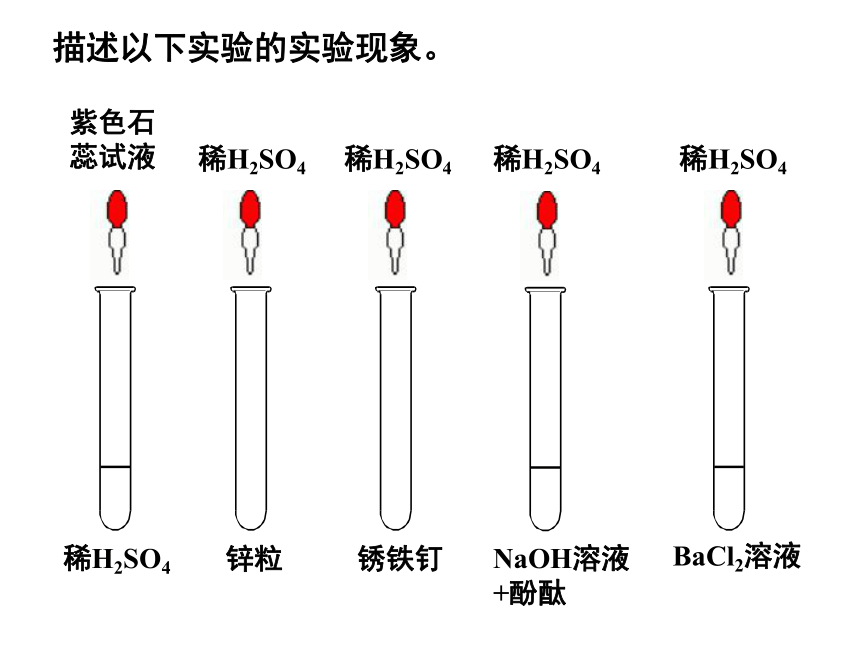
课件16张PPT。学习主线(化合价)描述以下实验的实验现象。稀H2SO4紫色石蕊试液锌粒稀H2SO4锈铁钉稀H2SO4NaOH溶液+酚酞稀H2SO4稀H2SO4BaCl2溶液【实验一】在试管中放少量胆矾(CuSO4·5H2O),并滴加少量浓H2SO4,振荡,观察固体颜色的变化。1、有什么现象?为什么?
2、这说明了浓H2SO4的什么性质?
3、性质决定用途,浓H2SO4可能有什么用途?固体颜色由蓝变白,胆矾晶体失去结晶水。吸水性:H2SO4 + nH2O = H2SO4 · nH2O常作气体干燥剂【实验二】“黑面包”实验。1、有什么现象?
2、蔗糖为什么会变黑?这说明浓H2SO4的什么性质?
3、脱水性和吸水性有何区别?
4、蔗糖体积为何会膨胀,刺激性气味的气体从何而来?蔗糖(C12H22O11)由白变黑,体积膨胀,呈疏松海绵状,有刺激性气味气体生成,放出大量的热。蔗糖脱水炭化,浓H2SO4具有脱水性。吸水是指吸收物质中本来就有的水分、水蒸气(或结晶水),脱水是指将化合物(主要是有机物)分子中的H、O两种元素按原子个数比2∶1脱去。【实验三】铜与浓H2SO4共热,观察现象。
1、有什么现象?反应生成什么物质?
2、根据推测的产物,书写该反应的化学方程式;
3、该反应中,氧化剂、还原剂、氧化产物、还原产物分别是
什么?还原剂与氧化剂的物质的量之比为多少?
4、该反应中,浓H2SO4的作用是什么?
5、该反应中,浓H2SO4的氧化性是由什么引起的?稀H2SO4是否也有氧化性?如果有,又何差别?溶液颜色变蓝,产生的气体使酸性KMnO4溶液褪色。氧化剂、酸性作用。浓H2SO4分子具有强氧化性,加热情况下氧化性更强,稀H2SO4具有弱氧化性,是由H+引起的。【问题1】某同学将两根表面已去除氧化膜的Al条分别插入盛有足量浓H2SO4、 CuSO4溶液的两支试管(分别标以A、B)中,各有什么现象?
1~2分钟后,将A试管中的Al条取出,插入B试管的CuSO4溶液中,有何现象?
将Al条取出,去除氧化膜后,再插入A试管的浓H2SO4中,加热,有何现象?请书写该反应的化学方程式。A试管中无明显变化,B试管中Al条表面镀上一层红色的铜无明显变化剧烈反应,Al条表面产生气泡,刺激性气味。【问题2】浓H2SO4有吸水性,常作一些气体的干燥剂,那么哪些气体不能用它来干燥呢?还原性气体(如H2S、HBr、HI)、碱性气体(如NH3)。【问题3】SO2有较强的还原性,能否用浓H2SO4来干燥呢?H2、CO呢?均可。SO2中S元素为+4价,同种元素的相邻价态不能发生氧化还原反应;H2、CO在高温条件下才有较强的还原性。【问题5】浓H2SO4滴在干燥的蓝色石蕊试纸上,可能会有什么现象?如果是试纸是湿润的,又可能有什么现象?【问题4】课本实验的两个细节:
1、“黑面包”实验:观察的白烟是什么?
2、铜与浓H2SO4共热实验:小试管口处棉花团的作用?SO2 + H2O = H2SO3,白烟是亚硫酸的酸雾。用NaOH溶液浸湿的棉花团的作用是吸收多余的SO2,防止污染空气。试纸干燥:先变红,后变黑;试纸湿润:变红。
如果是氯水呢?【问题6】如何鉴别失去标签的浓H2SO4和浓HCl?1、摇动,粘稠油状者为浓H2SO4;
2、打开瓶盖,瓶口出现白雾者为浓HCl;
3、打开瓶盖,露置空气中一段时间,质量增加者为浓H2SO4,质量减少者为浓HCl;
4、分别取少量试样,分装两支试管中,各投入一小块Fe片,产生气泡者为浓HCl;
5、能使纸张或棉花等变黑者为浓H2SO4;1、取等体积的两种试样,质量较重者为浓H2SO4;
2、露置空气中一段时间,质量增加者为浓H2SO4;
3、能使纸张、棉花等变黑者为浓H2SO4;
4、常温下,能和Fe片反应产生气泡者为稀H2SO4;
5、加水稀释,放出大量的热,为浓H2SO4;
6、能使胆矾晶体失去结晶水者为浓H2SO4;
7、加热能与铜反应者为浓H2SO4。【问题7】如何鉴别失去标签的浓H2SO4和稀H2SO4?【问题8】1、回忆金属与浓H2SO4反应的一般规律,试描述足量的金属锌跟一定量的浓H2SO4反应的实验现象,写出化学方程式。
2、浓、稀H2SO4是否均有氧化性?分别是由哪种元素的化合价变化引起的?
3、浓、稀H2SO4是否均为氧化性酸?Zn + 2H2SO4(浓)= ZnSO4 + SO2↑ + 2H2O
Zn + H2SO4 = ZnSO4 + H2↑均有氧化性。浓H2SO4中主要存在H2SO4分子,+6价的S在反应中被还原,而稀H2SO4则完全电离出H+,H+被还原。浓H2SO4是氧化性酸,稀H2SO4具有一定的氧化性,但不是氧化性酸。【问题9】组装一套实验装置,验证木炭与浓H2SO4反应的产物。一套完整的实验装置,应包括发生装置、性质实验装置、收集装置、尾气处理装置等。产物用何种试剂检验CO2
SO2
H2O用何种仪器或装置澄清石灰水
品红溶液
无水CuSO4洗气瓶
洗气瓶
硬质玻璃管或双通管检验顺序?1、A处反应中,浓H2SO4的作用是 ;
2、若将连接顺序改为②、①、③,则可检出的物质是
,不能检出的物质是 ;
3、若将连接顺序改为①、③、②或②、③、①又如何?只作氧化剂【问题10】由以上实验,归纳SO42-的检验方法。对其合理性作出评价。可能是AgCl排除Ag+、CO32-、SO32-能否将稀HCl改为稀HNO3?BaCl2能否改为Ba(NO3)2?【练习1】下列描述反映了硫酸的哪些主要性质:
⑴浓H2SO4滴在木条上,过一会儿,木条变黑;
⑵敞口放置浓H2SO4时,质量增加;
⑶锌粒投入稀H2SO4中,有气泡产生;
⑷把铜片放入浓H2SO4中加热,有气体产生;
⑸利用浓H2SO4和食盐固体反应制备HCl气体;
⑹浓H2SO4不能用来干燥H2S、HBr、HI气体;
⑺利用FeS与稀H2SO4反应制备H2S气体;
⑻浓H2SO4可用铁制或铝制的容器来贮运。脱水性吸水性酸性强氧化性难挥发性强氧化性强酸性强氧化性【练习2】向50 mL 18 mol/L的H2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A、小于0.45 mol B、等于0.45 mol
C、在0.45~0.90mol之间 D、大于0.45 mol
【练习3】为方便某些化学计算,有人将98%浓H2SO4表示成下列形式,其中合理的是( )
A、H2SO4·1/9H2O B、H2SO4·H2O
C、H2SO4·SO3 D、SO3·10/9H2OA、DA
2、这说明了浓H2SO4的什么性质?
3、性质决定用途,浓H2SO4可能有什么用途?固体颜色由蓝变白,胆矾晶体失去结晶水。吸水性:H2SO4 + nH2O = H2SO4 · nH2O常作气体干燥剂【实验二】“黑面包”实验。1、有什么现象?
2、蔗糖为什么会变黑?这说明浓H2SO4的什么性质?
3、脱水性和吸水性有何区别?
4、蔗糖体积为何会膨胀,刺激性气味的气体从何而来?蔗糖(C12H22O11)由白变黑,体积膨胀,呈疏松海绵状,有刺激性气味气体生成,放出大量的热。蔗糖脱水炭化,浓H2SO4具有脱水性。吸水是指吸收物质中本来就有的水分、水蒸气(或结晶水),脱水是指将化合物(主要是有机物)分子中的H、O两种元素按原子个数比2∶1脱去。【实验三】铜与浓H2SO4共热,观察现象。
1、有什么现象?反应生成什么物质?
2、根据推测的产物,书写该反应的化学方程式;
3、该反应中,氧化剂、还原剂、氧化产物、还原产物分别是
什么?还原剂与氧化剂的物质的量之比为多少?
4、该反应中,浓H2SO4的作用是什么?
5、该反应中,浓H2SO4的氧化性是由什么引起的?稀H2SO4是否也有氧化性?如果有,又何差别?溶液颜色变蓝,产生的气体使酸性KMnO4溶液褪色。氧化剂、酸性作用。浓H2SO4分子具有强氧化性,加热情况下氧化性更强,稀H2SO4具有弱氧化性,是由H+引起的。【问题1】某同学将两根表面已去除氧化膜的Al条分别插入盛有足量浓H2SO4、 CuSO4溶液的两支试管(分别标以A、B)中,各有什么现象?
1~2分钟后,将A试管中的Al条取出,插入B试管的CuSO4溶液中,有何现象?
将Al条取出,去除氧化膜后,再插入A试管的浓H2SO4中,加热,有何现象?请书写该反应的化学方程式。A试管中无明显变化,B试管中Al条表面镀上一层红色的铜无明显变化剧烈反应,Al条表面产生气泡,刺激性气味。【问题2】浓H2SO4有吸水性,常作一些气体的干燥剂,那么哪些气体不能用它来干燥呢?还原性气体(如H2S、HBr、HI)、碱性气体(如NH3)。【问题3】SO2有较强的还原性,能否用浓H2SO4来干燥呢?H2、CO呢?均可。SO2中S元素为+4价,同种元素的相邻价态不能发生氧化还原反应;H2、CO在高温条件下才有较强的还原性。【问题5】浓H2SO4滴在干燥的蓝色石蕊试纸上,可能会有什么现象?如果是试纸是湿润的,又可能有什么现象?【问题4】课本实验的两个细节:
1、“黑面包”实验:观察的白烟是什么?
2、铜与浓H2SO4共热实验:小试管口处棉花团的作用?SO2 + H2O = H2SO3,白烟是亚硫酸的酸雾。用NaOH溶液浸湿的棉花团的作用是吸收多余的SO2,防止污染空气。试纸干燥:先变红,后变黑;试纸湿润:变红。
如果是氯水呢?【问题6】如何鉴别失去标签的浓H2SO4和浓HCl?1、摇动,粘稠油状者为浓H2SO4;
2、打开瓶盖,瓶口出现白雾者为浓HCl;
3、打开瓶盖,露置空气中一段时间,质量增加者为浓H2SO4,质量减少者为浓HCl;
4、分别取少量试样,分装两支试管中,各投入一小块Fe片,产生气泡者为浓HCl;
5、能使纸张或棉花等变黑者为浓H2SO4;1、取等体积的两种试样,质量较重者为浓H2SO4;
2、露置空气中一段时间,质量增加者为浓H2SO4;
3、能使纸张、棉花等变黑者为浓H2SO4;
4、常温下,能和Fe片反应产生气泡者为稀H2SO4;
5、加水稀释,放出大量的热,为浓H2SO4;
6、能使胆矾晶体失去结晶水者为浓H2SO4;
7、加热能与铜反应者为浓H2SO4。【问题7】如何鉴别失去标签的浓H2SO4和稀H2SO4?【问题8】1、回忆金属与浓H2SO4反应的一般规律,试描述足量的金属锌跟一定量的浓H2SO4反应的实验现象,写出化学方程式。
2、浓、稀H2SO4是否均有氧化性?分别是由哪种元素的化合价变化引起的?
3、浓、稀H2SO4是否均为氧化性酸?Zn + 2H2SO4(浓)= ZnSO4 + SO2↑ + 2H2O
Zn + H2SO4 = ZnSO4 + H2↑均有氧化性。浓H2SO4中主要存在H2SO4分子,+6价的S在反应中被还原,而稀H2SO4则完全电离出H+,H+被还原。浓H2SO4是氧化性酸,稀H2SO4具有一定的氧化性,但不是氧化性酸。【问题9】组装一套实验装置,验证木炭与浓H2SO4反应的产物。一套完整的实验装置,应包括发生装置、性质实验装置、收集装置、尾气处理装置等。产物用何种试剂检验CO2
SO2
H2O用何种仪器或装置澄清石灰水
品红溶液
无水CuSO4洗气瓶
洗气瓶
硬质玻璃管或双通管检验顺序?1、A处反应中,浓H2SO4的作用是 ;
2、若将连接顺序改为②、①、③,则可检出的物质是
,不能检出的物质是 ;
3、若将连接顺序改为①、③、②或②、③、①又如何?只作氧化剂【问题10】由以上实验,归纳SO42-的检验方法。对其合理性作出评价。可能是AgCl排除Ag+、CO32-、SO32-能否将稀HCl改为稀HNO3?BaCl2能否改为Ba(NO3)2?【练习1】下列描述反映了硫酸的哪些主要性质:
⑴浓H2SO4滴在木条上,过一会儿,木条变黑;
⑵敞口放置浓H2SO4时,质量增加;
⑶锌粒投入稀H2SO4中,有气泡产生;
⑷把铜片放入浓H2SO4中加热,有气体产生;
⑸利用浓H2SO4和食盐固体反应制备HCl气体;
⑹浓H2SO4不能用来干燥H2S、HBr、HI气体;
⑺利用FeS与稀H2SO4反应制备H2S气体;
⑻浓H2SO4可用铁制或铝制的容器来贮运。脱水性吸水性酸性强氧化性难挥发性强氧化性强酸性强氧化性【练习2】向50 mL 18 mol/L的H2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A、小于0.45 mol B、等于0.45 mol
C、在0.45~0.90mol之间 D、大于0.45 mol
【练习3】为方便某些化学计算,有人将98%浓H2SO4表示成下列形式,其中合理的是( )
A、H2SO4·1/9H2O B、H2SO4·H2O
C、H2SO4·SO3 D、SO3·10/9H2OA、DA
