硫酸[下学期]
图片预览






文档简介
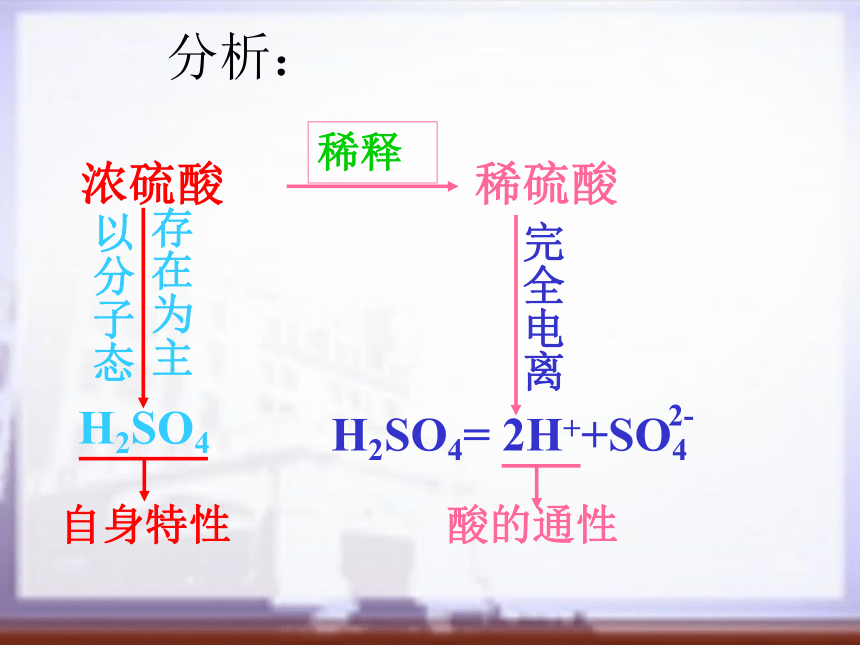
课件20张PPT。第三节 硫酸二零零五年四月十五号延长中学高一化学 崔安穰1.基础知识:(1)记住硫酸的物理性质;(2)理解硫酸的化学性质,尤其是浓硫酸的特性;(3)会写浓硫酸与铜、碳反应的化学方程式;(4)记住硫酸的用途。2.能力培养:学会全面观察、分析实验,提 高观察、实验、思维和自学能力。教学目标硫酸是一种__色___状___体.常用的浓硫酸中 H2SO4的质量分数为______,若其密度为1.84g/cm3,则其物质的量浓度为_____mol/L。硫酸是一种高沸点__挥发的酸,___溶于水,能以_____比与水混溶。浓硫酸溶解时释放大量的热,因此稀释浓硫酸的时候一定要__________________________________(为什么?)。一、硫酸的物理性质:浓硫酸稀硫酸 H2SO4自身特性完全电离酸的通性分析:一、硫酸
1、具有酸的通性 H2SO4==2H++SO42-
(1)使指示剂变色:石蕊变红,酚酞不变色
(2)与活泼金属反应生成氢气:
Zn+2H+=Zn2++H2 ↑
(3)与碱性氧化物反应:CuO+2H+=Cu2++H2O
(4)与碱反应:Fe(OH)3+3H+=Fe3++3H2O
(5)与盐反应:CO32-+2H+=H2O+CO2 ↑
1、用玻璃棒蘸取浓硫酸放于纸上
2、在硫酸铜晶体中滴加浓硫酸,有何现象?
3、取10g蔗糖放入小烧杯中,用2mL水调成糊状,再加入1mL浓硫酸,用玻璃棒搅拌。
实验探究:(白纸变黑)(蓝色晶体变为白色,溶液仍为无色)(蔗糖变黑,体积膨胀疏松,有刺激性气味,
有气体产生)
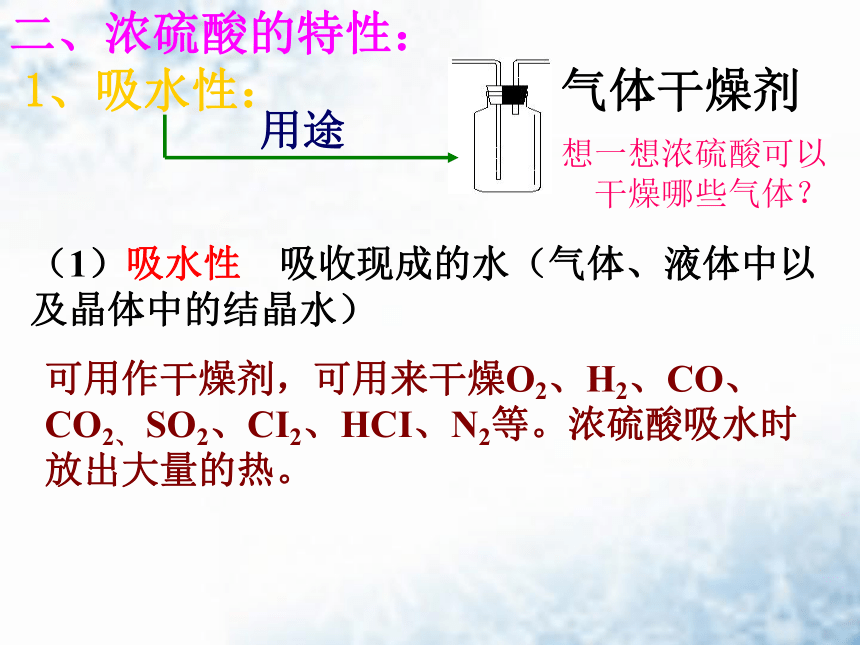
二、浓硫酸的特性:1、吸水性:气体干燥剂用途想一想浓硫酸可以
干燥哪些气体?(1)吸水性 吸收现成的水(气体、液体中以及晶体中的结晶水)可用作干燥剂,可用来干燥O2、H2、CO、CO2、 SO2、CI2、HCI、N2等。浓硫酸吸水时放出大量的热。
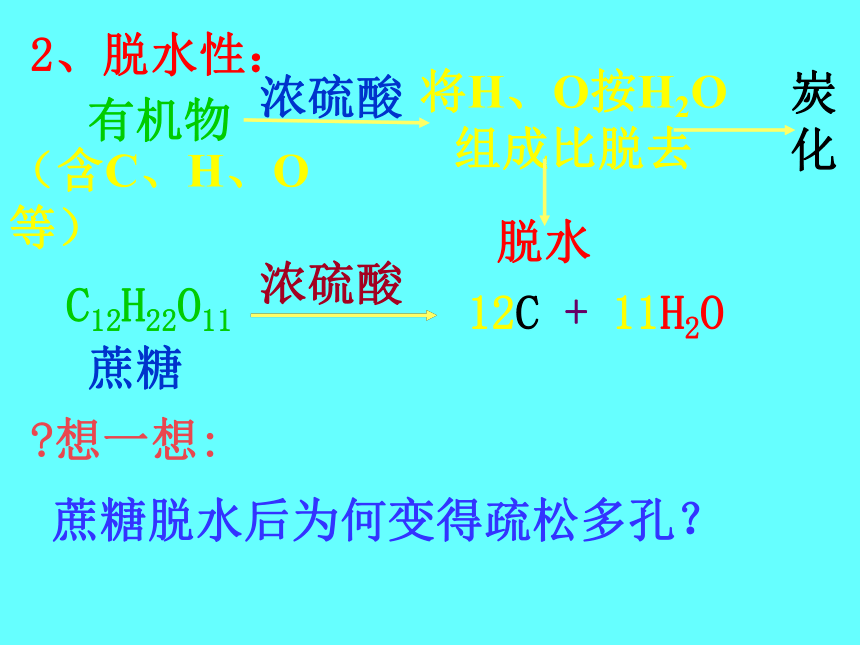
2、脱水性:?想一想:蔗糖脱水后为何变得疏松多孔?3、强氧化性(1)与某些固态非金属单质的反应:C + 2H2SO4(浓)==△S + 2H2SO4(浓)==△3SO2↑+ 2H2O既是氧化产物 又是还原产物CO2↑+ 2SO2↑+2H2O2P+5H2SO4 (浓) ===2H3PO4+5SO2 ↑ +2H2O
浓硫酸在和铜反应中的性质体现:1.体现氧化性:2.体现酸性:CuO+H2SO4==CuSO4+H2O(2)与金属反应?思考:1.1molCu 和2molH2SO4(浓)共热能否得到1molSO2?
2.浓硫酸的作用?与铜反应(演示实验)答案硫酸与铜反应的实验装置示意图:请你描述一下铜和浓硫酸反应的现象。
1.固体变小
2.有气体生成
3.溶液由无色变成蓝色?想一想:1、工业上为何能用铝槽车盛放、运输浓硫酸?(2)与金属反应a)加热时,与绝大多数金属反应(不产生H2)与活泼金属(如Zn)反应b)常温下,但Al Fe发生钝化表面生成致密的氧化物薄膜(3)与某些化合物反应(还原性较强的物质)4SO2 ↑ +3H2OI2+SO2 ↑ +K2SO4+2H2OFe2(SO4)3+SO2 ↑ +4H2OH2S+H2SO4(浓)=== S + SO2↑ +2H2O复习小结:强酸性— 酸的通性稀硫酸
浓硫酸
硫酸吸水性— 干燥剂
脱水性— 炭化
强氧化性与金属反应
与非金属反应
与还原性化合
物反应1.在常温下,下列物质可盛放在铁制的容器中的是( )
A.?? 盐酸 B.稀硫酸
C. 浓硫酸 D.硫酸铜溶液2.浓硫酸能与碳,硫等非金属单质反应,因为它是( )
A.?? 强氧化剂 B.不挥发性酸
C. 强酸 D.脱水剂
练习:CA(3)下列物质久置在敞口容器中, 质量会增加的是( )A.?? 浓硫酸 B.浓盐酸
C. 碳酸钠晶体 D.氯化钠
A思考题:下列现象体现了硫酸的哪些性质?(1) 把浓硫酸滴入放在蒸发皿里的蔗糖上,蔗糖就会炭化变黑
(2) 把浓硫酸露置在空气里,质量会增加。(3) 把锌粒放入稀硫酸里,会产生氢气。(4) 把铜片放入浓硫酸里并加热,会产生SO2。脱水性吸水性酸性强氧化性常温下:
2Al+3H2SO4(浓)=Al2O3+3SO2 ↑ +3H2O
Al2O3是一层致密的氧化膜,H2SO4难以再跟内部的金属继续反应。我们把这种现象叫做钝化。总结:浓硫酸与金属的反应,把金属氧化成最高价态,而硫酸被还原成SO2,反应中无H2。冷、浓硫酸与Fe、Al反应时,发生钝化。
1、具有酸的通性 H2SO4==2H++SO42-
(1)使指示剂变色:石蕊变红,酚酞不变色
(2)与活泼金属反应生成氢气:
Zn+2H+=Zn2++H2 ↑
(3)与碱性氧化物反应:CuO+2H+=Cu2++H2O
(4)与碱反应:Fe(OH)3+3H+=Fe3++3H2O
(5)与盐反应:CO32-+2H+=H2O+CO2 ↑
1、用玻璃棒蘸取浓硫酸放于纸上
2、在硫酸铜晶体中滴加浓硫酸,有何现象?
3、取10g蔗糖放入小烧杯中,用2mL水调成糊状,再加入1mL浓硫酸,用玻璃棒搅拌。
实验探究:(白纸变黑)(蓝色晶体变为白色,溶液仍为无色)(蔗糖变黑,体积膨胀疏松,有刺激性气味,
有气体产生)
二、浓硫酸的特性:1、吸水性:气体干燥剂用途想一想浓硫酸可以
干燥哪些气体?(1)吸水性 吸收现成的水(气体、液体中以及晶体中的结晶水)可用作干燥剂,可用来干燥O2、H2、CO、CO2、 SO2、CI2、HCI、N2等。浓硫酸吸水时放出大量的热。
2、脱水性:?想一想:蔗糖脱水后为何变得疏松多孔?3、强氧化性(1)与某些固态非金属单质的反应:C + 2H2SO4(浓)==△S + 2H2SO4(浓)==△3SO2↑+ 2H2O既是氧化产物 又是还原产物CO2↑+ 2SO2↑+2H2O2P+5H2SO4 (浓) ===2H3PO4+5SO2 ↑ +2H2O
浓硫酸在和铜反应中的性质体现:1.体现氧化性:2.体现酸性:CuO+H2SO4==CuSO4+H2O(2)与金属反应?思考:1.1molCu 和2molH2SO4(浓)共热能否得到1molSO2?
2.浓硫酸的作用?与铜反应(演示实验)答案硫酸与铜反应的实验装置示意图:请你描述一下铜和浓硫酸反应的现象。
1.固体变小
2.有气体生成
3.溶液由无色变成蓝色?想一想:1、工业上为何能用铝槽车盛放、运输浓硫酸?(2)与金属反应a)加热时,与绝大多数金属反应(不产生H2)与活泼金属(如Zn)反应b)常温下,但Al Fe发生钝化表面生成致密的氧化物薄膜(3)与某些化合物反应(还原性较强的物质)4SO2 ↑ +3H2OI2+SO2 ↑ +K2SO4+2H2OFe2(SO4)3+SO2 ↑ +4H2OH2S+H2SO4(浓)=== S + SO2↑ +2H2O复习小结:强酸性— 酸的通性稀硫酸
浓硫酸
硫酸吸水性— 干燥剂
脱水性— 炭化
强氧化性与金属反应
与非金属反应
与还原性化合
物反应1.在常温下,下列物质可盛放在铁制的容器中的是( )
A.?? 盐酸 B.稀硫酸
C. 浓硫酸 D.硫酸铜溶液2.浓硫酸能与碳,硫等非金属单质反应,因为它是( )
A.?? 强氧化剂 B.不挥发性酸
C. 强酸 D.脱水剂
练习:CA(3)下列物质久置在敞口容器中, 质量会增加的是( )A.?? 浓硫酸 B.浓盐酸
C. 碳酸钠晶体 D.氯化钠
A思考题:下列现象体现了硫酸的哪些性质?(1) 把浓硫酸滴入放在蒸发皿里的蔗糖上,蔗糖就会炭化变黑
(2) 把浓硫酸露置在空气里,质量会增加。(3) 把锌粒放入稀硫酸里,会产生氢气。(4) 把铜片放入浓硫酸里并加热,会产生SO2。脱水性吸水性酸性强氧化性常温下:
2Al+3H2SO4(浓)=Al2O3+3SO2 ↑ +3H2O
Al2O3是一层致密的氧化膜,H2SO4难以再跟内部的金属继续反应。我们把这种现象叫做钝化。总结:浓硫酸与金属的反应,把金属氧化成最高价态,而硫酸被还原成SO2,反应中无H2。冷、浓硫酸与Fe、Al反应时,发生钝化。
