硫酸、硝酸和氨[上学期]
文档属性
| 名称 | 硫酸、硝酸和氨[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 903.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-12-01 00:00:00 | ||
图片预览





文档简介
课件19张PPT。第四章非金属及其化合物
第四节
硫酸、硝酸和氨(2)学习目标: 1、了解氨的重要性质、用途和实验室制法。
2、学习用实验研究物质性质的方法和用对比法学习化学物质性质的方法。
重点:氨的化学性质。
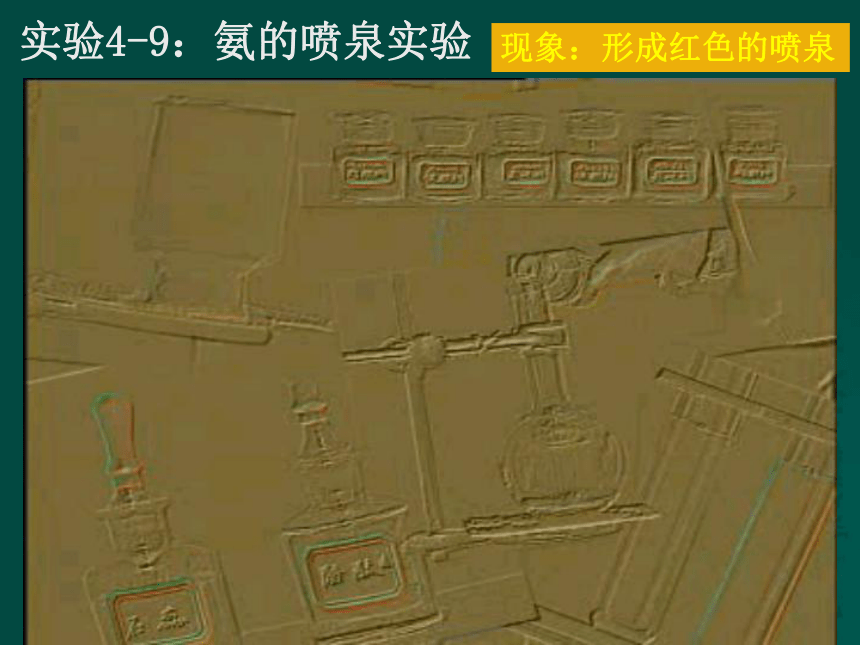
难点:氨的化学性质。氮气最重要的用途是什么? 氨在自然界中,是动物体,特别是蛋白质腐败的产物。 在日常生活中,在哪里最易闻到氨的气味?实验4-9:氨的喷泉实验现象:形成红色的喷泉实验4-9:现象:烧杯中的水溶液经导管进入烧瓶,形成喷泉,无色溶液进入烧瓶后变为红色。 讨论:(1)烧杯中的水溶液为什么会自动
地进入烧瓶?说明了什么?
(2)无色溶液进入烧瓶后变成了红
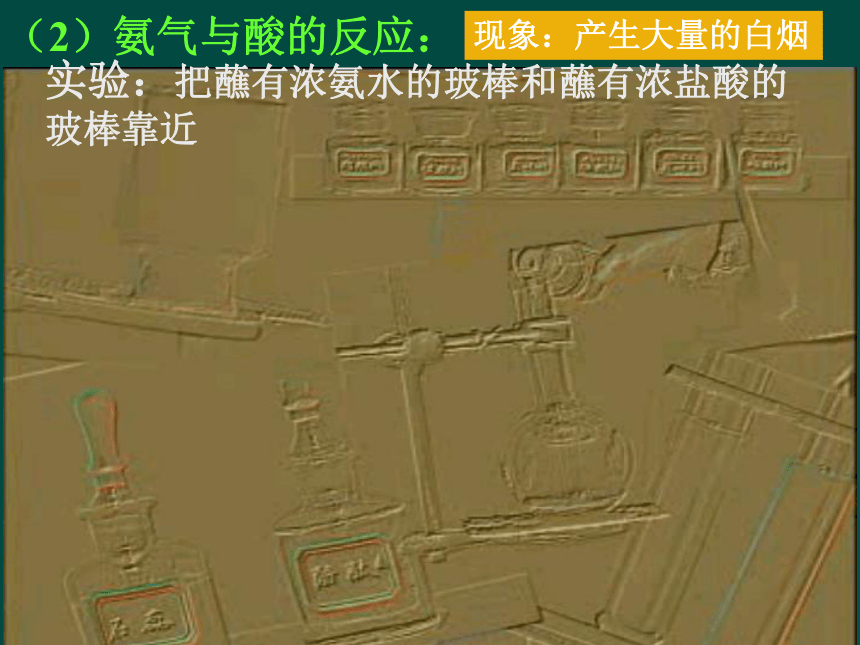
色,说 明了什么问题?结论: 氨气极易溶于水,氨水呈碱性。二、氨(NH3) 氨气是一种无色、有剌激性气味、比空气轻、极易溶于水(在常温常压下1:700)、易液化的气体。2、氨气的化学性质-31、氨气的物理性质(1)氨气与水的反应 氨气溶于水时,大部分与水结合成“一水合氨”; NH3 + H2O NH3?H2ONH4++OH-一水合氨部分电离实验:把蘸有浓氨水的玻棒和蘸有浓盐酸的玻棒靠近现象:产生大量的白烟(2)氨气与酸的反应:(2)氨气与酸的反应
NH3 + HCl ==NH4Cl
2NH3 + H2SO4==(NH4)2SO4
NH3 + HNO3 == NH4NO3
2NH3 + H2O+CO2 == (NH4)2CO3
NH3 + H2O+CO2 == NH4HCO33、铵盐都易溶于水,受热易分解,与碱反应可产生氨气。 ——生成铵盐4、NH3的实验室制法(1)反应原理:氨气的实验室制法 (4)收集方法 :向下排空气法注意:收集时在容器口要塞一团棉花,用湿润的
红色石蕊试纸来检验是否收集满。5、NH3的用途:见P.88(3)净化(干燥):碱石灰(干燥管)
注意:不能用无水CaCl2做干燥剂P.88 思考与交流——讨论氮的固定??思考与练习 为什么氨常用作致冷剂?还有哪些物质也可作致冷剂? 氨易液化(沸点-33. 35 ℃) 还有氯气(沸点-34. 6 ℃) 二氧化硫(沸点-10 ℃)请比较 氨、 氯化氢、 二氧化硫 和 氯气 的溶解度。1:7001:5001:401:2常温常压经常比较和归类,是学习化学的一种好方法思考与练习 在氨的喷泉实验中,为什么能形成红色的喷泉? ⑴ 由于氨气极易溶于水,使烧瓶内气压急剧下降。 氨水中含少量氢氧根离子,呈弱碱性,故能使酚酞试液变红。 喷泉停止后,为什么烧瓶不能被水完全充满? 由于氨气是用向下排空气法收集的,一定含有少量空气。思考与练习 在氨的喷泉实验中,烧瓶内溶液的物质的量浓度是多少?(假设实验是在标准状况下进行) 氨气体积设为VL 注意:氨水中溶质是NH3,不是NH3·H2O ; 氨气物质的量为(V/22.4)mol 氨水溶液体积也是VL 氨水的物质的量浓度为: C=(V/22.4)/V= 0.045 mol/L 氨水浓度越大,密度越小。思考与练习 某学生用氨做喷泉实验,结果实验失败,请
你分析实验失败的可能原因? 氨气中含有大量的空气 收集氨气的烧瓶潮湿 装置漏气思考与练习 检验氨气可用哪些方法? NH3 + HCl = NH4Cl 蘸有浓氨水的玻璃棒与蘸有其它何种酸的玻
璃棒相遇能形成白烟?浓硫酸可以吗?浓硝酸可
以吗?为什么? ⑴ 能使湿润的红色石蕊试纸变蓝 ⑵ 和氯化氢在空气中相遇,产生白烟。思考与练习 氨催化氧化(接触氧化)是工业制硝酸的
基础,请写出用氨制取硝酸的化学方程式。 2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO 思考与练习 氨在纯氧中能燃烧:请写出氨与氯气反应的化学方程式。 如果氨气过量,反应的化学方程式是: 可以用浓氨水检验氯气管道是否漏气布置作业:P.89 1、2、3、4、8
2、学习用实验研究物质性质的方法和用对比法学习化学物质性质的方法。
重点:氨的化学性质。
难点:氨的化学性质。氮气最重要的用途是什么? 氨在自然界中,是动物体,特别是蛋白质腐败的产物。 在日常生活中,在哪里最易闻到氨的气味?实验4-9:氨的喷泉实验现象:形成红色的喷泉实验4-9:现象:烧杯中的水溶液经导管进入烧瓶,形成喷泉,无色溶液进入烧瓶后变为红色。 讨论:(1)烧杯中的水溶液为什么会自动
地进入烧瓶?说明了什么?
(2)无色溶液进入烧瓶后变成了红
色,说 明了什么问题?结论: 氨气极易溶于水,氨水呈碱性。二、氨(NH3) 氨气是一种无色、有剌激性气味、比空气轻、极易溶于水(在常温常压下1:700)、易液化的气体。2、氨气的化学性质-31、氨气的物理性质(1)氨气与水的反应 氨气溶于水时,大部分与水结合成“一水合氨”; NH3 + H2O NH3?H2ONH4++OH-一水合氨部分电离实验:把蘸有浓氨水的玻棒和蘸有浓盐酸的玻棒靠近现象:产生大量的白烟(2)氨气与酸的反应:(2)氨气与酸的反应
NH3 + HCl ==NH4Cl
2NH3 + H2SO4==(NH4)2SO4
NH3 + HNO3 == NH4NO3
2NH3 + H2O+CO2 == (NH4)2CO3
NH3 + H2O+CO2 == NH4HCO33、铵盐都易溶于水,受热易分解,与碱反应可产生氨气。 ——生成铵盐4、NH3的实验室制法(1)反应原理:氨气的实验室制法 (4)收集方法 :向下排空气法注意:收集时在容器口要塞一团棉花,用湿润的
红色石蕊试纸来检验是否收集满。5、NH3的用途:见P.88(3)净化(干燥):碱石灰(干燥管)
注意:不能用无水CaCl2做干燥剂P.88 思考与交流——讨论氮的固定??思考与练习 为什么氨常用作致冷剂?还有哪些物质也可作致冷剂? 氨易液化(沸点-33. 35 ℃) 还有氯气(沸点-34. 6 ℃) 二氧化硫(沸点-10 ℃)请比较 氨、 氯化氢、 二氧化硫 和 氯气 的溶解度。1:7001:5001:401:2常温常压经常比较和归类,是学习化学的一种好方法思考与练习 在氨的喷泉实验中,为什么能形成红色的喷泉? ⑴ 由于氨气极易溶于水,使烧瓶内气压急剧下降。 氨水中含少量氢氧根离子,呈弱碱性,故能使酚酞试液变红。 喷泉停止后,为什么烧瓶不能被水完全充满? 由于氨气是用向下排空气法收集的,一定含有少量空气。思考与练习 在氨的喷泉实验中,烧瓶内溶液的物质的量浓度是多少?(假设实验是在标准状况下进行) 氨气体积设为VL 注意:氨水中溶质是NH3,不是NH3·H2O ; 氨气物质的量为(V/22.4)mol 氨水溶液体积也是VL 氨水的物质的量浓度为: C=(V/22.4)/V= 0.045 mol/L 氨水浓度越大,密度越小。思考与练习 某学生用氨做喷泉实验,结果实验失败,请
你分析实验失败的可能原因? 氨气中含有大量的空气 收集氨气的烧瓶潮湿 装置漏气思考与练习 检验氨气可用哪些方法? NH3 + HCl = NH4Cl 蘸有浓氨水的玻璃棒与蘸有其它何种酸的玻
璃棒相遇能形成白烟?浓硫酸可以吗?浓硝酸可
以吗?为什么? ⑴ 能使湿润的红色石蕊试纸变蓝 ⑵ 和氯化氢在空气中相遇,产生白烟。思考与练习 氨催化氧化(接触氧化)是工业制硝酸的
基础,请写出用氨制取硝酸的化学方程式。 2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO 思考与练习 氨在纯氧中能燃烧:请写出氨与氯气反应的化学方程式。 如果氨气过量,反应的化学方程式是: 可以用浓氨水检验氯气管道是否漏气布置作业:P.89 1、2、3、4、8
