无机化学物主角---硅[下学期]
文档属性
| 名称 | 无机化学物主角---硅[下学期] | 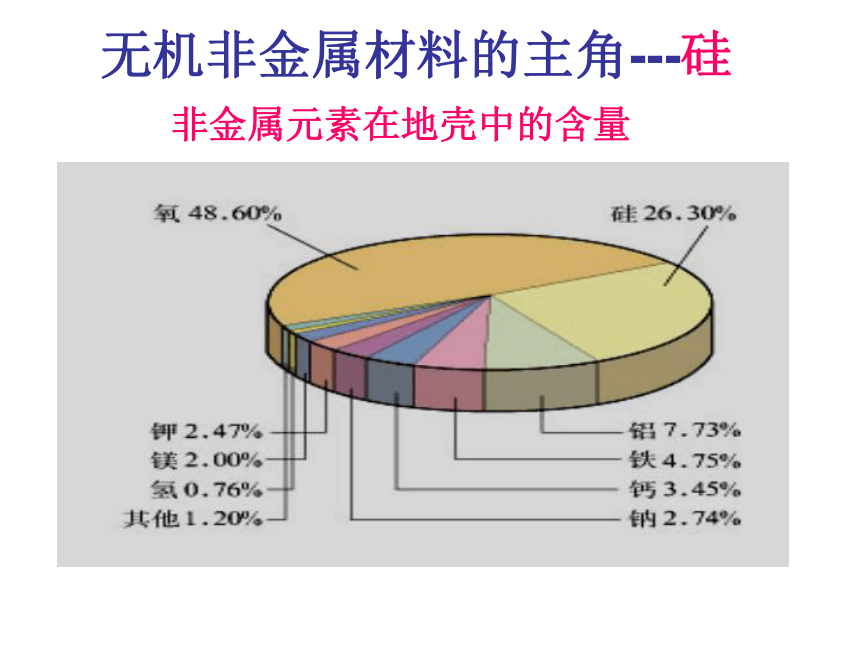 | |
| 格式 | rar | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-11-05 15:58:00 | ||
图片预览



文档简介
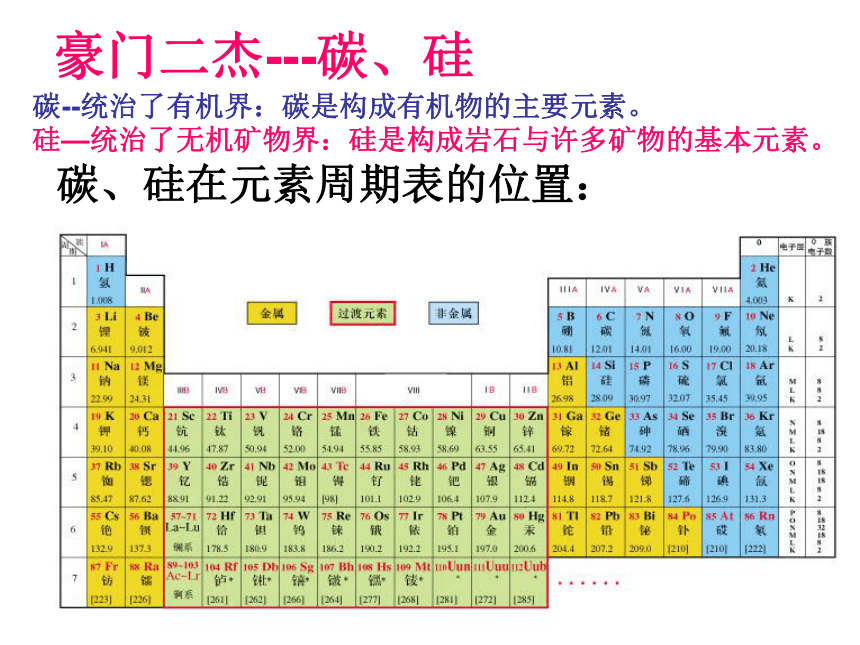
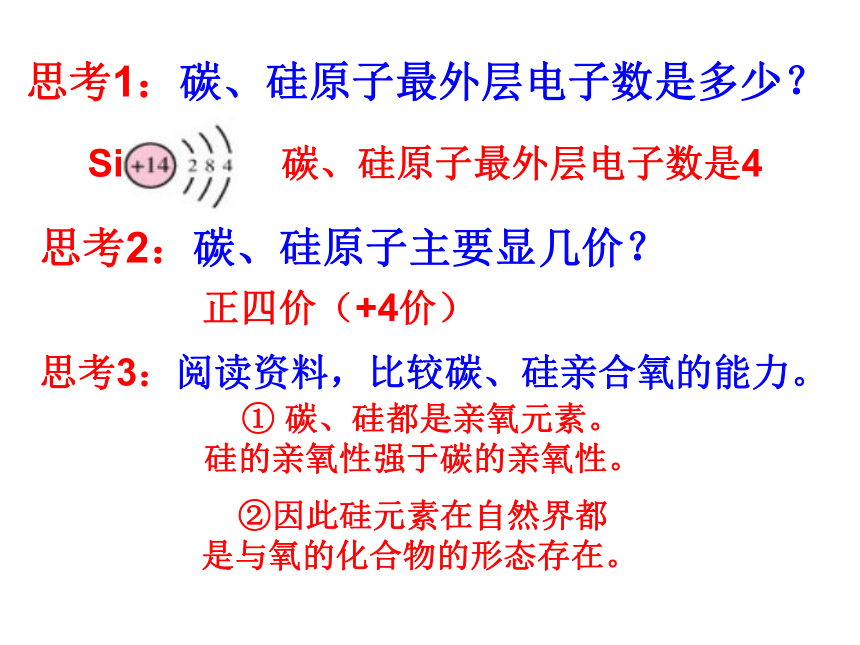
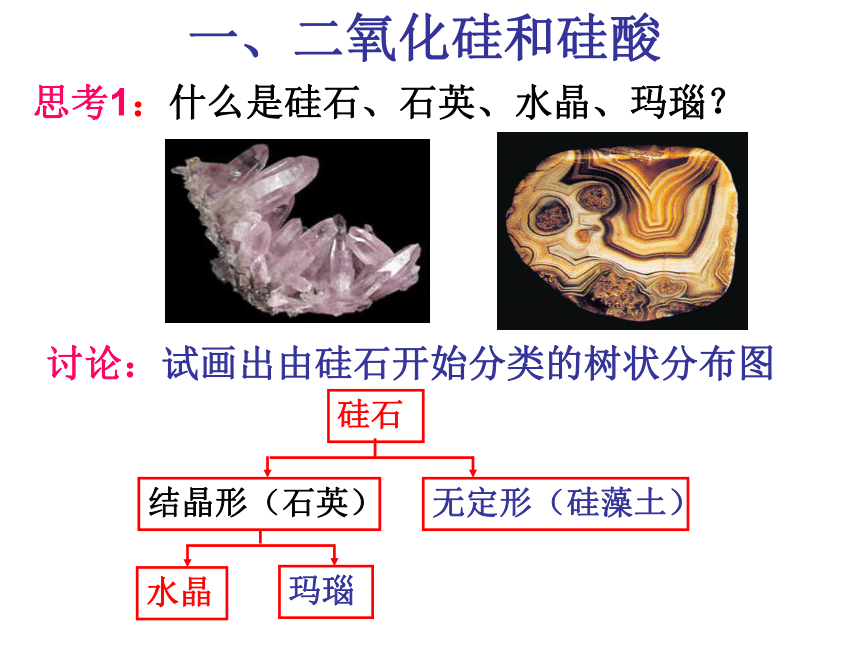
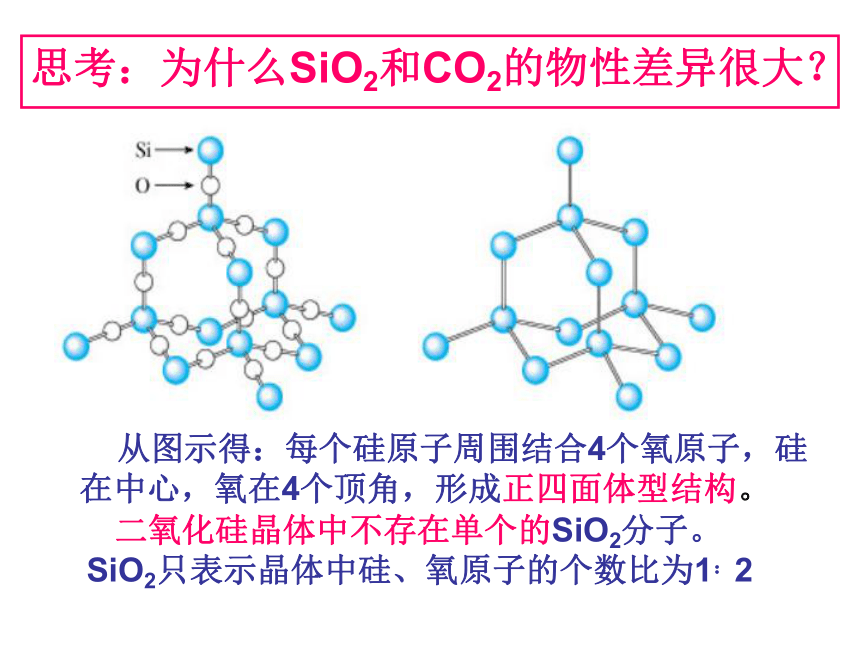
课件17张PPT。无机非金属材料的主角---硅非金属元素在地壳中的含量硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。 豪门二杰---碳、硅碳--统治了有机界:碳是构成有机物的主要元素。硅—统治了无机矿物界:硅是构成岩石与许多矿物的基本元素。 碳、硅在元素周期表的位置:思考1:碳、硅原子最外层电子数是多少?Si碳、硅原子最外层电子数是4思考2:碳、硅原子主要显几价?正四价(+4价)思考3:阅读资料,比较碳、硅亲合氧的能力。 ① 碳、硅都是亲氧元素。 硅的亲氧性强于碳的亲氧性。 ②因此硅元素在自然界都是与氧的化合物的形态存在。一、二氧化硅和硅酸思考1:什么是硅石、石英、水晶、玛瑙?讨论:试画出由硅石开始分类的树状分布图硅石结晶形(石英)无定形(硅藻土)水晶玛瑙思考:为什么SiO2和CO2的物性差异很大? 从图示得:每个硅原子周围结合4个氧原子,硅在中心,氧在4个顶角,形成正四面体型结构。 二氧化硅晶体中不存在单个的SiO2分子。 SiO2只表示晶体中硅、氧原子的个数比为1:2 思考:二氧化硅具有哪些物理性质?
化学稳定性如何?你的根据是什么?
SiO2的这些性质是由什么决定的?物理性质:难溶于水,熔点高,硬度大。化学性质:化学性质很稳定,不活泼原因:SiO2的这些性质主要与它的结构有关, SiO2是正四面体的空间网状结构,因此性质很稳定 SiO2的化学性质—性质稳定, 不活泼①难溶于水,不与水反应 ②不与酸反应(除氢氟酸以外)SiO2 + 4HF == SiF4 + 2H2O ③是酸性氧化物SiO2 + CaO === CaSiO3 SiO2 + 2NaOH == Na2SiO3 + H2O高温 思考: 实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞,你知道为什么吗? 防止玻璃中的SiO2与NaOH溶液反应生成粘稠的Na2SiO3,使瓶塞和瓶口粘在一起 由于SiO2具有优良的物理化学性能,加上SiO2在自然界的广泛存在,因此从古到今都被人类广泛地应用着2.硅酸(H2SiO3) 实验1:向饱和Na2SiO3溶液中,滴入酚酞,再滴入稀盐酸现象结论方程式 滴入酚酞溶液呈红色,滴入盐酸有透明的硅酸凝胶产生 Na2SiO3呈碱性,硅酸难溶于水Na2SiO3+2HCl = H2SiO3+2NaCl思考:怎样由石英制取硅酸?实验2:将CO2通入Na2SiO3溶液中现象:有白色胶状沉淀生成方程式:Na2SiO3+H2O+CO2==H2SiO3+Na2CO3结论:硅酸是一种很弱的酸,酸性比碳酸还弱 硅酸凝胶经干燥脱水就形成干胶,称为“硅胶”。是一种常用的干燥剂二、硅酸盐硅酸盐的结构很复杂,一般都不溶于水。 最简单的硅酸盐是硅酸钠(Na2SiO3),其水溶液 俗称为水玻璃,可用作肥皂填料、木材防火剂等放入蒸馏水现象结论水份蒸发后燃烧放入Na2SiO3溶液水份蒸发后不燃烧水份蒸发后,失去防火作用防火效果好用作防火剂无机非金属材料硅酸盐产品陶瓷水泥玻璃传统无机非金属材料:陶瓷、玻璃、水泥新型无机非金属材料:新型陶瓷高温结构陶瓷、压电陶瓷透明陶瓷、超导陶瓷等三、硅单质1.制法SiO2 + 2C === Si + 2CO2.物性 结构类似金刚石,为硬而脆的灰黑色固体, 熔点高,硬度大。3.化性在常温下化学性质不活泼高温Si + O2 === SiO24.用途 晶体硅的导电性介于导体和半导体之间,是良好的半导体材料,硅是信息技术的关键材料硅太阳能电池电脑的中央处理器(CPU)
