高一化学期前考[上学期]
图片预览


文档简介
2006-2007学年上期高一化学期前考
相对原子量 :Na:23 C:12 H:1 O:16 N:14 K:39 Ca:40 Cl:35.5 Mn:55 S:32 Ag:108 Mg:24 Fe:56
一.选择题(每题只有一个答案,每题2分,共24分)
1.下列物质能使紫色石蕊试液变红的是( )
A.稀盐酸 B.石灰水 C.食盐水 D.水
2.亚硒酸钠(Na2SeO3)能消除加速人体衰老的活性氧,其中硒(Se)的化合价为(?? ? )
A.+1 B.+4 C.+3 D.+2
3.关于氢氧化钠的性质,下列说法正确的是(?? ? )
① 能跟二氧化碳反应 ② 没有腐蚀性
③ 能跟盐酸发生中和反应 ④ 不能使无色酚酞试液变色
A.④ B.②④ C. ①③ D. ①②
4.某些花岗岩石材中含有放射性元素氡。一种氡原子的质子数为86,中子数为136,这种氡原子核外电子数为 (??? )
A.50??? B.86 ??? C.136??? D.222
5.某物质R与水和氧气发生化学反应为:2R+2H2O+7O2=2FeSO4+2H2SO4,推断R的化学式为(?? ? )
A.FeS B.Fe2S3 C.FeO D.FeS2
6.配制一定溶质质量分数的氯化钠溶液,操作顺序正确的是(?? ? )
A.计算、溶解、称量、量取 B.溶解、量取、计算、称量
C.计算、称量、量取、溶解 D.称量、量取、溶解、计算
7.下列制取物质的方案中,可以经过一步化学反应实现的是(?? ? )
A. 用铁和稀硫酸制取硫酸铁 B.用氯化铜和水制取氢氧化铜
C. 用铜和稀盐酸制取氯化铜 D.用生石灰和水制取熟石灰
8.已知60℃时硝酸钾的溶解度为110克。现有500克60℃的硝酸钾溶液,若蒸发掉10克水,温度恢复到60℃,不可能有的情况是(?? ? )
① 析出硝酸钾晶体的质量等于11克 ② 析出硝酸钾晶体的质量小于11克
③ 析出硝酸钾晶体的质量大于11克 ④ 没有硝酸钾晶体析出
A. ④ B. ②④ C. ③ D. ①②
9.下列实验室制取氧气的操作中,不正确的是(?? ? )
① 试管口略向下倾斜 ② 用排水法收集氧气
③ 铁夹夹持在试管的中上部 ④ 收集完毕,先停止加热再将导管移出水面
A. ④ B.②④
C. ①③ D. ①②
10.下列实验操作中错误的是( )
A、实验室制取气体,要先对装置的气密性进行检查
B、给玻璃仪器加热时都需垫石棉网
C、可燃性气体点燃之前必须检查其纯度
D、实验时多取的药品放入指定容器内
11.在水溶液中,一般不与其它物质发生复分解反应,这种物质是下列中的(?? ? )
A.KCl B.HNO3 C.NaNO3 D.Mg(OH)2
12.下列各组气体中,均能用固体氢氧化钠干燥的一组是(?? ? )
A.O2、CO、CO2 B.H2、O2、HCl
C.H2、SO2、CO D.H2、O2、CO
二.选择题(每题只有一个正确答案,每题3分,共21分)
13.下列认识或说法中正确的是( )
A、向某固体中加入稀盐酸有气泡产生,可证明该物质中一定含有CO32-
B、常温下可用Fe与AgCl反应制取Ag
C、可用过量的Cu(OH)2除去CuSO4溶液中少量的H2SO4
D、分别将Mg、Fe、Cu、Ag放入稀盐酸中,可确定它们的活动性顺序
14.现有四种白色固体:①氯化钠 ②氯化钡 ③无水硫酸铜 ④硫酸钠,不使用其它试剂(可以用水)就可以把它们区分开,区分出的先后顺序是(?? ? )
A.②③④① B. ②④③①
C.③①④② D. ③②④①
15. 某种铁的氧化物20克,在加热条件下通入足量的一氧化碳完全反应,将生成的气体用石灰水完全吸收,得到沉淀37.5克,则该氧化物中铁元素和氧元素的质量比为(?? ? )
A.7∶3 B.7∶2
C.2∶3 D.21∶8
16.某单质X能从某溶液中置换出单质Y,由此推断下列说法中正确的是(?? ? )
A.X一定是排在金属活动顺序表中氢以前的金属
B.X是金属时,Y可能是金属,也可能
C.X是金属时,Y一定是非金属
D.X、Y都是金属时,Y一定比X活泼
17.常用燃烧法测定有机物的组成。现取3.2g某有机物在足量氧气中充分燃烧,生成4.4gCO2和3.6gH2O,则该有机物中(? ?? )
A.一 定含有C、H两种元素,可能含有O元素?
B.一 定含有C、O两种元素,可能含有H元素
C.一 定含C、H、O三种元素?
D.只含有C、H两种元素,不含O元素
18.如图所示,将气体X和气体Y同时通入液体Z,最终一定能看到液体变浑浊的是(?? ? )
X
Y
Z
A
H2
N2
水
B
HCl
CO2
石灰水
C
CO2
O2
烧碱溶液
D
HCl
O2
硝酸银溶液
19.在H2+CuOCu+H2O反应中,铜元素由+2价变为0价,氢元素由0价变为+1价。这类有元素化合价升降的反应属于氧化还原反应。据此判断,以下反应中不属于氧化还原反应的是(?? ? )
A.S+O2SO2 ? B.3CO+Fe2O32Fe+3CO2
C.2KClO32KCl+3O2↑ D.Na2CO3+Ca(OH)2=CaCO3↓+2NaOH?
三.填空题(共50分)
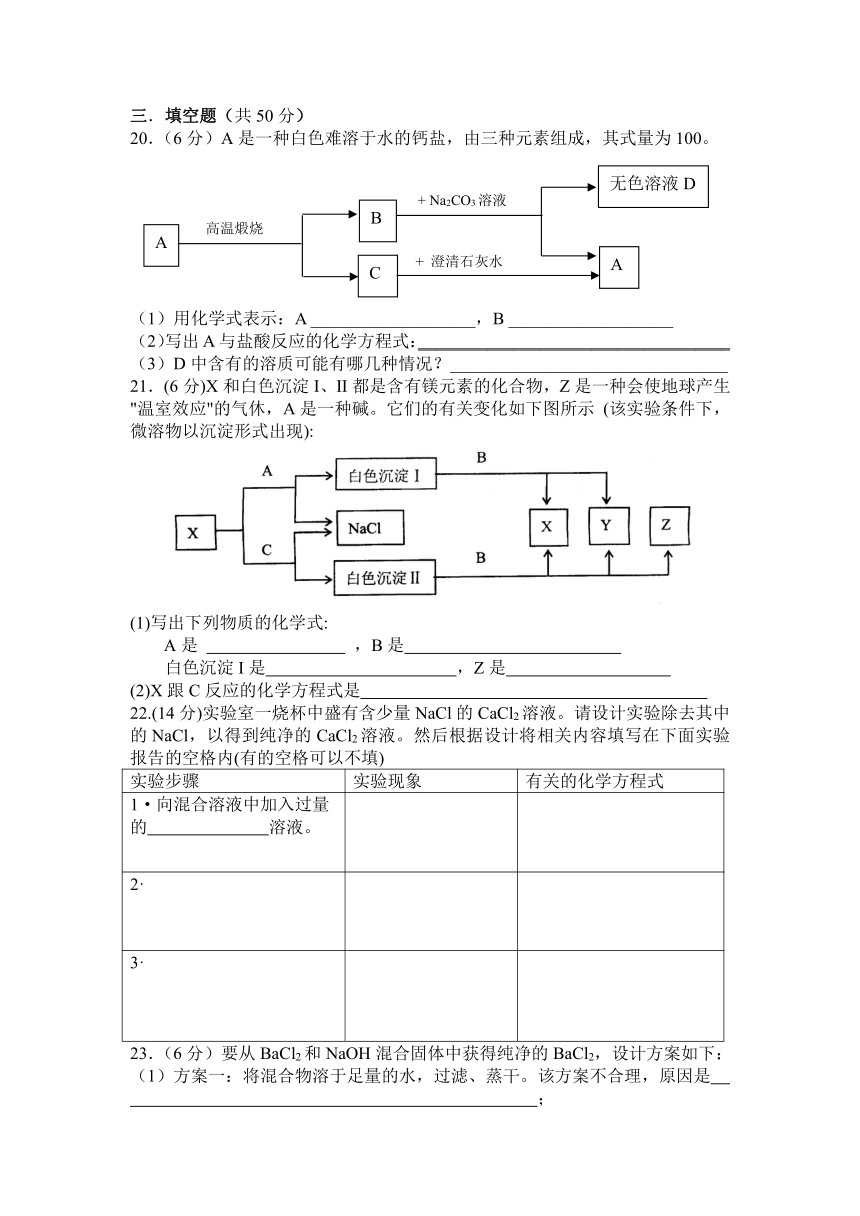
20.(6分)A是一种白色难溶于水的钙盐,由三种元素组成,其式量为100。
(1)用化学式表示:A ___________________,B ___________________
(2)写出A与盐酸反应的化学方程式:____________________________________
(3)D中含有的溶质可能有哪几种情况?________________________________
21.(6分)X和白色沉淀I、II都是含有镁元素的化合物,Z是一种会使地球产生"温室效应"的气休,A是一种碱。它们的有关变化如下图所示 (该实验条件下,微溶物以沉淀形式出现):
(1)写出下列物质的化学式:
A是 ,B是
白色沉淀I是 ,Z是
(2)X跟C反应的化学方程式是
22.(14分)实验室一烧杯中盛有含少量NaCl的CaCl2溶液。请设计实验除去其中的NaCl,以得到纯净的CaCl2溶液。然后根据设计将相关内容填写在下面实验报告的空格内(有的空格可以不填)
实验步骤
实验现象
有关的化学方程式
1·向混合溶液中加入过量
的 溶液。
2·
3·
23.(6分)要从BaCl2和NaOH混合固体中获得纯净的BaCl2,设计方案如下:
(1)方案一:将混合物溶于足量的水,过滤、蒸干。该方案不合理,原因是
;
(2)方案二,将混合物溶于足量的水,再加入适量的CuCl2溶液,充分反应后过滤、蒸干。该方案不合理的原因是 。
(3)合理的方案是:将混合物溶于足量的水,先用适量试剂①把BaCl2转化为含钡不溶物,过滤;再用足量试剂②将不溶物转化为BaCl2溶液,蒸干。所用试剂①和试剂②依次是 。
24.(8分)下图为常见的实验装置(各具用途),根据下列要求回答问题。装置可重复使用。提示: H2+CuOCu+H2O(填序号)
A B C D E
⑴将含水蒸气的氢气干燥后还原氧化铜,则该气体先要通过装置_____。
⑵如果验证混合体中有H2和H2O,需连接的仪器顺序是_______________。
⑶如果验证混合气体中有H2、CO和H2O ,则需连接的仪器顺序为__________。
⑷如果验证混合气体中有CO2、CO、H2,则需连接的仪器顺序是__________。
25.(10分)某中学化学实验室有如下图所示的实验装置,用于制取氧气或二氧化碳气体。
(1)若制取的一种气体是 ,应选用的发生装置是 (填序号,下同),,应选用的收集装置是 , 反应的化学方程式是 ;反应的基本类型属于 反应(选填“化合”或“分解”或“置换”或“复分解”)。检验所制取的气体的方法是: ;
(2)在常温下,用亚硫酸钠固体和稀硫酸制取二氧化硫气体,应选用的发生装置是: ;由于二氧化硫是易溶于水、密度比空气大的有毒气体,所以应用 装置进行收集,以便将尾气吸收处理,避免造成 。
四、计算题
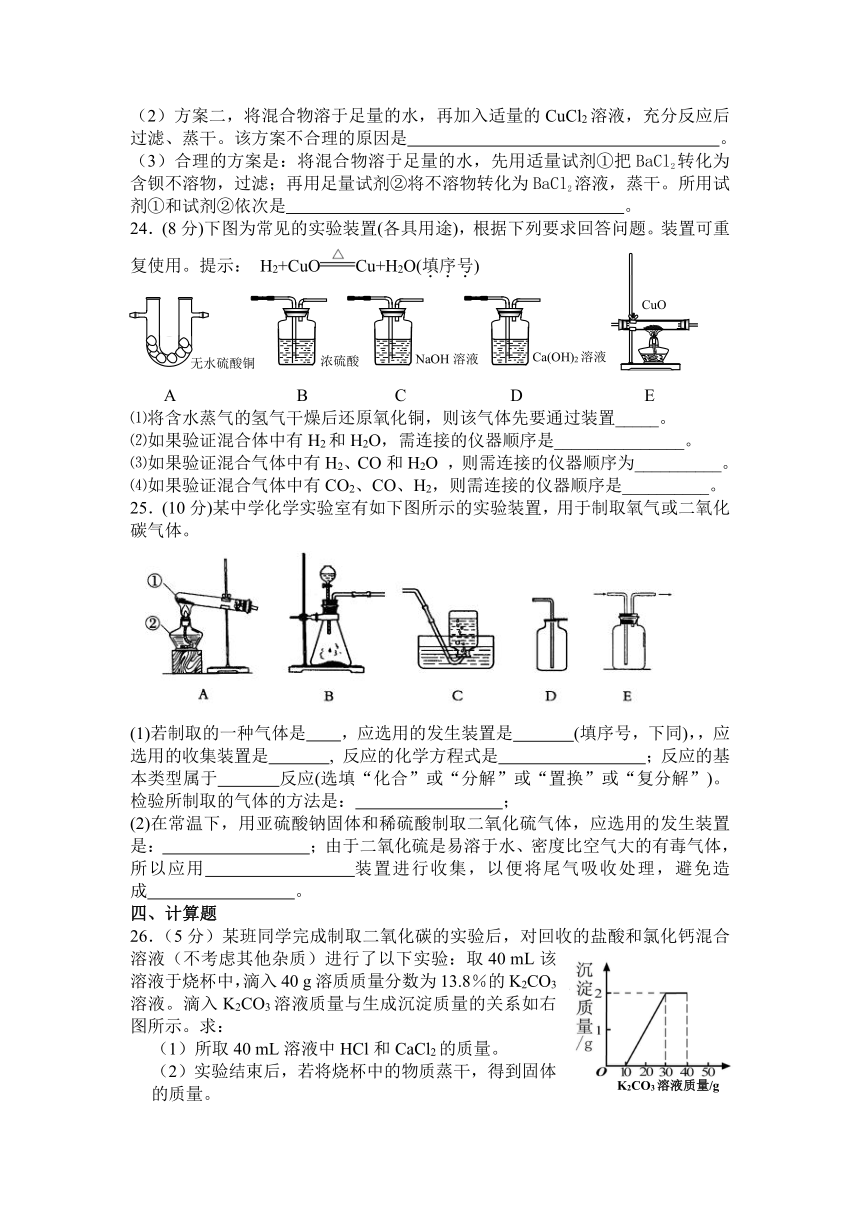
26.(5分)某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了以下实验:取40 mL该溶液于烧杯中,滴入40 g溶质质量分数为13.8%的K2CO3溶液。滴入K2CO3溶液质量与生成沉淀质量的关系如右图所示。求:
(1)所取40 mL溶液中HCl和CaCl2的质量。
(2)实验结束后,若将烧杯中的物质蒸干,得到固体的质量。
宝丰一高2006-2007学年上学期期前考答题卷
高一化学命题人:何占伟 2006-8-11
选择题答题卡(45分)
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
答案
三.填空题(共50分)
20.(1)A ___________________,B
(2)____________________________________
(3)
21.(1)A ____________,B I Z
(2)
22.
实验步骤
实验现象
有关的化学方程式
1·向混合溶液中加入过量
的 溶液。
2·
3·
23.(1)
(2)
(3)
24.(1) (2)
(3) (4)
25.(1)
(2)
四、计算题
26.(5分)某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了以下实验:取40 mL该溶液于烧杯中,滴入40 g溶质质量分数为13.8%的K2CO3溶液。滴入K2CO3溶液质量与生成沉淀质量的关系如右图所示。求:
(1)所取40 mL溶液中HCl和CaCl2的质量。
(2)实验结束后,若将烧杯中的物质蒸干,得到固体的质量。
宝丰一高2006-2007学年上学期期前考答题卷
高一化学命题人:何占伟 2006-8-11
选择题答题卡(45分)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
B
C
D
D
C
D
C
A
B
题号
11
12
13
14
15
16
17
18
19
答案
C
D
C
D
A
B
C
D
D
三.填空题(共50分)
20.(1)A、CaCO3,B、CaO(2)CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
(3)NaOH ; NaOH和Na2CO3 ; NaOH和Ca(OH)2
21.(1) NaOH HCl Mg(OH)2 MgCO3
(2) MgCl2+ Na2CO3 == MgCO3 +2NaCl
22.
实验步骤
实验现象
有关的化学方程式
1·向混合溶液中加入过量的 Na2CO3 溶液。
有白色沉淀生成
Na2CO3+CaCl2==CaCO3↓+2NaCl
2· 过滤、洗涤沉淀
3· 加入适量盐酸
沉淀溶解,有气泡生成
CaCO3+2HCl==CaCl2 +H2O +CO2↑
23.(1)BaCl2和NaOH都溶于水(2)无法除去Na+(3)碳酸钠溶液、盐酸(或用化学式表示、其它可溶性碳酸盐跟盐酸组合也可以)
24.⑴B ⑵ABEA ⑶ABEAD ⑷DCBEAD
25.(1)参考答案一:氧气(或O2);A(或B);C(或D或E) ;分解
2KClO32KCl+3O2↑
将带火星的木条伸到集气瓶里,木条复燃,证明瓶里的气体是氧气。
参考答案二:二氧化碳(CO2);B;D(或E)
2HCl+CaC03==CaCl2+H20+C02 ↑;复分解
倒人足量的澄清石灰水,振荡,石灰水变白色浑浊,证明瓶里的气体是二氧化碳。
(2))B;E;空气污染
四、计算题
26.解:设40 mL溶液中所含HCl和CaCl2的质量分别为x、y,K2CO3与HCl反应生成KCl的质量为m,K2CO3与CaCl2反应生成KCl的质量为n。
K2CO3 + 2HCl === 2KCl + H2O + CO2↑
138 73 149
10 g×13.8% x m
≈0.7 g
K2CO3 + CaCl2 === CaCO3↓ + 2KCl
111 100 149
y 2 g n
≈2.2 g
剩余K2CO3的质量为10 g×13.8%=1.38 g
固体的质量为1.49 g+2.98 g+1.38 g + 2 g=7.85 g≈7.9 g
答:40 mL溶液中所含HCl和CaCl2的质量分别为0.7 g、2.2 g,得到固体的质量为7.9 g。
相对原子量 :Na:23 C:12 H:1 O:16 N:14 K:39 Ca:40 Cl:35.5 Mn:55 S:32 Ag:108 Mg:24 Fe:56
一.选择题(每题只有一个答案,每题2分,共24分)
1.下列物质能使紫色石蕊试液变红的是( )
A.稀盐酸 B.石灰水 C.食盐水 D.水
2.亚硒酸钠(Na2SeO3)能消除加速人体衰老的活性氧,其中硒(Se)的化合价为(?? ? )
A.+1 B.+4 C.+3 D.+2
3.关于氢氧化钠的性质,下列说法正确的是(?? ? )
① 能跟二氧化碳反应 ② 没有腐蚀性
③ 能跟盐酸发生中和反应 ④ 不能使无色酚酞试液变色
A.④ B.②④ C. ①③ D. ①②
4.某些花岗岩石材中含有放射性元素氡。一种氡原子的质子数为86,中子数为136,这种氡原子核外电子数为 (??? )
A.50??? B.86 ??? C.136??? D.222
5.某物质R与水和氧气发生化学反应为:2R+2H2O+7O2=2FeSO4+2H2SO4,推断R的化学式为(?? ? )
A.FeS B.Fe2S3 C.FeO D.FeS2
6.配制一定溶质质量分数的氯化钠溶液,操作顺序正确的是(?? ? )
A.计算、溶解、称量、量取 B.溶解、量取、计算、称量
C.计算、称量、量取、溶解 D.称量、量取、溶解、计算
7.下列制取物质的方案中,可以经过一步化学反应实现的是(?? ? )
A. 用铁和稀硫酸制取硫酸铁 B.用氯化铜和水制取氢氧化铜
C. 用铜和稀盐酸制取氯化铜 D.用生石灰和水制取熟石灰
8.已知60℃时硝酸钾的溶解度为110克。现有500克60℃的硝酸钾溶液,若蒸发掉10克水,温度恢复到60℃,不可能有的情况是(?? ? )
① 析出硝酸钾晶体的质量等于11克 ② 析出硝酸钾晶体的质量小于11克
③ 析出硝酸钾晶体的质量大于11克 ④ 没有硝酸钾晶体析出
A. ④ B. ②④ C. ③ D. ①②
9.下列实验室制取氧气的操作中,不正确的是(?? ? )
① 试管口略向下倾斜 ② 用排水法收集氧气
③ 铁夹夹持在试管的中上部 ④ 收集完毕,先停止加热再将导管移出水面
A. ④ B.②④
C. ①③ D. ①②
10.下列实验操作中错误的是( )
A、实验室制取气体,要先对装置的气密性进行检查
B、给玻璃仪器加热时都需垫石棉网
C、可燃性气体点燃之前必须检查其纯度
D、实验时多取的药品放入指定容器内
11.在水溶液中,一般不与其它物质发生复分解反应,这种物质是下列中的(?? ? )
A.KCl B.HNO3 C.NaNO3 D.Mg(OH)2
12.下列各组气体中,均能用固体氢氧化钠干燥的一组是(?? ? )
A.O2、CO、CO2 B.H2、O2、HCl
C.H2、SO2、CO D.H2、O2、CO
二.选择题(每题只有一个正确答案,每题3分,共21分)
13.下列认识或说法中正确的是( )
A、向某固体中加入稀盐酸有气泡产生,可证明该物质中一定含有CO32-
B、常温下可用Fe与AgCl反应制取Ag
C、可用过量的Cu(OH)2除去CuSO4溶液中少量的H2SO4
D、分别将Mg、Fe、Cu、Ag放入稀盐酸中,可确定它们的活动性顺序
14.现有四种白色固体:①氯化钠 ②氯化钡 ③无水硫酸铜 ④硫酸钠,不使用其它试剂(可以用水)就可以把它们区分开,区分出的先后顺序是(?? ? )
A.②③④① B. ②④③①
C.③①④② D. ③②④①
15. 某种铁的氧化物20克,在加热条件下通入足量的一氧化碳完全反应,将生成的气体用石灰水完全吸收,得到沉淀37.5克,则该氧化物中铁元素和氧元素的质量比为(?? ? )
A.7∶3 B.7∶2
C.2∶3 D.21∶8
16.某单质X能从某溶液中置换出单质Y,由此推断下列说法中正确的是(?? ? )
A.X一定是排在金属活动顺序表中氢以前的金属
B.X是金属时,Y可能是金属,也可能
C.X是金属时,Y一定是非金属
D.X、Y都是金属时,Y一定比X活泼
17.常用燃烧法测定有机物的组成。现取3.2g某有机物在足量氧气中充分燃烧,生成4.4gCO2和3.6gH2O,则该有机物中(? ?? )
A.一 定含有C、H两种元素,可能含有O元素?
B.一 定含有C、O两种元素,可能含有H元素
C.一 定含C、H、O三种元素?
D.只含有C、H两种元素,不含O元素
18.如图所示,将气体X和气体Y同时通入液体Z,最终一定能看到液体变浑浊的是(?? ? )
X
Y
Z
A
H2
N2
水
B
HCl
CO2
石灰水
C
CO2
O2
烧碱溶液
D
HCl
O2
硝酸银溶液
19.在H2+CuOCu+H2O反应中,铜元素由+2价变为0价,氢元素由0价变为+1价。这类有元素化合价升降的反应属于氧化还原反应。据此判断,以下反应中不属于氧化还原反应的是(?? ? )
A.S+O2SO2 ? B.3CO+Fe2O32Fe+3CO2
C.2KClO32KCl+3O2↑ D.Na2CO3+Ca(OH)2=CaCO3↓+2NaOH?
三.填空题(共50分)
20.(6分)A是一种白色难溶于水的钙盐,由三种元素组成,其式量为100。
(1)用化学式表示:A ___________________,B ___________________
(2)写出A与盐酸反应的化学方程式:____________________________________
(3)D中含有的溶质可能有哪几种情况?________________________________
21.(6分)X和白色沉淀I、II都是含有镁元素的化合物,Z是一种会使地球产生"温室效应"的气休,A是一种碱。它们的有关变化如下图所示 (该实验条件下,微溶物以沉淀形式出现):
(1)写出下列物质的化学式:
A是 ,B是
白色沉淀I是 ,Z是
(2)X跟C反应的化学方程式是
22.(14分)实验室一烧杯中盛有含少量NaCl的CaCl2溶液。请设计实验除去其中的NaCl,以得到纯净的CaCl2溶液。然后根据设计将相关内容填写在下面实验报告的空格内(有的空格可以不填)
实验步骤
实验现象
有关的化学方程式
1·向混合溶液中加入过量
的 溶液。
2·
3·
23.(6分)要从BaCl2和NaOH混合固体中获得纯净的BaCl2,设计方案如下:
(1)方案一:将混合物溶于足量的水,过滤、蒸干。该方案不合理,原因是
;
(2)方案二,将混合物溶于足量的水,再加入适量的CuCl2溶液,充分反应后过滤、蒸干。该方案不合理的原因是 。
(3)合理的方案是:将混合物溶于足量的水,先用适量试剂①把BaCl2转化为含钡不溶物,过滤;再用足量试剂②将不溶物转化为BaCl2溶液,蒸干。所用试剂①和试剂②依次是 。
24.(8分)下图为常见的实验装置(各具用途),根据下列要求回答问题。装置可重复使用。提示: H2+CuOCu+H2O(填序号)
A B C D E
⑴将含水蒸气的氢气干燥后还原氧化铜,则该气体先要通过装置_____。
⑵如果验证混合体中有H2和H2O,需连接的仪器顺序是_______________。
⑶如果验证混合气体中有H2、CO和H2O ,则需连接的仪器顺序为__________。
⑷如果验证混合气体中有CO2、CO、H2,则需连接的仪器顺序是__________。
25.(10分)某中学化学实验室有如下图所示的实验装置,用于制取氧气或二氧化碳气体。
(1)若制取的一种气体是 ,应选用的发生装置是 (填序号,下同),,应选用的收集装置是 , 反应的化学方程式是 ;反应的基本类型属于 反应(选填“化合”或“分解”或“置换”或“复分解”)。检验所制取的气体的方法是: ;
(2)在常温下,用亚硫酸钠固体和稀硫酸制取二氧化硫气体,应选用的发生装置是: ;由于二氧化硫是易溶于水、密度比空气大的有毒气体,所以应用 装置进行收集,以便将尾气吸收处理,避免造成 。
四、计算题
26.(5分)某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了以下实验:取40 mL该溶液于烧杯中,滴入40 g溶质质量分数为13.8%的K2CO3溶液。滴入K2CO3溶液质量与生成沉淀质量的关系如右图所示。求:
(1)所取40 mL溶液中HCl和CaCl2的质量。
(2)实验结束后,若将烧杯中的物质蒸干,得到固体的质量。
宝丰一高2006-2007学年上学期期前考答题卷
高一化学命题人:何占伟 2006-8-11
选择题答题卡(45分)
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
答案
三.填空题(共50分)
20.(1)A ___________________,B
(2)____________________________________
(3)
21.(1)A ____________,B I Z
(2)
22.
实验步骤
实验现象
有关的化学方程式
1·向混合溶液中加入过量
的 溶液。
2·
3·
23.(1)
(2)
(3)
24.(1) (2)
(3) (4)
25.(1)
(2)
四、计算题
26.(5分)某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了以下实验:取40 mL该溶液于烧杯中,滴入40 g溶质质量分数为13.8%的K2CO3溶液。滴入K2CO3溶液质量与生成沉淀质量的关系如右图所示。求:
(1)所取40 mL溶液中HCl和CaCl2的质量。
(2)实验结束后,若将烧杯中的物质蒸干,得到固体的质量。
宝丰一高2006-2007学年上学期期前考答题卷
高一化学命题人:何占伟 2006-8-11
选择题答题卡(45分)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
B
C
D
D
C
D
C
A
B
题号
11
12
13
14
15
16
17
18
19
答案
C
D
C
D
A
B
C
D
D
三.填空题(共50分)
20.(1)A、CaCO3,B、CaO(2)CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
(3)NaOH ; NaOH和Na2CO3 ; NaOH和Ca(OH)2
21.(1) NaOH HCl Mg(OH)2 MgCO3
(2) MgCl2+ Na2CO3 == MgCO3 +2NaCl
22.
实验步骤
实验现象
有关的化学方程式
1·向混合溶液中加入过量的 Na2CO3 溶液。
有白色沉淀生成
Na2CO3+CaCl2==CaCO3↓+2NaCl
2· 过滤、洗涤沉淀
3· 加入适量盐酸
沉淀溶解,有气泡生成
CaCO3+2HCl==CaCl2 +H2O +CO2↑
23.(1)BaCl2和NaOH都溶于水(2)无法除去Na+(3)碳酸钠溶液、盐酸(或用化学式表示、其它可溶性碳酸盐跟盐酸组合也可以)
24.⑴B ⑵ABEA ⑶ABEAD ⑷DCBEAD
25.(1)参考答案一:氧气(或O2);A(或B);C(或D或E) ;分解
2KClO32KCl+3O2↑
将带火星的木条伸到集气瓶里,木条复燃,证明瓶里的气体是氧气。
参考答案二:二氧化碳(CO2);B;D(或E)
2HCl+CaC03==CaCl2+H20+C02 ↑;复分解
倒人足量的澄清石灰水,振荡,石灰水变白色浑浊,证明瓶里的气体是二氧化碳。
(2))B;E;空气污染
四、计算题
26.解:设40 mL溶液中所含HCl和CaCl2的质量分别为x、y,K2CO3与HCl反应生成KCl的质量为m,K2CO3与CaCl2反应生成KCl的质量为n。
K2CO3 + 2HCl === 2KCl + H2O + CO2↑
138 73 149
10 g×13.8% x m
≈0.7 g
K2CO3 + CaCl2 === CaCO3↓ + 2KCl
111 100 149
y 2 g n
≈2.2 g
剩余K2CO3的质量为10 g×13.8%=1.38 g
固体的质量为1.49 g+2.98 g+1.38 g + 2 g=7.85 g≈7.9 g
答:40 mL溶液中所含HCl和CaCl2的质量分别为0.7 g、2.2 g,得到固体的质量为7.9 g。
同课章节目录
