苏教版高中化学必修二专题2《化学反应与能量转化》检测题(解析版)
文档属性
| 名称 | 苏教版高中化学必修二专题2《化学反应与能量转化》检测题(解析版) |
|
|
| 格式 | zip | ||
| 文件大小 | 322.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-27 07:29:43 | ||
图片预览




文档简介
专题2《化学反应与能量转化》检测题
一、单选题(每小题只有一个正确答案)
1.把铝条放入盛有过量稀盐酸的试管中,不影响产生氢气速率的因素是( )
A. 加少量浓盐酸 B. 加少量NaCl溶液
C. 加少量NaNO3固体 D. 加少量Na2SO4固体
2.等质量(金属颗粒大小相当)下列金属与足量l mol/L盐酸反应,速率最快是 ( )
A. 镁 B. 铝 C. 锌 D. 铁
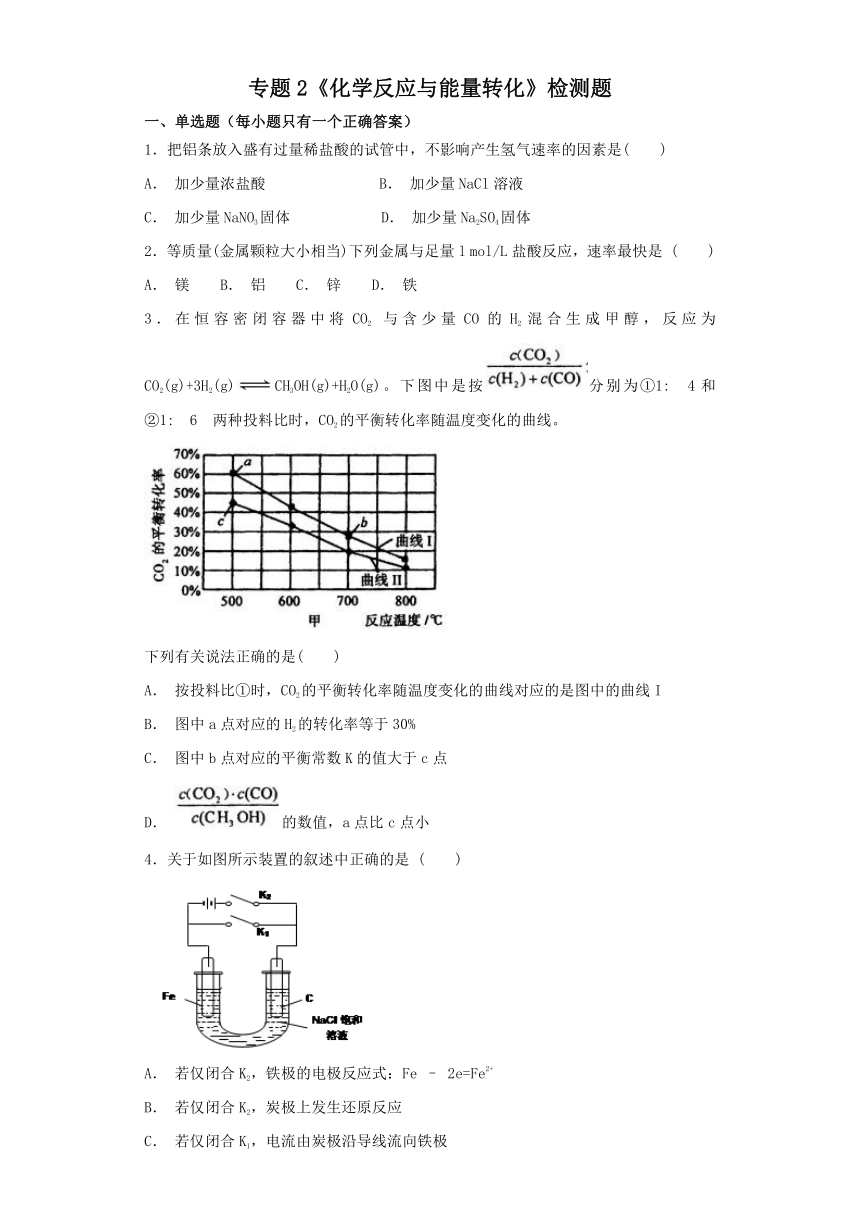
3.在恒容密闭容器中将CO2?与含少量CO的H2混合生成甲醇,反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g)。下图中是按分别为①1:?4和②1:?6?两种投料比时,CO2的平衡转化率随温度变化的曲线。
下列有关说法正确的是( )
A. 按投料比①时,CO2的平衡转化率随温度变化的曲线对应的是图中的曲线I
B. 图中a点对应的H2的转化率等于30%
C. 图中b点对应的平衡常数K的值大于c点
D. 的数值,a点比c点小
4.关于如图所示装置的叙述中正确的是 ( )
A. 若仅闭合K2,铁极的电极反应式:Fe – 2e=Fe2+
B. 若仅闭合K2,炭极上发生还原反应
C. 若仅闭合K1,电流由炭极沿导线流向铁极
D. 若仅闭合K1,炭极的电极反应式: O2+4e+4H+=2H2O
5.下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.吸热反应发生过程中要不断从外界获得能量,放热反应一定不需要吸收外界能量
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O (l) ΔH= +285.8kJ/mol
D.稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7kJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7kJ
6.恒温下向体积为5 L的恒容密闭容器中通入2 mol A气体和1 mol B气体,发生如下反应:2A(g)+B(g) ?x C(g),2 min时反应达到平衡状态,此时A的转化率和C的体积分数都是25% 。则能作为该可逆反应到达平衡的标志是( )
A. 混合气体平均相对分子质量保持一定
B. 单位时间内每生成3mol C的同时,生成1 mol B
C. 容器内气体密度恒定不变
D. 反应前后容器内总压强恒定不变
7.下列关于化学反应速率的说法错误的是( )
A. 化学反应速率是用于衡量化学反应进行快慢的物理量
B. 可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零
C. 决定化学反应速率的主要因素是反应物本身的性质
D. 增大反应物浓度或升高反应温度都能加快化学反应速率
8.硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如右图,该电池工作时反应为4VB2+ 11O2=4B2O3+2V2O5。下列说法正确的是( )
A. VB2极为负极,发生还原反应 B. 图中选择性透过膜只能让阳离子选择性透过
C. 电子由VB2极经导线、负载流向电极a D. 电极a上发生反应为O2+2H2O-4e-=4OH-
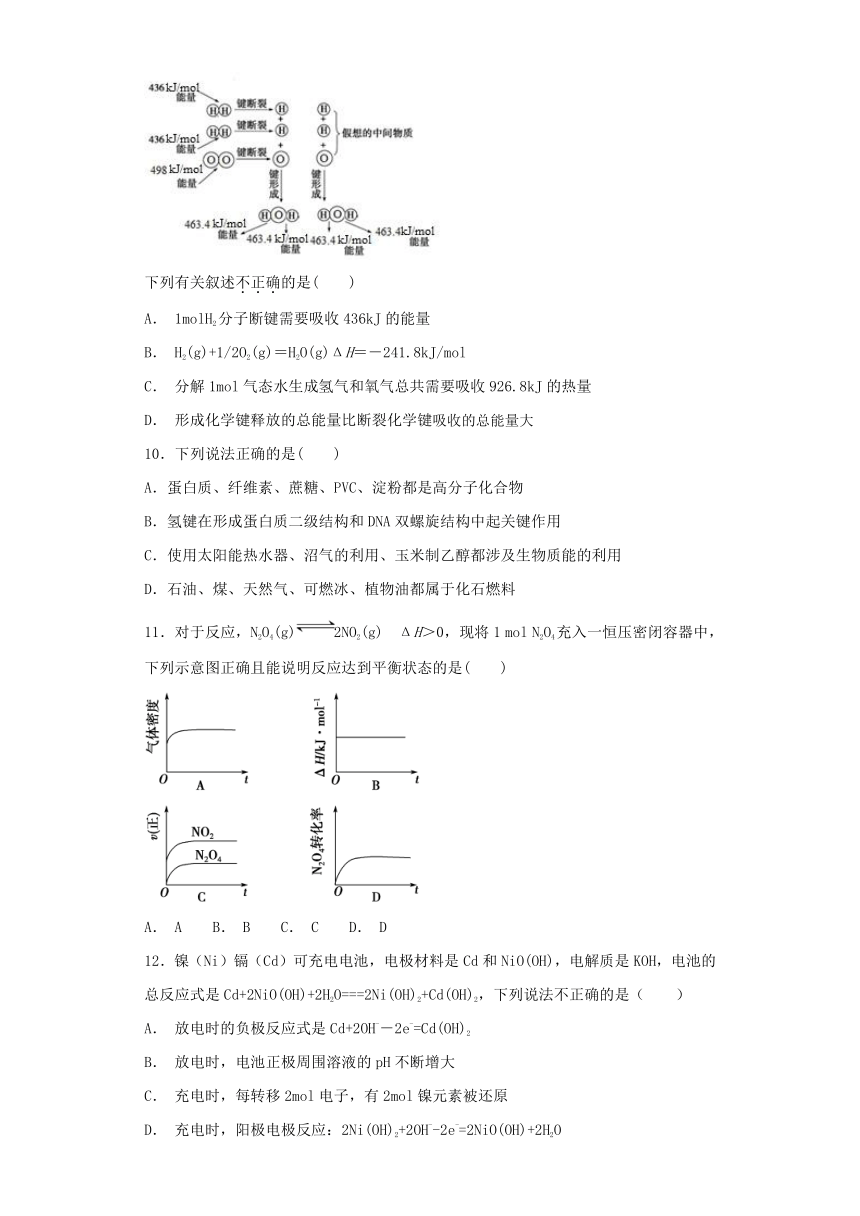
9.图为H2与O2反应生成H2O(g)的能量变化示意图:
下列有关叙述不正确的是( )
A. 1molH2分子断键需要吸收436kJ的能量
B. H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8kJ/mol
C. 分解1mol气态水生成氢气和氧气总共需要吸收926.8kJ的热量
D. 形成化学键释放的总能量比断裂化学键吸收的总能量大
10.下列说法正确的是( )
A.蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物
B.氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用
C.使用太阳能热水器、沼气的利用、玉米制乙醇都涉及生物质能的利用
D.石油、煤、天然气、可燃冰、植物油都属于化石燃料
11.对于反应,N2O4(g)2NO2(g) ΔH>0,现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是( )
A. A B. B C. C D. D
12.镍(Ni)镉(Cd)可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,电池的总反应式是Cd+2NiO(OH)+2H2O===2Ni(OH)2+Cd(OH)2,下列说法不正确的是( )
A. 放电时的负极反应式是Cd+2OH--2e-=Cd(OH)2
B. 放电时,电池正极周围溶液的pH不断增大
C. 充电时,每转移2mol电子,有2mol镍元素被还原
D. 充电时,阳极电极反应:2Ni(OH)2+2OH--2e-=2NiO(OH)+2H2O
二、填空题
13.一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu===2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-===Cu2+,还原反应式:2Fe3++2e-===2Fe2+。据此,回答下列问题:
(1)将反应3Cu+8H++2NO===3Cu2++2NO↑+4H2O拆写为两个“半反应式”,还原反应式:______________________________。
(2)此原理可用于电化学。锌?锰碱性电池广泛应用于日常生活,电池的总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。该电池的正极反应式为_________。
14. 800℃、2L密闭容器反应2NO(g)+O2(g)2NO2(g)体系中, n(NO)随
时间的变化如表:
时间(s) 0 1 2 3 4 5
n(NO)(mol) 0.020 0.010 0.008 0.007 0.007 0.007
计算并回答下列问题:
(1)反应进行到2 s时c (NO)= 。
(2)用O2表示从0~2s内该反应的平均速率υ=___________。
(3) 反应达到平衡状态时NO的转化率= 。(提示 : )
(4)判断一可逆反应是否达到平衡状态的依据有很多,某同学针对该反应提出一种设想:测定容器内气体的密度,当密度不再改变时即可判断出该反应已经达到平衡状态。你认为这种设想是否正确? (填“是”或“否”)请说明你的理由 。
15.乙烷(C2H6)作为一种新能源在化学领域应用广泛,请回答下列问题:(如图所示,装置Ⅰ为乙烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①a处应通入______(填“C2H6”或“O2”),a处电极上发生的电极反应式是____________________________________;
②电镀结束后,装置Ⅰ中溶液的pH______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有___________(忽略水解);在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗乙烷________L(标准状况下)。
16.把0.04 mol X气体和0.06 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末生成0.03 mol W。若测知以Z的浓度变化表示的反应速率为0.005 mol·(L·min)-1。试计算:
(1)前2 min内用X的浓度变化表示的平均反应速率为 ;
(2)化学方程式中n的值是 。
17.已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ 能量,根据图中的能量图,回答下列问题:
(1)分别写出①②的数值:①___________KJ;②____________KJ。
(2)生成H2O(g)中的1 mol H—O键放出_____________kJ的能量。
(3)已知:H2O(l)==H2O(g) ΔH = + 44 kJ·mol-1,试写出2 mol氢气在足量氧气中完全燃烧生成液态水的热化学方程式___________________。
三、推断题
18.随原子序数的递增,八种短周期元素(用英文小写字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)f在元素周期表的位置是_________________。
(2)比较d、e简单离子的半径大小(用化学式表示,下同)_____________;比较g、h的最高价氧化物对应的水化物的酸性强弱是______________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式________________。
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:____________________________________________。
(5)由元素f、h形成的物质X与由元素x、z形成的化合物Y可发生以下反应:
①写出X溶液与Y溶液反应的离子方程式____________________________________;
②写出工业上制备f的单质的化学方程式____________________________________。
19.A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中的位置是________。
(2)写出C物质的化学式:________。
(3)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:____________________________;
反应④的离子方程式:____________________________;
反应⑥的化学方程式:____________________________。
(4)从能量变化的角度看,反应①②③中,属于ΔH<0的反应是________(填序号)
四、实验题
20.为探究Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
定性分析:(1)如图甲所示可通过观察____________________,定性比较得出结论.
(2)有同学提出试剂的选择不妥,应将FeCl3改为更为_____________合理。
(3)H2O2在二氧化锰作用下发生的反应可分为两步,第一步的方程式为:2MnO2+H2O2=2HMnO3,第二步的化学方程式为:___________________________,若第一步反应慢第二步反应快,则总反应速率由_____________(填“第一步”或“ 第二步”)决定。
定量分析:(4)如图乙所示,以实验时均生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是:_____________________________.
21.小艾同学在妈妈买回的某食品包装内发现有一包白色颗粒状固体A的小纸袋,上面写着“生石灰干燥剂,请勿食用”。小艾同学随手将小纸袋放在窗台上,过一段时间后发现纸袋内的白色颗粒粘在一起成为块状固体B。小艾同学请你和同学们一起对块状固体B进行探究。
(1)猜想一:块状固体B中除氧化钙外,还可能有 (写两种);
(2)猜想二:块状固体B溶于水可能有 现象(填“放热”或“吸热”)。
(3)取块状固体B加入盛有一定量水的试管内,振荡、静置、过滤,得到少量白色固体C。就白色固体C同学们展开了热烈讨价,一起猜想。
小艾同学认为白色固体C可能是氢氧化钙,小聪同学认为白色固体C可能是碳酸钙;你认为白色固体C还可能是 (任写一种)。
五、计算题
22.在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:
(1)2 min末SO3的浓度;
(2)2 min内SO2的平均反应速率。
23.400 ℃时,将一定量的SO2和 14 mol O2压入一个盛有催化剂的10 L密闭容器中进行反应:2SO2+O22SO3
已知 2 min后,容器中剩余 2 mol SO2和12 mol O2。试计算:
(1)生成SO3 的物质的量。
(2)SO2的起始物质的量浓度。
(3)2 min 内SO2和SO3 的反应速率。
试卷第4页,总7页
参考答案
1.D
【解析】反应的实质是2Al+6H+=2Al3++3H2↑,影响反应速率的因素有H+的浓度和铝条的表面积,另外温度不同,反应速率不同,但是加入少量Na2SO4固体,参加反应的H+的浓度不变,对反应速率没有影响,故选D。
点睛:本题考查化学反应速率的影响因素,注意把握影响化学反应速率的因素,本题特别要注意C项,加入硝酸钠与加入硫酸钠固体的区别,要知道硝酸具有强氧化性,与金属反应一般不放出氢气。
2.D
【解析】尽管随着社会的发展,人类已开发利用了多种能源,但是当今人类社会的主要能源仍是煤、石油、天然气等化石能源,而这些物质所储存的能量的释放,均是通过化学反应实现的。人体内有机物所含能量的释放是有机物被氧化成简单无机物的过程。至于化学反应放出的能量,可以造福人类,也可以给人类带来灾难,比如火灾。
3.C
【解析】H2SO4与Ba(OH)2溶液混合,酸与碱发生中和反应,是放热反应。与铝跟稀盐酸的反应类似,镁跟醋酸溶液的反应也是放热反应。燃烧是指剧烈的发光发热的反应,因而都是放热反应。复分解反应,有的是放热反应,如酸碱中和反应;有的是吸热反应,如氢氧化钡晶体与氯化铵晶体的反应。
4.A
【解析】分析:金属性越强,与酸反应越剧烈,反应速率越快。
详解:选项中的四种金属性强弱顺序是Mg>Al>Zn>Fe,所以等质量(金属颗粒大小相当)金属与足量l mol/L盐酸反应,速率最快是镁。
答案选A。
5.D
【解析】
同一温度下,两种物质参加反应,增加氢气的浓度,二氧化碳的转化率增大,因此从图中可知,按投料比①时,CO2的平衡转化率随温度变化的曲线对应的是图中的曲线II,A错误;相同条件下,二氧化碳的含量越高,二氧化碳转化率越低,所以曲线Ⅰ的投料比[]为1:6,而一氧化碳与氢气的物质的量之比未知,无法计算氢气的转化率,B错误;温度升高,二氧化碳的平衡转化率降低,所以平衡逆向移动,则正反应是放热反应,所以b点对应的平衡常数K的值小于c点,C错误;假设CO为1mol/L,则根据按为1:4时,c(CO2)=1 mol/L,c(H2)=3mol/L,根据图像可知,500℃时,CO2的平衡转化率为45%,所以反应剩余c(CO2)=1-1×45%=0.55 mol/L,生成甲醇的浓度为0.45 mol/L,带入并计算=0.55×1/0.45=1.22;假设CO为1mol/L,则根据按为1:6时,c(CO2)=1 mol/L,c(H2)=5mol/L,根据图像可知,500℃时,CO2的平衡转化率为60%,所以反应剩余c(CO2)=1-1×60%=0.4mol/L,生成甲醇的浓度为0.6 mol/L,带入并计算=0.4×1/0.6=0.67;综上分析可知的数值,a点比c点小,D正确;正确选项D。
6.C
【解析】A. 若仅闭合K2,构成电解池,铁极与电源的负极相连,作阴极,溶液中的氢离子放电,A错误;B. 若仅闭合K2,构成电解池,碳电极与电源的正极相连,作阳极,溶液中的氯离子放电,炭极上发生氧化反应,B错误;C. 若仅闭合K1,形成原电池,铁是负极,电流由炭极沿导线流向铁极,C正确;D. 若仅闭合K1,形成原电池,炭极是正极,氧气得到电子,电极反应式: O2+4e-+2H2O=4OH-,D错误,答案选C。
7.D
【解析】
试题分析:硫燃烧为放热反应,固体硫先吸热,变成硫蒸气,故后者放出的热量少,A错误;吸热反应发生过程中要不断从外界获得能量,某些放热反应需先从外界吸收能量,达到反应的活化能,再放出能量,B错误;C选项中,2g H2为1mol,热化学方程式应为:2H2(g)+O2(g)=2H2O (l) ΔH= +571.6kJ/mol,C错误;浓硫酸遇水稀释放热(稀释热),与NaOH发生中和反应(中和热),故放出的热量大于53.7kJ,D正确。
考点:反应热
点评:反应热是历年高考的重点,考生应重点掌握。
8.B
【解析】2A(g)+B(g) x C(g)
起始: 2 1 0
变化: 2a a xa
平衡:2-2a 1-a xa A的转化率为2a/2×100%=25%,a=0.25mol,C的体积分数为xa/(3-3a+xa)×100%=25%,解得x=3,A、组分都是气体,气体质量不变,反应前后气体系数之和相等,即物质的量不变,因此平均摩尔质量不变,不能说明反应达到平衡,故A错误;B、生成C说明反应向正反应方向进行,生成B说明反应向逆反应方向进行,生成量等于系数之比,故B正确;C、组分都是气体,气体质量相等,容器是恒容状态,因此密度不变,不能说明反应达到平衡,故C错误;D、反应前后气体系数之和相等,压强不变,不能说明反应达到平衡,故D错误。
9.B
【解析】化学反应有的快,有的慢,则使用化学反应速率来定量表示化学反应进行的快慢,故A正确;可逆反应达到化学平衡状态时,正逆反应速率相等,但反应并没有停止,B项错误;影响化学反应速率的主要因素是反应物本身的性质,C项正确;即单位体积内的反应物分子增多,其中能量较高的活化分子数也同时增多,分子之间碰撞的机会增多,反应速率加快,升高反应温度,反应物分子获得能量,使一部分原来能量较低分子变成活化分子,增加了活化分子的百分数,使得有效碰撞次数增多,故反应速率加大,D项正确。
10.C
【解析】根据电池总反应,VB2发生氧化反应,所以VB2是负极,故A错误;该电池正极生成氢氧根离子、负极消耗氢氧根离子,所以选择性透过膜能让氢氧根离子选择性透过,故B错误;VB2极为负极,a是正极,所以电子由VB2极经导线、负载流向电极a,故C正确;a是正极,电极a上得电子发生还原反应, O2+2H2O+4e-=4OH-,故D错误。
点睛:原电池中,负极失电子发生氧化反应,正极得电子发生还原反应,电解质溶液中阳离子移向正极、阴离子移向负极;电子由负极经导线流向正极。
11.C
【解析】
【详解】
A、化学键断裂需要吸收能量,1molH2分子断键需要吸收436kJ的能量,选项A正确;
B、H2(g)+O2(g)═H2O(g)反应焓变=反应物总键能-生成物总键能=(436+×498-2×463.4)=-241.8kJ/mol,标注物质聚集状态和对应反应焓变写出热化学方程式为,H2(g)+O2(g)═H2O(g)△H=-241.8kJ/mol,选项B正确;
C、根据热反应方程式H2(g)+O2(g)═H2O(g)△H=-241.8kJ/mol可知,分解1mol气态水生成氢气和氧气总共需要吸收483.6kJ的热量,选项C不正确;
D、反应为放热反应,依据能量守恒可知,形成化学键释放的总能量比断裂化学键吸收的总能量大,选项D正确;
答案选C。
12.B
【解析】
试题分析:A、蔗糖是二糖,相对分子质量较小,则不属于高分子化合物,A错误;B、氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用,B正确;C、使用太阳能热水器是直接利用太阳能,不涉及生物质能的利用,C错误;D、植物油不属于化石燃料,D错误,答案选B。
考点:考查有机物结构和性质以及能源应用等
13.D
【解析】
【分析】
当可逆反应中正逆反应速率相等,反应体系中各物质物质的量不变、浓度不变以及引起的一系列物理量不变时,该反应达到平衡状态。
【详解】
反应方程式两边气体的质量相等,物质的量增大,反应时容器体积增大,气体密度减小,图像错误,A错误;反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,B错误;根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,D正确。
故选D。
【点睛】
本题考查平衡状态判断,注意只有反应前后改变的物理量才能作为判断平衡状态的依据,为易错点。
14.C
【解析】A项,放电时负极Cd发生氧化反应生成Cd(OH)2,负极反应式为Cd-2e-+2OH-=Cd(OH)2,正确;B项,放电时正极NiO(OH)发生还原反应生成Ni(OH)2,正极反应式为NiO(OH)+e-+H2O=Ni(OH)2+OH-,c(OH-)增大,正极周围溶液的pH不断增大,正确;C项,充电时Ni元素的化合价由Ni(OH)2中的+2价升至NiO(OH)中的+3价,每转移2mol电子有2mol镍元素被氧化,错误;D项,充电时阳极Ni(OH)2发生氧化反应生成NiO(OH),阳极反应式为2 Ni(OH)2+2OH--2e-=2 NiO(OH)+2H2O,正确;答案选C。
点睛:本题考查镍镉可充电电池的工作原理,理解二次电池的工作原理是解题的关键。二次电池放电时为原电池原理,充电时为电解原理;充电时阴极反应为放电时负极反应的逆过程,充电时阳极反应为放电时正极反应的逆过程。
15. 8H++2NO+6e-===2NO↑+4H2O 2MnO2+2H2O+2e-===2MnOOH+2OH-
【解析】(1)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O反应中,Cu失电子发生氧化反应,NO3-得电子发生还原反应,则还原反应:8H++2NO3-+6e-=2NO↑+4H2O;(2)由化合价变化可知,Mn元素化合价由+4价降低到+3价,应为原电池正极反应,电极方程式为MnO2+H2O+e-=MnOOH+OH-。
16.(每空2分)
⑴0.004mol/L;⑵0.0015mol/(L?s);⑶65%;⑷否 反应物、生成物均为气体,密闭容器中气体质量和体积不变,气体密度始终恒定。
【解析】
试题分析:(1)反应进行到2 s时c (NO)=0.008mol÷2L=0.004mol/L。
(2)用O2表示从0~2s内该反应的平均速率v=1/2×(0.020mol-0.008mol)÷2L÷2S=0.0015mol/(L?s)。
(3)反应达到平衡状态时NO的转化率=(0.020mol—0.007mol)÷0.020mol×100%=65%。
(4)因为该反应的反应物、生成物均为气体,根据质量守恒定律密闭容器中气体质量不变,密闭容器的体积为2L,体积不变,所以气体密度始终恒定,因此不能根据密度不再改变时判断出该反应已经达到平衡状态。
考点:本题考查化学反应速率了和转化率的计算、化学平衡状态的判断。
17. C2H6 C2H6-14e-+18OH-=2CO32-+12H2O 变小 不变 CO32- 0.64
【解析】试题分析:本题考查乙烷燃料电池,电镀原理以及多池串联装置的计算。装置II实现铁棒上镀铜,根据电镀原理,则Fe为阴极,Cu为阳极,Fe极与a极相连,Cu极与b极相连,a极为负极,b极为正极。
①乙烷燃料电池中,通入乙烷的一极为负极,通入O2的一极为正极,a处应通入C2H6。由于电解质溶液为KOH溶液,a处C2H6发生氧化反应生成CO32-,1molC2H6失去14mol电子,a处的电极反应式为C2H6-14e-+18OH-=2CO32-+12H2O。
②装置I中电池总反应为2C2H6+7O2+8OH-=4CO32-+10H2O,OH-浓度减小,pH变小。装置II中Cu极的电极反应式为Cu-2e-=Cu2+,Fe极的电极反应式为Cu2++2e-=Cu,装置II中Cu2+的物质的量浓度不变。
③根据装置I中的电池总反应,电镀结束后装置I溶液中的阴离子除了OH-外还含有CO32-。装置II中阴极电极反应为Cu2++2e-=Cu,装置I中负极反应式为C2H6-14e-+18OH-=2CO32-+12H2O,根据电子守恒,2n(Cu)=14n(C2H6),n(C2H6)=n(Cu)==mol,消耗乙烷在标准状况下的体积为mol22.4L/mol=0.64L。
点睛:本题解题的关键是电极的判断,根据电镀原理判断电极。难点是燃料电池电极反应式的书写。关于燃料电池必须注意:(1)燃料电池中,通入O2的一极为正极,通入燃料的一极为负极;(2)燃料电池的电池总反应一般与燃烧反应相同(注意:碱性条件下不生成CO2,生成CO32-);(3)书写有机物燃料电池负极电极反应式时,有机物中碳元素的化合价用平均价态,如C2H6中H元素的化合价为+1价,则C元素的化合价为-3价,反应后被氧化成+4价碳的化合物(在碱性条件下生成CO32-,其他条件下生成CO2),则1molC2H6发生氧化反应失去14mol电子。
18.0.005 mol/(L·min); 4
【解析】
试题分析:(1)因为在2 min末生成0.03 mol W,则根据方程式中X与M的物质的量的比为4:6,所以消耗的X的物质的量为0.02mol。因此前2 min内用X的浓度变化表示的平均反应速率为(0.02mol÷2 L)÷2min=0.005 mol/(L·min)。(2)V(Z)=0.005 mol·(L·min)-1,所以在前2分钟内Z的物质的量变化:0.005 mol·(L·min)-1×2min×2L=0.02mol.因为在化学方程式中,物质的方程式前边的系数比等于其物质的量的比,所以n:6=0.02mol: 0.03 mol。解得n=4。
考点:考查化学反应速率的计算及不同物质间的速率关系的知识。
19.(1)① 1370 ② 1852 (2)463
(3)2H2(g) + O2(g)====2H2O(l)ΔH =-570 kJ·mol-1
【解析】
试题分析:(1)①吸收的能量应为2molH2和1molO2吸收的能量,为2×436kJ + 498kJ=1370kJ,由图象可知2H2(g) + O2(g)=2H2O(g)△H=-482kJ?mol-1,反应热为反应物的总键能减去生成物的总键能,则②放出的热量为1370kJ + 482kJ=1852kJ,故答案为:①1370;②1852;
(2)②放出的热量为1852kJ,可知生成2molH2O放出1852kJ,则H-O键的键能为=463kJ,故答案为:463;
(3)已知①2H2(g) + O2(g)=2H2O(g)△H=-482kJ?mol-1,
②H2O(l)=H2O(g)△H= + 44kJ?mol-1,
利用盖斯定律将①-②×2
可知2H2(g) + O2(g)=2H2O(l)△H=-570kJ/mol,
故答案为:2H2(g) + O2(g)=2H2O(l)△H=-570kJ/mol.
考点:考查化学反应与能量
20.第三周期第ⅢA族O2->Na+HClO4>H2SO4(或,答案合理即可)2Na(s)+O2(g)=Na2O2(s) △H=-511kJ·mol-1Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+)2Al2O3(熔融)4Al+3O2↑
【解析】
【分析】
根据八种元素的最高正价或最低负价分析,x、y、z、d、e、f、g、h依次处于第IA族、第IVA族、第VA族、第VIA族、第IA族、第IIIA族、第VIA族、第VIIA族,结合原子序数和原子半径的图像,x、y、z、d、e、f、g、h依次为H、C、N、O、Na、Al、S、Cl元素。根据元素周期表、元素周期律和相关化学用语作答。
【详解】
根据八种元素的最高正价或最低负价分析,x、y、z、d、e、f、g、h依次处于第IA族、第IVA族、第VA族、第VIA族、第IA族、第IIIA族、第VIA族、第VIIA族,结合原子序数和原子半径的图像,x、y、z、d、e、f、g、h依次为H、C、N、O、Na、Al、S、Cl元素。
(1)f为Al元素,Al在元素周期表的位置是第三周期第IIIA族。
(2)d、e的简单离子依次为O2-、Na+,O2-、Na+具有相同的电子层结构,核电荷数:O2-r(Na+)。根据“同周期从左到右元素的非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强”,非金属性:SH2SO4。
(3)上述元素组成的常见四原子共价化合物有:C2H2、NH3、H2O2等,它们的电子式依次为、、。
(4)Na(s)在O2(g)中燃烧生成Na2O2(s),反应的热化学方程式为Na(s)+O2(g)=Na2O2(s)ΔH=-255.5kJ/mol(或2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ/mol)。
(5)由f、h组成的物质X为AlCl3,由x、z形成的化合物Y为NH3;X与Y在水溶液中反应生成M和Z,M是仅含非金属元素的盐,M为NH4Cl,Z为Al(OH)3,Al(OH)3受热分解生成的N为Al2O3,电解熔融Al2O3生成Al和O2。
①X溶液与Y溶液反应的化学方程式为:AlCl3+3NH3+3H2O=Al(OH)3↓+3NH4Cl(或AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl),反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+(或Al3++3NH3·H2O=Al(OH)3↓+3NH4+)。
②工业上电解熔融Al2O3制备Al,工业上制备Al的化学方程式为:2Al2O3(熔融)4Al+3O2↑。
21.第四周期第Ⅷ族 FeCl2 8Al+3Fe3O44Al2O3+9Fe 2Al+2OH-+2H2O===2AlO2—+3H2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 ①②
【解析】
G为主族元素的固态氧化物,电解G得到I和H,G能和氢氧化钠溶液反应生成J,I能和氢氧化钠溶液反应生成J,工业上常用电解氧化铝的方法冶炼铝,则G是Al2O3,I是Al,J是NaAlO2,H是O2,Al和B能在高温下反应生成A,A能在氧气中燃烧生成B,B与铝在高温下发生铝热反应,则B是金属氧化物,A是金属单质,B和盐酸反应生成C和D,C和氢氧化钠反应生成E,D和氨水反应生成F,E在空气中反应生成F,说明E不稳定,易被氧气氧化,且A、B、C、D、E、F六种物质中均含同一种元素,则A是Fe、B为Fe3O4、C为FeCl2、D为FeCl3、E为Fe(OH)2、F为Fe(OH)3。
(1). 由上述分析可知,A、B、C、D、E、F六种物质中所含的同一种元素是Fe,Fe位于第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2). C是氯化亚铁,化学式为FeCl2,故答案为:FeCl2;
(3). 由上述分析可知,反应①的化学方程式为:8Al+3Fe3O4 4Al2O3+9Fe,反应④的离子方程式为:2Al+2OH-+2H2O=2AlO2—+3H2↑,反应⑥的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:8Al+3Fe3O4 4Al2O3+9Fe;2Al+2OH-+2H2O=2AlO2—+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4). △H<0的反应为放热反应,①是铝热反应,②是燃烧反应,均为常见的放热反应,③是电解反应,为吸热反应,故答案为:①②。
点睛:本题考查无机物的推断,试题难度较大,突破本题的关键点是:1、G为主族元素的固态氧化物,在电解条件下生成I和H,能与NaOH溶液反应,说明G为Al2O3;2、C、D分别和碱反应生成E、F,说明E、F都为氢氧化物,E能在空气中转化为F,说明应为变价金属,进而推知A、B、C、D、E、F六种物质中所含的同一种元素是Fe,再利用图中所示转化关系解答即可。
22. 两支试管中产生气泡的快慢 Fe2(SO4)3 2HMnO3+H2O2=2MnO2+2H2O+O2↑ 第一步 产生40ml气体所需要的时间
【解析】(1)该反应中产生气体,所以可根据生成气泡的快慢判断,即可通过观察两支试管中产生气泡的快慢定性比较得出结论;(2)氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,因此为消除阴离子的干扰,应将FeCl3改为更为Fe2(SO4)3合理;(3)双氧水在二氧化锰作用下生成水和氧气,所以反应方程式为2H2O2=2H2O+O2↑,因此第二步的化学方程式为2HMnO3+H2O2=2MnO2+2H2O+O2↑;总反应速率由反应最慢的那一步决定,所以总反应速率由第一步决定。(4)该反应是通过生成气体的反应速率分析判断的,所以根据v=△V÷△t知,需要测量的数据是产生40mL气体所需要的时间。
点睛:本题考查了催化剂的作用及化学反应速率的影响因素等知识点,要会分析将FeCl3改为Fe2(SO4)3更为合理的理由,注意控制变量法的灵活应用。
23.(1)Ca(OH)2 CaCO3
(2)放热
(3)Ca(OH)2 和CaCO3的混合物(开放性试题,其他符合题意的猜想也可)
【解析】
试题分析:(1)生石灰在空气中易吸吸收空气中的水蒸汽变成氢氧化钙,氢氧化钙又易与二氧化碳反应生 成碳酸钙,则此固体中可能含有氢氧化钙与碳酸钙;
(2)白色粉末中可能含有未反应完全的氧化钙,由于氧化钙溶于水会放热,则此固体溶于水后会放出 热量。
(3)部分生石灰在空气中会与水反应生成氢氧化钙,氢氧化钙又易与二氧化碳反应生成碳酸钙,由于氢氧化钙是微溶物,量多时也会以沉淀的形式存在,故生成的白色沉淀也可能是两者的混合物.
【考点定位】本题主要是考查实验设计与探究
【名师点晴】明确生石灰等有关物质的化学性质以及实验原理是解答的关键,注意实验原理是解答实验题的核心,是实验设计的依据和起点。实验原理可从题给的化学情景(或题首所给实验目的)并结合元素化合物等有关知识获取。在此基础上,遵循可靠性、简捷性、安全性的原则,确定符合实验目的、要求的方案
24.(1)1.2 mol/L(2) 0.6 mol/(L·min)
【解析】试题分析:(1)2min末测得容器中有1.6mol SO2,则参加反应的二氧化硫物质的量为4mol-1.6mol=2.4mol,由方程式可知生成的三氧化硫的物质的量为2.4mol,三氧化硫的浓度为2.4mol÷2L=1.2mol/L,
(2)v(SO2)="2.4mol÷(2L×2min)=0.6" mol/(L.min),对同一个化学反应,不同物质表示的化学反应速率不同,速率之比等于化学计量数之比,则v (O2)="1/2×0.6" mol/(L?min)=0.3mol/(L·min)
考点:考查化学反应速率的计算等知识。
一、单选题(每小题只有一个正确答案)
1.把铝条放入盛有过量稀盐酸的试管中,不影响产生氢气速率的因素是( )
A. 加少量浓盐酸 B. 加少量NaCl溶液
C. 加少量NaNO3固体 D. 加少量Na2SO4固体
2.等质量(金属颗粒大小相当)下列金属与足量l mol/L盐酸反应,速率最快是 ( )
A. 镁 B. 铝 C. 锌 D. 铁
3.在恒容密闭容器中将CO2?与含少量CO的H2混合生成甲醇,反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g)。下图中是按分别为①1:?4和②1:?6?两种投料比时,CO2的平衡转化率随温度变化的曲线。
下列有关说法正确的是( )
A. 按投料比①时,CO2的平衡转化率随温度变化的曲线对应的是图中的曲线I
B. 图中a点对应的H2的转化率等于30%
C. 图中b点对应的平衡常数K的值大于c点
D. 的数值,a点比c点小
4.关于如图所示装置的叙述中正确的是 ( )
A. 若仅闭合K2,铁极的电极反应式:Fe – 2e=Fe2+
B. 若仅闭合K2,炭极上发生还原反应
C. 若仅闭合K1,电流由炭极沿导线流向铁极
D. 若仅闭合K1,炭极的电极反应式: O2+4e+4H+=2H2O
5.下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.吸热反应发生过程中要不断从外界获得能量,放热反应一定不需要吸收外界能量
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O (l) ΔH= +285.8kJ/mol
D.稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7kJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7kJ
6.恒温下向体积为5 L的恒容密闭容器中通入2 mol A气体和1 mol B气体,发生如下反应:2A(g)+B(g) ?x C(g),2 min时反应达到平衡状态,此时A的转化率和C的体积分数都是25% 。则能作为该可逆反应到达平衡的标志是( )
A. 混合气体平均相对分子质量保持一定
B. 单位时间内每生成3mol C的同时,生成1 mol B
C. 容器内气体密度恒定不变
D. 反应前后容器内总压强恒定不变
7.下列关于化学反应速率的说法错误的是( )
A. 化学反应速率是用于衡量化学反应进行快慢的物理量
B. 可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零
C. 决定化学反应速率的主要因素是反应物本身的性质
D. 增大反应物浓度或升高反应温度都能加快化学反应速率
8.硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如右图,该电池工作时反应为4VB2+ 11O2=4B2O3+2V2O5。下列说法正确的是( )
A. VB2极为负极,发生还原反应 B. 图中选择性透过膜只能让阳离子选择性透过
C. 电子由VB2极经导线、负载流向电极a D. 电极a上发生反应为O2+2H2O-4e-=4OH-
9.图为H2与O2反应生成H2O(g)的能量变化示意图:
下列有关叙述不正确的是( )
A. 1molH2分子断键需要吸收436kJ的能量
B. H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8kJ/mol
C. 分解1mol气态水生成氢气和氧气总共需要吸收926.8kJ的热量
D. 形成化学键释放的总能量比断裂化学键吸收的总能量大
10.下列说法正确的是( )
A.蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物
B.氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用
C.使用太阳能热水器、沼气的利用、玉米制乙醇都涉及生物质能的利用
D.石油、煤、天然气、可燃冰、植物油都属于化石燃料
11.对于反应,N2O4(g)2NO2(g) ΔH>0,现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是( )
A. A B. B C. C D. D
12.镍(Ni)镉(Cd)可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,电池的总反应式是Cd+2NiO(OH)+2H2O===2Ni(OH)2+Cd(OH)2,下列说法不正确的是( )
A. 放电时的负极反应式是Cd+2OH--2e-=Cd(OH)2
B. 放电时,电池正极周围溶液的pH不断增大
C. 充电时,每转移2mol电子,有2mol镍元素被还原
D. 充电时,阳极电极反应:2Ni(OH)2+2OH--2e-=2NiO(OH)+2H2O
二、填空题
13.一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu===2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-===Cu2+,还原反应式:2Fe3++2e-===2Fe2+。据此,回答下列问题:
(1)将反应3Cu+8H++2NO===3Cu2++2NO↑+4H2O拆写为两个“半反应式”,还原反应式:______________________________。
(2)此原理可用于电化学。锌?锰碱性电池广泛应用于日常生活,电池的总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。该电池的正极反应式为_________。
14. 800℃、2L密闭容器反应2NO(g)+O2(g)2NO2(g)体系中, n(NO)随
时间的变化如表:
时间(s) 0 1 2 3 4 5
n(NO)(mol) 0.020 0.010 0.008 0.007 0.007 0.007
计算并回答下列问题:
(1)反应进行到2 s时c (NO)= 。
(2)用O2表示从0~2s内该反应的平均速率υ=___________。
(3) 反应达到平衡状态时NO的转化率= 。(提示 : )
(4)判断一可逆反应是否达到平衡状态的依据有很多,某同学针对该反应提出一种设想:测定容器内气体的密度,当密度不再改变时即可判断出该反应已经达到平衡状态。你认为这种设想是否正确? (填“是”或“否”)请说明你的理由 。
15.乙烷(C2H6)作为一种新能源在化学领域应用广泛,请回答下列问题:(如图所示,装置Ⅰ为乙烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①a处应通入______(填“C2H6”或“O2”),a处电极上发生的电极反应式是____________________________________;
②电镀结束后,装置Ⅰ中溶液的pH______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有___________(忽略水解);在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗乙烷________L(标准状况下)。
16.把0.04 mol X气体和0.06 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末生成0.03 mol W。若测知以Z的浓度变化表示的反应速率为0.005 mol·(L·min)-1。试计算:
(1)前2 min内用X的浓度变化表示的平均反应速率为 ;
(2)化学方程式中n的值是 。
17.已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ 能量,根据图中的能量图,回答下列问题:
(1)分别写出①②的数值:①___________KJ;②____________KJ。
(2)生成H2O(g)中的1 mol H—O键放出_____________kJ的能量。
(3)已知:H2O(l)==H2O(g) ΔH = + 44 kJ·mol-1,试写出2 mol氢气在足量氧气中完全燃烧生成液态水的热化学方程式___________________。
三、推断题
18.随原子序数的递增,八种短周期元素(用英文小写字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)f在元素周期表的位置是_________________。
(2)比较d、e简单离子的半径大小(用化学式表示,下同)_____________;比较g、h的最高价氧化物对应的水化物的酸性强弱是______________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式________________。
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:____________________________________________。
(5)由元素f、h形成的物质X与由元素x、z形成的化合物Y可发生以下反应:
①写出X溶液与Y溶液反应的离子方程式____________________________________;
②写出工业上制备f的单质的化学方程式____________________________________。
19.A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中的位置是________。
(2)写出C物质的化学式:________。
(3)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:____________________________;
反应④的离子方程式:____________________________;
反应⑥的化学方程式:____________________________。
(4)从能量变化的角度看,反应①②③中,属于ΔH<0的反应是________(填序号)
四、实验题
20.为探究Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
定性分析:(1)如图甲所示可通过观察____________________,定性比较得出结论.
(2)有同学提出试剂的选择不妥,应将FeCl3改为更为_____________合理。
(3)H2O2在二氧化锰作用下发生的反应可分为两步,第一步的方程式为:2MnO2+H2O2=2HMnO3,第二步的化学方程式为:___________________________,若第一步反应慢第二步反应快,则总反应速率由_____________(填“第一步”或“ 第二步”)决定。
定量分析:(4)如图乙所示,以实验时均生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是:_____________________________.
21.小艾同学在妈妈买回的某食品包装内发现有一包白色颗粒状固体A的小纸袋,上面写着“生石灰干燥剂,请勿食用”。小艾同学随手将小纸袋放在窗台上,过一段时间后发现纸袋内的白色颗粒粘在一起成为块状固体B。小艾同学请你和同学们一起对块状固体B进行探究。
(1)猜想一:块状固体B中除氧化钙外,还可能有 (写两种);
(2)猜想二:块状固体B溶于水可能有 现象(填“放热”或“吸热”)。
(3)取块状固体B加入盛有一定量水的试管内,振荡、静置、过滤,得到少量白色固体C。就白色固体C同学们展开了热烈讨价,一起猜想。
小艾同学认为白色固体C可能是氢氧化钙,小聪同学认为白色固体C可能是碳酸钙;你认为白色固体C还可能是 (任写一种)。
五、计算题
22.在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:
(1)2 min末SO3的浓度;
(2)2 min内SO2的平均反应速率。
23.400 ℃时,将一定量的SO2和 14 mol O2压入一个盛有催化剂的10 L密闭容器中进行反应:2SO2+O22SO3
已知 2 min后,容器中剩余 2 mol SO2和12 mol O2。试计算:
(1)生成SO3 的物质的量。
(2)SO2的起始物质的量浓度。
(3)2 min 内SO2和SO3 的反应速率。
试卷第4页,总7页
参考答案
1.D
【解析】反应的实质是2Al+6H+=2Al3++3H2↑,影响反应速率的因素有H+的浓度和铝条的表面积,另外温度不同,反应速率不同,但是加入少量Na2SO4固体,参加反应的H+的浓度不变,对反应速率没有影响,故选D。
点睛:本题考查化学反应速率的影响因素,注意把握影响化学反应速率的因素,本题特别要注意C项,加入硝酸钠与加入硫酸钠固体的区别,要知道硝酸具有强氧化性,与金属反应一般不放出氢气。
2.D
【解析】尽管随着社会的发展,人类已开发利用了多种能源,但是当今人类社会的主要能源仍是煤、石油、天然气等化石能源,而这些物质所储存的能量的释放,均是通过化学反应实现的。人体内有机物所含能量的释放是有机物被氧化成简单无机物的过程。至于化学反应放出的能量,可以造福人类,也可以给人类带来灾难,比如火灾。
3.C
【解析】H2SO4与Ba(OH)2溶液混合,酸与碱发生中和反应,是放热反应。与铝跟稀盐酸的反应类似,镁跟醋酸溶液的反应也是放热反应。燃烧是指剧烈的发光发热的反应,因而都是放热反应。复分解反应,有的是放热反应,如酸碱中和反应;有的是吸热反应,如氢氧化钡晶体与氯化铵晶体的反应。
4.A
【解析】分析:金属性越强,与酸反应越剧烈,反应速率越快。
详解:选项中的四种金属性强弱顺序是Mg>Al>Zn>Fe,所以等质量(金属颗粒大小相当)金属与足量l mol/L盐酸反应,速率最快是镁。
答案选A。
5.D
【解析】
同一温度下,两种物质参加反应,增加氢气的浓度,二氧化碳的转化率增大,因此从图中可知,按投料比①时,CO2的平衡转化率随温度变化的曲线对应的是图中的曲线II,A错误;相同条件下,二氧化碳的含量越高,二氧化碳转化率越低,所以曲线Ⅰ的投料比[]为1:6,而一氧化碳与氢气的物质的量之比未知,无法计算氢气的转化率,B错误;温度升高,二氧化碳的平衡转化率降低,所以平衡逆向移动,则正反应是放热反应,所以b点对应的平衡常数K的值小于c点,C错误;假设CO为1mol/L,则根据按为1:4时,c(CO2)=1 mol/L,c(H2)=3mol/L,根据图像可知,500℃时,CO2的平衡转化率为45%,所以反应剩余c(CO2)=1-1×45%=0.55 mol/L,生成甲醇的浓度为0.45 mol/L,带入并计算=0.55×1/0.45=1.22;假设CO为1mol/L,则根据按为1:6时,c(CO2)=1 mol/L,c(H2)=5mol/L,根据图像可知,500℃时,CO2的平衡转化率为60%,所以反应剩余c(CO2)=1-1×60%=0.4mol/L,生成甲醇的浓度为0.6 mol/L,带入并计算=0.4×1/0.6=0.67;综上分析可知的数值,a点比c点小,D正确;正确选项D。
6.C
【解析】A. 若仅闭合K2,构成电解池,铁极与电源的负极相连,作阴极,溶液中的氢离子放电,A错误;B. 若仅闭合K2,构成电解池,碳电极与电源的正极相连,作阳极,溶液中的氯离子放电,炭极上发生氧化反应,B错误;C. 若仅闭合K1,形成原电池,铁是负极,电流由炭极沿导线流向铁极,C正确;D. 若仅闭合K1,形成原电池,炭极是正极,氧气得到电子,电极反应式: O2+4e-+2H2O=4OH-,D错误,答案选C。
7.D
【解析】
试题分析:硫燃烧为放热反应,固体硫先吸热,变成硫蒸气,故后者放出的热量少,A错误;吸热反应发生过程中要不断从外界获得能量,某些放热反应需先从外界吸收能量,达到反应的活化能,再放出能量,B错误;C选项中,2g H2为1mol,热化学方程式应为:2H2(g)+O2(g)=2H2O (l) ΔH= +571.6kJ/mol,C错误;浓硫酸遇水稀释放热(稀释热),与NaOH发生中和反应(中和热),故放出的热量大于53.7kJ,D正确。
考点:反应热
点评:反应热是历年高考的重点,考生应重点掌握。
8.B
【解析】2A(g)+B(g) x C(g)
起始: 2 1 0
变化: 2a a xa
平衡:2-2a 1-a xa A的转化率为2a/2×100%=25%,a=0.25mol,C的体积分数为xa/(3-3a+xa)×100%=25%,解得x=3,A、组分都是气体,气体质量不变,反应前后气体系数之和相等,即物质的量不变,因此平均摩尔质量不变,不能说明反应达到平衡,故A错误;B、生成C说明反应向正反应方向进行,生成B说明反应向逆反应方向进行,生成量等于系数之比,故B正确;C、组分都是气体,气体质量相等,容器是恒容状态,因此密度不变,不能说明反应达到平衡,故C错误;D、反应前后气体系数之和相等,压强不变,不能说明反应达到平衡,故D错误。
9.B
【解析】化学反应有的快,有的慢,则使用化学反应速率来定量表示化学反应进行的快慢,故A正确;可逆反应达到化学平衡状态时,正逆反应速率相等,但反应并没有停止,B项错误;影响化学反应速率的主要因素是反应物本身的性质,C项正确;即单位体积内的反应物分子增多,其中能量较高的活化分子数也同时增多,分子之间碰撞的机会增多,反应速率加快,升高反应温度,反应物分子获得能量,使一部分原来能量较低分子变成活化分子,增加了活化分子的百分数,使得有效碰撞次数增多,故反应速率加大,D项正确。
10.C
【解析】根据电池总反应,VB2发生氧化反应,所以VB2是负极,故A错误;该电池正极生成氢氧根离子、负极消耗氢氧根离子,所以选择性透过膜能让氢氧根离子选择性透过,故B错误;VB2极为负极,a是正极,所以电子由VB2极经导线、负载流向电极a,故C正确;a是正极,电极a上得电子发生还原反应, O2+2H2O+4e-=4OH-,故D错误。
点睛:原电池中,负极失电子发生氧化反应,正极得电子发生还原反应,电解质溶液中阳离子移向正极、阴离子移向负极;电子由负极经导线流向正极。
11.C
【解析】
【详解】
A、化学键断裂需要吸收能量,1molH2分子断键需要吸收436kJ的能量,选项A正确;
B、H2(g)+O2(g)═H2O(g)反应焓变=反应物总键能-生成物总键能=(436+×498-2×463.4)=-241.8kJ/mol,标注物质聚集状态和对应反应焓变写出热化学方程式为,H2(g)+O2(g)═H2O(g)△H=-241.8kJ/mol,选项B正确;
C、根据热反应方程式H2(g)+O2(g)═H2O(g)△H=-241.8kJ/mol可知,分解1mol气态水生成氢气和氧气总共需要吸收483.6kJ的热量,选项C不正确;
D、反应为放热反应,依据能量守恒可知,形成化学键释放的总能量比断裂化学键吸收的总能量大,选项D正确;
答案选C。
12.B
【解析】
试题分析:A、蔗糖是二糖,相对分子质量较小,则不属于高分子化合物,A错误;B、氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用,B正确;C、使用太阳能热水器是直接利用太阳能,不涉及生物质能的利用,C错误;D、植物油不属于化石燃料,D错误,答案选B。
考点:考查有机物结构和性质以及能源应用等
13.D
【解析】
【分析】
当可逆反应中正逆反应速率相等,反应体系中各物质物质的量不变、浓度不变以及引起的一系列物理量不变时,该反应达到平衡状态。
【详解】
反应方程式两边气体的质量相等,物质的量增大,反应时容器体积增大,气体密度减小,图像错误,A错误;反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,B错误;根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,D正确。
故选D。
【点睛】
本题考查平衡状态判断,注意只有反应前后改变的物理量才能作为判断平衡状态的依据,为易错点。
14.C
【解析】A项,放电时负极Cd发生氧化反应生成Cd(OH)2,负极反应式为Cd-2e-+2OH-=Cd(OH)2,正确;B项,放电时正极NiO(OH)发生还原反应生成Ni(OH)2,正极反应式为NiO(OH)+e-+H2O=Ni(OH)2+OH-,c(OH-)增大,正极周围溶液的pH不断增大,正确;C项,充电时Ni元素的化合价由Ni(OH)2中的+2价升至NiO(OH)中的+3价,每转移2mol电子有2mol镍元素被氧化,错误;D项,充电时阳极Ni(OH)2发生氧化反应生成NiO(OH),阳极反应式为2 Ni(OH)2+2OH--2e-=2 NiO(OH)+2H2O,正确;答案选C。
点睛:本题考查镍镉可充电电池的工作原理,理解二次电池的工作原理是解题的关键。二次电池放电时为原电池原理,充电时为电解原理;充电时阴极反应为放电时负极反应的逆过程,充电时阳极反应为放电时正极反应的逆过程。
15. 8H++2NO+6e-===2NO↑+4H2O 2MnO2+2H2O+2e-===2MnOOH+2OH-
【解析】(1)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O反应中,Cu失电子发生氧化反应,NO3-得电子发生还原反应,则还原反应:8H++2NO3-+6e-=2NO↑+4H2O;(2)由化合价变化可知,Mn元素化合价由+4价降低到+3价,应为原电池正极反应,电极方程式为MnO2+H2O+e-=MnOOH+OH-。
16.(每空2分)
⑴0.004mol/L;⑵0.0015mol/(L?s);⑶65%;⑷否 反应物、生成物均为气体,密闭容器中气体质量和体积不变,气体密度始终恒定。
【解析】
试题分析:(1)反应进行到2 s时c (NO)=0.008mol÷2L=0.004mol/L。
(2)用O2表示从0~2s内该反应的平均速率v=1/2×(0.020mol-0.008mol)÷2L÷2S=0.0015mol/(L?s)。
(3)反应达到平衡状态时NO的转化率=(0.020mol—0.007mol)÷0.020mol×100%=65%。
(4)因为该反应的反应物、生成物均为气体,根据质量守恒定律密闭容器中气体质量不变,密闭容器的体积为2L,体积不变,所以气体密度始终恒定,因此不能根据密度不再改变时判断出该反应已经达到平衡状态。
考点:本题考查化学反应速率了和转化率的计算、化学平衡状态的判断。
17. C2H6 C2H6-14e-+18OH-=2CO32-+12H2O 变小 不变 CO32- 0.64
【解析】试题分析:本题考查乙烷燃料电池,电镀原理以及多池串联装置的计算。装置II实现铁棒上镀铜,根据电镀原理,则Fe为阴极,Cu为阳极,Fe极与a极相连,Cu极与b极相连,a极为负极,b极为正极。
①乙烷燃料电池中,通入乙烷的一极为负极,通入O2的一极为正极,a处应通入C2H6。由于电解质溶液为KOH溶液,a处C2H6发生氧化反应生成CO32-,1molC2H6失去14mol电子,a处的电极反应式为C2H6-14e-+18OH-=2CO32-+12H2O。
②装置I中电池总反应为2C2H6+7O2+8OH-=4CO32-+10H2O,OH-浓度减小,pH变小。装置II中Cu极的电极反应式为Cu-2e-=Cu2+,Fe极的电极反应式为Cu2++2e-=Cu,装置II中Cu2+的物质的量浓度不变。
③根据装置I中的电池总反应,电镀结束后装置I溶液中的阴离子除了OH-外还含有CO32-。装置II中阴极电极反应为Cu2++2e-=Cu,装置I中负极反应式为C2H6-14e-+18OH-=2CO32-+12H2O,根据电子守恒,2n(Cu)=14n(C2H6),n(C2H6)=n(Cu)==mol,消耗乙烷在标准状况下的体积为mol22.4L/mol=0.64L。
点睛:本题解题的关键是电极的判断,根据电镀原理判断电极。难点是燃料电池电极反应式的书写。关于燃料电池必须注意:(1)燃料电池中,通入O2的一极为正极,通入燃料的一极为负极;(2)燃料电池的电池总反应一般与燃烧反应相同(注意:碱性条件下不生成CO2,生成CO32-);(3)书写有机物燃料电池负极电极反应式时,有机物中碳元素的化合价用平均价态,如C2H6中H元素的化合价为+1价,则C元素的化合价为-3价,反应后被氧化成+4价碳的化合物(在碱性条件下生成CO32-,其他条件下生成CO2),则1molC2H6发生氧化反应失去14mol电子。
18.0.005 mol/(L·min); 4
【解析】
试题分析:(1)因为在2 min末生成0.03 mol W,则根据方程式中X与M的物质的量的比为4:6,所以消耗的X的物质的量为0.02mol。因此前2 min内用X的浓度变化表示的平均反应速率为(0.02mol÷2 L)÷2min=0.005 mol/(L·min)。(2)V(Z)=0.005 mol·(L·min)-1,所以在前2分钟内Z的物质的量变化:0.005 mol·(L·min)-1×2min×2L=0.02mol.因为在化学方程式中,物质的方程式前边的系数比等于其物质的量的比,所以n:6=0.02mol: 0.03 mol。解得n=4。
考点:考查化学反应速率的计算及不同物质间的速率关系的知识。
19.(1)① 1370 ② 1852 (2)463
(3)2H2(g) + O2(g)====2H2O(l)ΔH =-570 kJ·mol-1
【解析】
试题分析:(1)①吸收的能量应为2molH2和1molO2吸收的能量,为2×436kJ + 498kJ=1370kJ,由图象可知2H2(g) + O2(g)=2H2O(g)△H=-482kJ?mol-1,反应热为反应物的总键能减去生成物的总键能,则②放出的热量为1370kJ + 482kJ=1852kJ,故答案为:①1370;②1852;
(2)②放出的热量为1852kJ,可知生成2molH2O放出1852kJ,则H-O键的键能为=463kJ,故答案为:463;
(3)已知①2H2(g) + O2(g)=2H2O(g)△H=-482kJ?mol-1,
②H2O(l)=H2O(g)△H= + 44kJ?mol-1,
利用盖斯定律将①-②×2
可知2H2(g) + O2(g)=2H2O(l)△H=-570kJ/mol,
故答案为:2H2(g) + O2(g)=2H2O(l)△H=-570kJ/mol.
考点:考查化学反应与能量
20.第三周期第ⅢA族O2->Na+HClO4>H2SO4(或,答案合理即可)2Na(s)+O2(g)=Na2O2(s) △H=-511kJ·mol-1Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+)2Al2O3(熔融)4Al+3O2↑
【解析】
【分析】
根据八种元素的最高正价或最低负价分析,x、y、z、d、e、f、g、h依次处于第IA族、第IVA族、第VA族、第VIA族、第IA族、第IIIA族、第VIA族、第VIIA族,结合原子序数和原子半径的图像,x、y、z、d、e、f、g、h依次为H、C、N、O、Na、Al、S、Cl元素。根据元素周期表、元素周期律和相关化学用语作答。
【详解】
根据八种元素的最高正价或最低负价分析,x、y、z、d、e、f、g、h依次处于第IA族、第IVA族、第VA族、第VIA族、第IA族、第IIIA族、第VIA族、第VIIA族,结合原子序数和原子半径的图像,x、y、z、d、e、f、g、h依次为H、C、N、O、Na、Al、S、Cl元素。
(1)f为Al元素,Al在元素周期表的位置是第三周期第IIIA族。
(2)d、e的简单离子依次为O2-、Na+,O2-、Na+具有相同的电子层结构,核电荷数:O2-
(3)上述元素组成的常见四原子共价化合物有:C2H2、NH3、H2O2等,它们的电子式依次为、、。
(4)Na(s)在O2(g)中燃烧生成Na2O2(s),反应的热化学方程式为Na(s)+O2(g)=Na2O2(s)ΔH=-255.5kJ/mol(或2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ/mol)。
(5)由f、h组成的物质X为AlCl3,由x、z形成的化合物Y为NH3;X与Y在水溶液中反应生成M和Z,M是仅含非金属元素的盐,M为NH4Cl,Z为Al(OH)3,Al(OH)3受热分解生成的N为Al2O3,电解熔融Al2O3生成Al和O2。
①X溶液与Y溶液反应的化学方程式为:AlCl3+3NH3+3H2O=Al(OH)3↓+3NH4Cl(或AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl),反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+(或Al3++3NH3·H2O=Al(OH)3↓+3NH4+)。
②工业上电解熔融Al2O3制备Al,工业上制备Al的化学方程式为:2Al2O3(熔融)4Al+3O2↑。
21.第四周期第Ⅷ族 FeCl2 8Al+3Fe3O44Al2O3+9Fe 2Al+2OH-+2H2O===2AlO2—+3H2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 ①②
【解析】
G为主族元素的固态氧化物,电解G得到I和H,G能和氢氧化钠溶液反应生成J,I能和氢氧化钠溶液反应生成J,工业上常用电解氧化铝的方法冶炼铝,则G是Al2O3,I是Al,J是NaAlO2,H是O2,Al和B能在高温下反应生成A,A能在氧气中燃烧生成B,B与铝在高温下发生铝热反应,则B是金属氧化物,A是金属单质,B和盐酸反应生成C和D,C和氢氧化钠反应生成E,D和氨水反应生成F,E在空气中反应生成F,说明E不稳定,易被氧气氧化,且A、B、C、D、E、F六种物质中均含同一种元素,则A是Fe、B为Fe3O4、C为FeCl2、D为FeCl3、E为Fe(OH)2、F为Fe(OH)3。
(1). 由上述分析可知,A、B、C、D、E、F六种物质中所含的同一种元素是Fe,Fe位于第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2). C是氯化亚铁,化学式为FeCl2,故答案为:FeCl2;
(3). 由上述分析可知,反应①的化学方程式为:8Al+3Fe3O4 4Al2O3+9Fe,反应④的离子方程式为:2Al+2OH-+2H2O=2AlO2—+3H2↑,反应⑥的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:8Al+3Fe3O4 4Al2O3+9Fe;2Al+2OH-+2H2O=2AlO2—+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4). △H<0的反应为放热反应,①是铝热反应,②是燃烧反应,均为常见的放热反应,③是电解反应,为吸热反应,故答案为:①②。
点睛:本题考查无机物的推断,试题难度较大,突破本题的关键点是:1、G为主族元素的固态氧化物,在电解条件下生成I和H,能与NaOH溶液反应,说明G为Al2O3;2、C、D分别和碱反应生成E、F,说明E、F都为氢氧化物,E能在空气中转化为F,说明应为变价金属,进而推知A、B、C、D、E、F六种物质中所含的同一种元素是Fe,再利用图中所示转化关系解答即可。
22. 两支试管中产生气泡的快慢 Fe2(SO4)3 2HMnO3+H2O2=2MnO2+2H2O+O2↑ 第一步 产生40ml气体所需要的时间
【解析】(1)该反应中产生气体,所以可根据生成气泡的快慢判断,即可通过观察两支试管中产生气泡的快慢定性比较得出结论;(2)氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,因此为消除阴离子的干扰,应将FeCl3改为更为Fe2(SO4)3合理;(3)双氧水在二氧化锰作用下生成水和氧气,所以反应方程式为2H2O2=2H2O+O2↑,因此第二步的化学方程式为2HMnO3+H2O2=2MnO2+2H2O+O2↑;总反应速率由反应最慢的那一步决定,所以总反应速率由第一步决定。(4)该反应是通过生成气体的反应速率分析判断的,所以根据v=△V÷△t知,需要测量的数据是产生40mL气体所需要的时间。
点睛:本题考查了催化剂的作用及化学反应速率的影响因素等知识点,要会分析将FeCl3改为Fe2(SO4)3更为合理的理由,注意控制变量法的灵活应用。
23.(1)Ca(OH)2 CaCO3
(2)放热
(3)Ca(OH)2 和CaCO3的混合物(开放性试题,其他符合题意的猜想也可)
【解析】
试题分析:(1)生石灰在空气中易吸吸收空气中的水蒸汽变成氢氧化钙,氢氧化钙又易与二氧化碳反应生 成碳酸钙,则此固体中可能含有氢氧化钙与碳酸钙;
(2)白色粉末中可能含有未反应完全的氧化钙,由于氧化钙溶于水会放热,则此固体溶于水后会放出 热量。
(3)部分生石灰在空气中会与水反应生成氢氧化钙,氢氧化钙又易与二氧化碳反应生成碳酸钙,由于氢氧化钙是微溶物,量多时也会以沉淀的形式存在,故生成的白色沉淀也可能是两者的混合物.
【考点定位】本题主要是考查实验设计与探究
【名师点晴】明确生石灰等有关物质的化学性质以及实验原理是解答的关键,注意实验原理是解答实验题的核心,是实验设计的依据和起点。实验原理可从题给的化学情景(或题首所给实验目的)并结合元素化合物等有关知识获取。在此基础上,遵循可靠性、简捷性、安全性的原则,确定符合实验目的、要求的方案
24.(1)1.2 mol/L(2) 0.6 mol/(L·min)
【解析】试题分析:(1)2min末测得容器中有1.6mol SO2,则参加反应的二氧化硫物质的量为4mol-1.6mol=2.4mol,由方程式可知生成的三氧化硫的物质的量为2.4mol,三氧化硫的浓度为2.4mol÷2L=1.2mol/L,
(2)v(SO2)="2.4mol÷(2L×2min)=0.6" mol/(L.min),对同一个化学反应,不同物质表示的化学反应速率不同,速率之比等于化学计量数之比,则v (O2)="1/2×0.6" mol/(L?min)=0.3mol/(L·min)
考点:考查化学反应速率的计算等知识。
