图 示 题 的 分 类 解 析[下学期]
文档属性
| 名称 | 图 示 题 的 分 类 解 析[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 353.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-04-28 00:00:00 | ||
图片预览

文档简介
图 示 题 的 分 类 解 析
教学目标: 浙江省黄岩中学 王万林
知识目标:1.了解图示题的几种常见题型,掌握图示题的解题方法。
2.通过对图示题的分类解析,复习并巩固相关的基础知识。
能力培养:1.通过对图示题的分类解析,培养学生的观察能力和思维能力。
2.通过对图示题的分类解析,促进学生实验能力、自学能力的提高和良好思维品质的形成。
3.通过分析与综合、比较与论证,选择解决问题的最佳方案和评价能力。
科学思想:通过各类图示题的训练,使学生对化学基本知识能更深入的理解和应用,通过题示信息的捕获、理解、加工,加强思维的敏捷性、严密性、整体性及创造性。
科学方法:1.通过分析各类图示题,形成形象~抽象思维、求同~求异思维、直觉~判断思维、集中~发散思维。
2.通过数学抽象和简明的文字表达,解决图示题的答题方法。
教学重点:图示题的解析
教学难点:图示题分类解析的突破口
教学内容:
2006年《考试大纲》在“观察能力”方面要求学生具有“能够通过对实验现象、实物、模型、图形、图表以及自然界、生产、生活中的化学现象的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆”的能力。对客观事物的观察是获得知识的最基本途径,也是认识客观事物的最基本环节,更是思维的基础。通过对题设情境的分解,找出解答的关键,并能够运用自己存储的知识,将它们分解、迁移转换、重组,使问题得到顺利解决,体现较高的能力要求。下面以近几年高考题中的图示题为例进行分析,希望大家对图示题引起重视并掌握好这部分知识。
一、模型类图示题
常常是反映理论知识内容的一些问题,如化学平衡问题分析、测试物质结构知识(如晶体结构图示、球棍模型、比例模型、有机物的空间结构图示)等。
例1 金刚石、二氧化硅晶体的模型如下图所示:
2NA 4NA
12 g金刚石中含有C—C键的个数为 ,60 g SiO2中含Si—O键的个数为 。
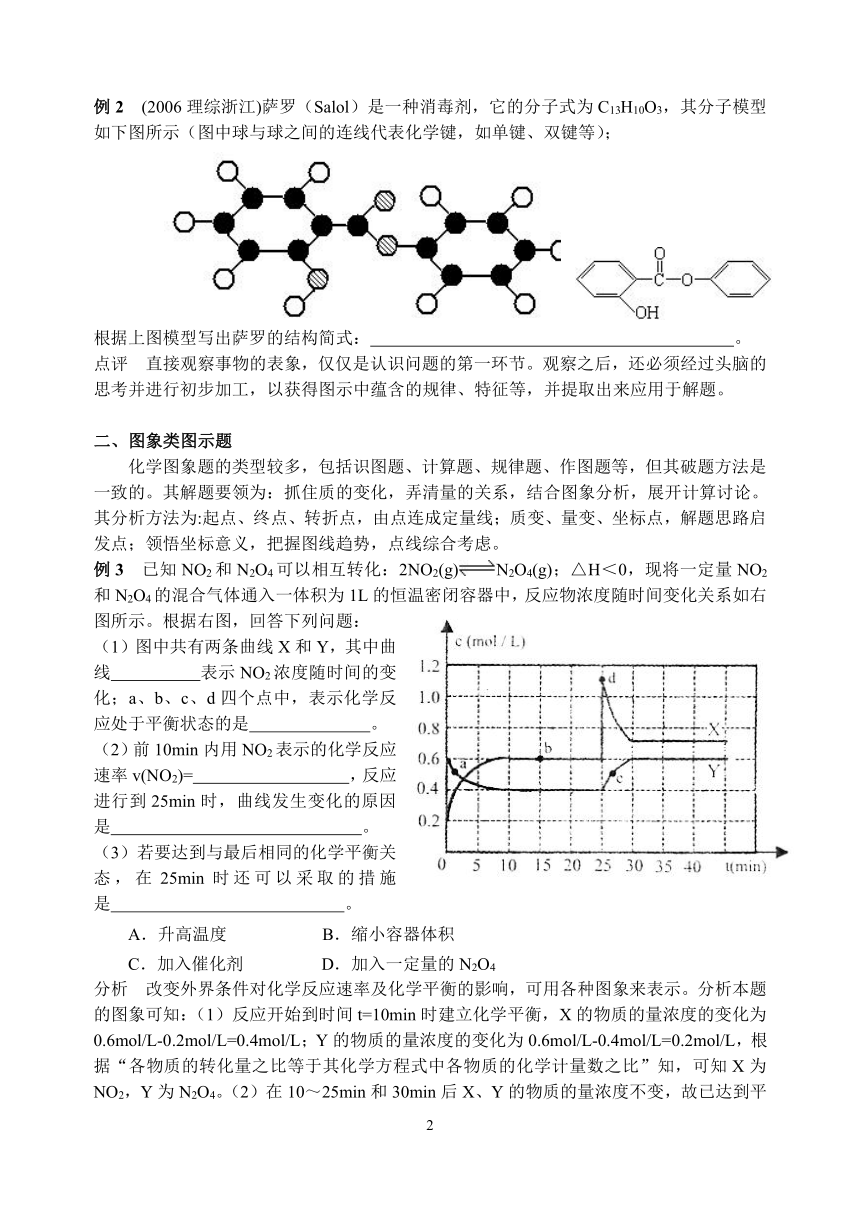
例2 (2006理综浙江)萨罗(Salol)是一种消毒剂,它的分子式为C13H10O3,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等);
根据上图模型写出萨罗的结构简式: 。
点评 直接观察事物的表象,仅仅是认识问题的第一环节。观察之后,还必须经过头脑的思考并进行初步加工,以获得图示中蕴含的规律、特征等,并提取出来应用于解题。
二、图象类图示题
化学图象题的类型较多,包括识图题、计算题、规律题、作图题等,但其破题方法是一致的。其解题要领为:抓住质的变化,弄清量的关系,结合图象分析,展开计算讨论。其分析方法为:起点、终点、转折点,由点连成定量线;质变、量变、坐标点,解题思路启发点;领悟坐标意义,把握图线趋势,点线综合考虑。
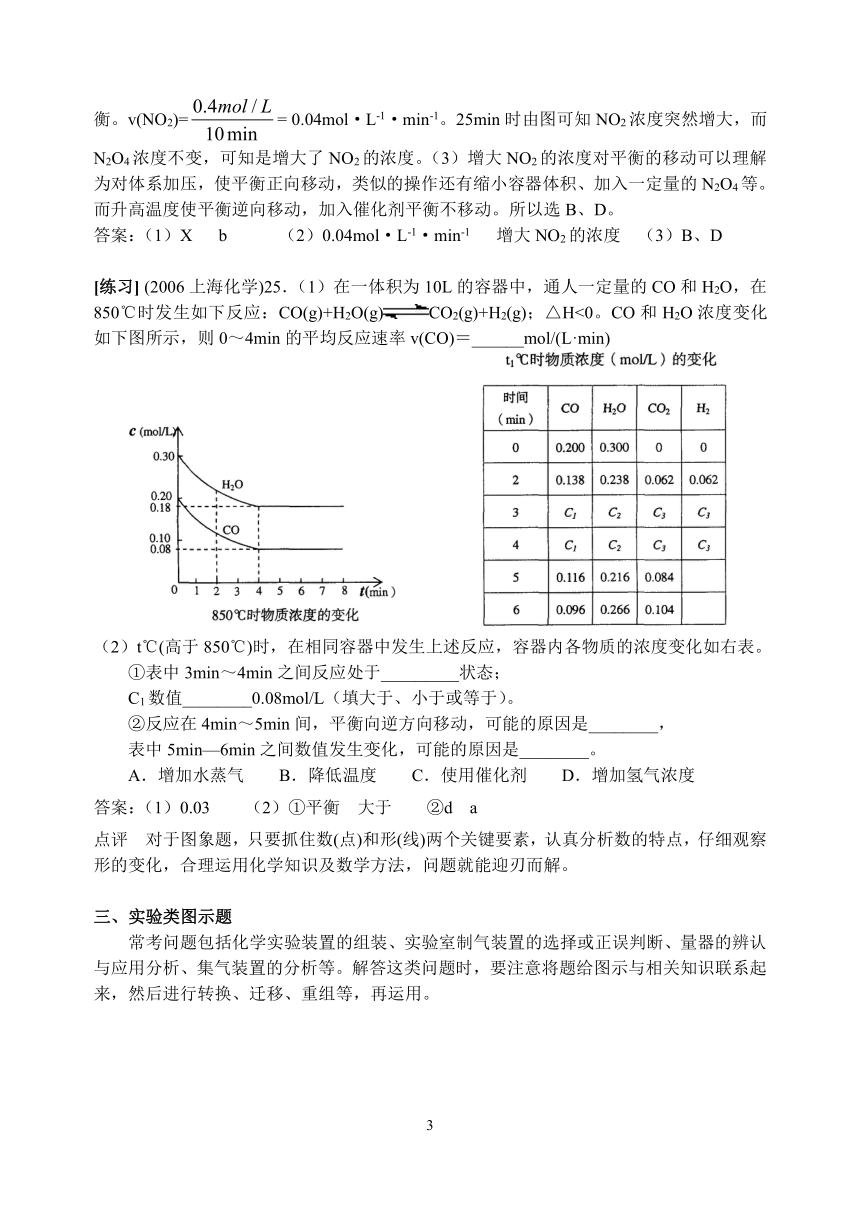
例3 已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g);△H<0,现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。根据右图,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线 表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的是 。
(2)前10min内用NO2表示的化学反应速率v(NO2)= ,反应进行到25min时,曲线发生变化的原因是 。
(3)若要达到与最后相同的化学平衡关态,在25min时还可以采取的措施是 。
A.升高温度 B.缩小容器体积
C.加入催化剂 D.加入一定量的N2O4
分析 改变外界条件对化学反应速率及化学平衡的影响,可用各种图象来表示。分析本题的图象可知:(1)反应开始到时间t=10min时建立化学平衡,X的物质的量浓度的变化为0.6mol/L-0.2mol/L=0.4mol/L;Y的物质的量浓度的变化为0.6mol/L-0.4mol/L=0.2mol/L,根据“各物质的转化量之比等于其化学方程式中各物质的化学计量数之比”知,可知X为NO2,Y为N2O4。(2)在10~25min和30min后X、Y的物质的量浓度不变,故已达到平衡。v(NO2)== 0.04mol·L-1·min-1。25min时由图可知NO2浓度突然增大,而N2O4浓度不变,可知是增大了NO2的浓度。(3)增大NO2的浓度对平衡的移动可以理解为对体系加压,使平衡正向移动,类似的操作还有缩小容器体积、加入一定量的N2O4等。而升高温度使平衡逆向移动,加入催化剂平衡不移动。所以选B、D。
答案:(1)X b (2)0.04mol·L-1·min-1 增大NO2的浓度 (3)B、D
[练习] (2006上海化学)25.(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图所示,则0~4min的平均反应速率v(CO)=______mol/(L·min)
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。
①表中3min~4min之间反应处于_________状态;
C1数值________0.08mol/L(填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是________,
表中5min—6min之间数值发生变化,可能的原因是________。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
答案:(1)0.03 (2)①平衡 大于 ②d a
点评 对于图象题,只要抓住数(点)和形(线)两个关键要素,认真分析数的特点,仔细观察形的变化,合理运用化学知识及数学方法,问题就能迎刃而解。
三、实验类图示题
常考问题包括化学实验装置的组装、实验室制气装置的选择或正误判断、量器的辨认与应用分析、集气装置的分析等。解答这类问题时,要注意将题给图示与相关知识联系起来,然后进行转换、迁移、重组等,再运用。
例4 某校化学课外活动小组组装了下列仪器,如图所示。欲经过简单连接,制备中学化学中几种常见气体。请填写下列表格中的空白:
序号 气体 装置的连接顺序(用编号表示) 按要求填试剂名称 制备该气体的化学反应方程式(是离子反应的要写出离子反应方程式)
(1) CO2 制备→收集( )→( )
(2) NH3 制备→收集→尾气处理( )→( )→( ) 若干燥NH3可选用的试剂
(3) Cl2 制备→净化→干燥→收集→尾气处理( )→( )→( )→( )→( ) 处理尾气的试剂
答案:(1)D→H CaCO3+2H+ Ca2++CO2↑+H2O
(2)A→I→L 碱石灰(或NaOH固体) Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O
(3)B→G→E→H→K(F代替K也可)NaOH溶液
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
点评 将图示分段,再对图示的各个部分仔细分析,并与题意要求相结合.一要往意反应原理或物质性质与装置原理的一致性,二要注意思维方法,如反推、转化等,灵活分析。
四、实物类图示题
新高考以能力立意为主,如用图示代替语言描述就是一个例证。通过图示反映题设情景的实际状况,能够较好的测试学生观察、分析等能力。处理这类间题的基本程序是:分解→联系→突破→整合。
例5 (2006理综江苏)(1)有右下图所示A、B、C、D四种仪器:
请选择下列仪器名称的序号,填人相应的空格内:
①烧杯 ②普通漏斗 ③圆底烧瓶 ④锥形瓶 ⑤分液漏斗 ⑥酸式滴定管
A ______________ B______________C______________D______________
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为______________g.
(3)指出下面3个实验中各存在的一个错误:
A_____________________,B______________________,C______________________。
答案:(1)③⑤④⑥ (2)砝码放在左盘,烧杯放在右盘(或砝码和物品的位置放反了) 27.4
(3)A.滴管口伸人试管中错 B.试管口向上错 C.混合气体从短导管进入洗气瓶错
五、其它类图示题
例6 如图所示,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应。供填写的物质有:
a.Na2CO3溶液 b.MgSO4溶液
c.BaCl2溶液 d.稀H2SO4溶液
e.铁 f.Cu(NO3)2溶液
则图中编号代表的物质是 B
A.a B.d C.e D.f
[课堂小结]通过对以上五类图示题的分析,使我们对化学基本知识能有深入的理解和应用,熟悉了图示题信息的捕获、理解和加工方法。
[反馈练习]
1.某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单健或双健或三健,不同颜色的球代表不同元素的原子,该模型图可代表一种 C
A.卤代羧酸 B.酯 C.氨基酸 D.醇钠
2.(2004年广东大综合)已知KMnO4与浓HCl在常温下反应能产生Cl2。若用图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应,每个虚线框表示一个单元装置。其中错误的是 ( )
A.只有①和②处 B.只有② C.只有②和③处 D.只有②、③、④处
3.(2006理综四川)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示。下列描述正确的是 C
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应开始时10s,X的物质的量浓度减少了0.79mol/L
C.反应开始时10s,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)Z(g)
4.某化学反应2A(g)B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行。
B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
时间实验序号 1 10 20 30 40 50 60
1 800℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800℃ c2 0.60 0.50 0.50 0.50 0.50 0.50
3 800℃ c3 0.92 0.75 0.63 0.60 0.60 0.60
4 820℃ 1.0 0.20 0.20 0.20 0.20 0.20 0.20
(1)实验1中,反应在10至20分钟时间内平均化学反应速率为 。
(2)实验2中,反应经20min就达到平衡,可推测实验2中隐含的条件可能是 。
(3)设实验3的化学反应速率为,实验1的化学反应速率为,则 (填“>”“=”或“<”)
(4)比较实验4和实验1,可推测该反应的正反应是 反应(填“吸热”或“放热”)。
答案:(1)0.013mol/(L·min) (2)使用催化剂 (3)> (4)吸热,
5.右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是 B
A.大理石和稀硫酸制取二氧化碳 B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气 D.电石和水制取乙炔
6.T℃时,反应物和生成物均为气体的某反应,反应过程中浓度变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是 C
A.在t1时间内用B表示该反应的平均速率为:0.6mol·L-1·min-1
B.在(t1+a)时,保持其他条件不变,增大压强,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.1 mol·L-1A、0.3 mol·L-1B和0.4 mol·L-1C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.在其他条件不变时,升高温度,正、逆反应速率均增大,且A的转化率增大
6
5
4
3
2
1
△
△
PAGE
6
教学目标: 浙江省黄岩中学 王万林
知识目标:1.了解图示题的几种常见题型,掌握图示题的解题方法。
2.通过对图示题的分类解析,复习并巩固相关的基础知识。
能力培养:1.通过对图示题的分类解析,培养学生的观察能力和思维能力。
2.通过对图示题的分类解析,促进学生实验能力、自学能力的提高和良好思维品质的形成。
3.通过分析与综合、比较与论证,选择解决问题的最佳方案和评价能力。
科学思想:通过各类图示题的训练,使学生对化学基本知识能更深入的理解和应用,通过题示信息的捕获、理解、加工,加强思维的敏捷性、严密性、整体性及创造性。
科学方法:1.通过分析各类图示题,形成形象~抽象思维、求同~求异思维、直觉~判断思维、集中~发散思维。
2.通过数学抽象和简明的文字表达,解决图示题的答题方法。
教学重点:图示题的解析
教学难点:图示题分类解析的突破口
教学内容:
2006年《考试大纲》在“观察能力”方面要求学生具有“能够通过对实验现象、实物、模型、图形、图表以及自然界、生产、生活中的化学现象的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆”的能力。对客观事物的观察是获得知识的最基本途径,也是认识客观事物的最基本环节,更是思维的基础。通过对题设情境的分解,找出解答的关键,并能够运用自己存储的知识,将它们分解、迁移转换、重组,使问题得到顺利解决,体现较高的能力要求。下面以近几年高考题中的图示题为例进行分析,希望大家对图示题引起重视并掌握好这部分知识。
一、模型类图示题
常常是反映理论知识内容的一些问题,如化学平衡问题分析、测试物质结构知识(如晶体结构图示、球棍模型、比例模型、有机物的空间结构图示)等。
例1 金刚石、二氧化硅晶体的模型如下图所示:
2NA 4NA
12 g金刚石中含有C—C键的个数为 ,60 g SiO2中含Si—O键的个数为 。
例2 (2006理综浙江)萨罗(Salol)是一种消毒剂,它的分子式为C13H10O3,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等);
根据上图模型写出萨罗的结构简式: 。
点评 直接观察事物的表象,仅仅是认识问题的第一环节。观察之后,还必须经过头脑的思考并进行初步加工,以获得图示中蕴含的规律、特征等,并提取出来应用于解题。
二、图象类图示题
化学图象题的类型较多,包括识图题、计算题、规律题、作图题等,但其破题方法是一致的。其解题要领为:抓住质的变化,弄清量的关系,结合图象分析,展开计算讨论。其分析方法为:起点、终点、转折点,由点连成定量线;质变、量变、坐标点,解题思路启发点;领悟坐标意义,把握图线趋势,点线综合考虑。
例3 已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g);△H<0,现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。根据右图,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线 表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的是 。
(2)前10min内用NO2表示的化学反应速率v(NO2)= ,反应进行到25min时,曲线发生变化的原因是 。
(3)若要达到与最后相同的化学平衡关态,在25min时还可以采取的措施是 。
A.升高温度 B.缩小容器体积
C.加入催化剂 D.加入一定量的N2O4
分析 改变外界条件对化学反应速率及化学平衡的影响,可用各种图象来表示。分析本题的图象可知:(1)反应开始到时间t=10min时建立化学平衡,X的物质的量浓度的变化为0.6mol/L-0.2mol/L=0.4mol/L;Y的物质的量浓度的变化为0.6mol/L-0.4mol/L=0.2mol/L,根据“各物质的转化量之比等于其化学方程式中各物质的化学计量数之比”知,可知X为NO2,Y为N2O4。(2)在10~25min和30min后X、Y的物质的量浓度不变,故已达到平衡。v(NO2)== 0.04mol·L-1·min-1。25min时由图可知NO2浓度突然增大,而N2O4浓度不变,可知是增大了NO2的浓度。(3)增大NO2的浓度对平衡的移动可以理解为对体系加压,使平衡正向移动,类似的操作还有缩小容器体积、加入一定量的N2O4等。而升高温度使平衡逆向移动,加入催化剂平衡不移动。所以选B、D。
答案:(1)X b (2)0.04mol·L-1·min-1 增大NO2的浓度 (3)B、D
[练习] (2006上海化学)25.(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图所示,则0~4min的平均反应速率v(CO)=______mol/(L·min)
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。
①表中3min~4min之间反应处于_________状态;
C1数值________0.08mol/L(填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是________,
表中5min—6min之间数值发生变化,可能的原因是________。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
答案:(1)0.03 (2)①平衡 大于 ②d a
点评 对于图象题,只要抓住数(点)和形(线)两个关键要素,认真分析数的特点,仔细观察形的变化,合理运用化学知识及数学方法,问题就能迎刃而解。
三、实验类图示题
常考问题包括化学实验装置的组装、实验室制气装置的选择或正误判断、量器的辨认与应用分析、集气装置的分析等。解答这类问题时,要注意将题给图示与相关知识联系起来,然后进行转换、迁移、重组等,再运用。
例4 某校化学课外活动小组组装了下列仪器,如图所示。欲经过简单连接,制备中学化学中几种常见气体。请填写下列表格中的空白:
序号 气体 装置的连接顺序(用编号表示) 按要求填试剂名称 制备该气体的化学反应方程式(是离子反应的要写出离子反应方程式)
(1) CO2 制备→收集( )→( )
(2) NH3 制备→收集→尾气处理( )→( )→( ) 若干燥NH3可选用的试剂
(3) Cl2 制备→净化→干燥→收集→尾气处理( )→( )→( )→( )→( ) 处理尾气的试剂
答案:(1)D→H CaCO3+2H+ Ca2++CO2↑+H2O
(2)A→I→L 碱石灰(或NaOH固体) Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O
(3)B→G→E→H→K(F代替K也可)NaOH溶液
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
点评 将图示分段,再对图示的各个部分仔细分析,并与题意要求相结合.一要往意反应原理或物质性质与装置原理的一致性,二要注意思维方法,如反推、转化等,灵活分析。
四、实物类图示题
新高考以能力立意为主,如用图示代替语言描述就是一个例证。通过图示反映题设情景的实际状况,能够较好的测试学生观察、分析等能力。处理这类间题的基本程序是:分解→联系→突破→整合。
例5 (2006理综江苏)(1)有右下图所示A、B、C、D四种仪器:
请选择下列仪器名称的序号,填人相应的空格内:
①烧杯 ②普通漏斗 ③圆底烧瓶 ④锥形瓶 ⑤分液漏斗 ⑥酸式滴定管
A ______________ B______________C______________D______________
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为______________g.
(3)指出下面3个实验中各存在的一个错误:
A_____________________,B______________________,C______________________。
答案:(1)③⑤④⑥ (2)砝码放在左盘,烧杯放在右盘(或砝码和物品的位置放反了) 27.4
(3)A.滴管口伸人试管中错 B.试管口向上错 C.混合气体从短导管进入洗气瓶错
五、其它类图示题
例6 如图所示,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应。供填写的物质有:
a.Na2CO3溶液 b.MgSO4溶液
c.BaCl2溶液 d.稀H2SO4溶液
e.铁 f.Cu(NO3)2溶液
则图中编号代表的物质是 B
A.a B.d C.e D.f
[课堂小结]通过对以上五类图示题的分析,使我们对化学基本知识能有深入的理解和应用,熟悉了图示题信息的捕获、理解和加工方法。
[反馈练习]
1.某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单健或双健或三健,不同颜色的球代表不同元素的原子,该模型图可代表一种 C
A.卤代羧酸 B.酯 C.氨基酸 D.醇钠
2.(2004年广东大综合)已知KMnO4与浓HCl在常温下反应能产生Cl2。若用图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应,每个虚线框表示一个单元装置。其中错误的是 ( )
A.只有①和②处 B.只有② C.只有②和③处 D.只有②、③、④处
3.(2006理综四川)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示。下列描述正确的是 C
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应开始时10s,X的物质的量浓度减少了0.79mol/L
C.反应开始时10s,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)Z(g)
4.某化学反应2A(g)B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行。
B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
时间实验序号 1 10 20 30 40 50 60
1 800℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800℃ c2 0.60 0.50 0.50 0.50 0.50 0.50
3 800℃ c3 0.92 0.75 0.63 0.60 0.60 0.60
4 820℃ 1.0 0.20 0.20 0.20 0.20 0.20 0.20
(1)实验1中,反应在10至20分钟时间内平均化学反应速率为 。
(2)实验2中,反应经20min就达到平衡,可推测实验2中隐含的条件可能是 。
(3)设实验3的化学反应速率为,实验1的化学反应速率为,则 (填“>”“=”或“<”)
(4)比较实验4和实验1,可推测该反应的正反应是 反应(填“吸热”或“放热”)。
答案:(1)0.013mol/(L·min) (2)使用催化剂 (3)> (4)吸热,
5.右图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是 B
A.大理石和稀硫酸制取二氧化碳 B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气 D.电石和水制取乙炔
6.T℃时,反应物和生成物均为气体的某反应,反应过程中浓度变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是 C
A.在t1时间内用B表示该反应的平均速率为:0.6mol·L-1·min-1
B.在(t1+a)时,保持其他条件不变,增大压强,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.1 mol·L-1A、0.3 mol·L-1B和0.4 mol·L-1C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.在其他条件不变时,升高温度,正、逆反应速率均增大,且A的转化率增大
6
5
4
3
2
1
△
△
PAGE
6
同课章节目录
