氮族元素学案[上学期]
图片预览

文档简介
第八章氮族元素学案
学习目标:
1、根据氮族元素在周期表的位置及结构特点,掌握该族元素的非金属性及其重要性质的递变规律,并和相邻的氧族、卤素进行比较。掌握氮气的性质和用途。
2、根据氨分子的结构特点,掌握氨的性质、制法、用途,掌握铵盐的特性和检验方法。
3、比较并掌握氮的两种重要氧化物NO和NO2的性质。
4、掌握硝酸的重要性质和用途,工业上氨的催化氧化法制硝酸的原理,了解硝酸工业尾气的吸收。
5比较磷的两种同素异形体的物理性质,掌握磷的重要的化学性质和用途。
一、氮族元素概述
1. 写出氮族元素的元素名称和元素符号
2. 原子核外电子排布的规律
3. 依据元素周期律预测氮族元素性质走势
4 . 性质递变规律:(从上到下)
a、单质的熔沸点:
b、元素的金属性、非金属性:
c、最高价氧化物的水化物酸性
d、气态氢化物稳定性
e、主要化合价
二、单质(一)氮气
1、分子结构(写电子式):
2、物理性质:
3、化学性质:常温下比较稳定
(1)氧化性:N2+3Mg— (点燃) 生成固体是 色
N2+3H2— 条件是:
(2)还原性:N2+O2— 条件是:
4、制备 工业制法:利用的原理是:
采用的方法是:
(2) 磷(红磷、白磷)1、分子结构:分子晶体
2、物理性质:
白磷 红磷
分子结构 属于 晶体 结构复杂,属于 晶体
颜色 色 状固体 色粉未
密度(g·cm-3) 1.82 2.34
溶解性 溶于水, 溶于CS2 溶于水, 溶于CS2
毒性 毒性 毒性
着火点 ,易自燃 可燃
还原性 易被氧化,发磷光 不易被氧化
保存 少量保存在 贮存在
相互转化 条件下,白磷加热到260℃可转化为红磷,红磷加热到416℃以上(升华)可得到白磷。
3、化学性质:
P+ O2= (点燃)
P2O5 + H2O(冷)= (偏磷酸剧毒)
P2O5 + H2O(热)= (无毒)
P + Cl2= (点燃)
P + Cl2= (点燃)
三、氢化物———氨气
1、分子结构(写出电子式): 属于 分子
2、物理性质: 色、有刺 性气味、 溶于水、易 的气体(1:700)
3、化学性质:
(1)碱性
(2)还原性
(3)络合
(4)其他
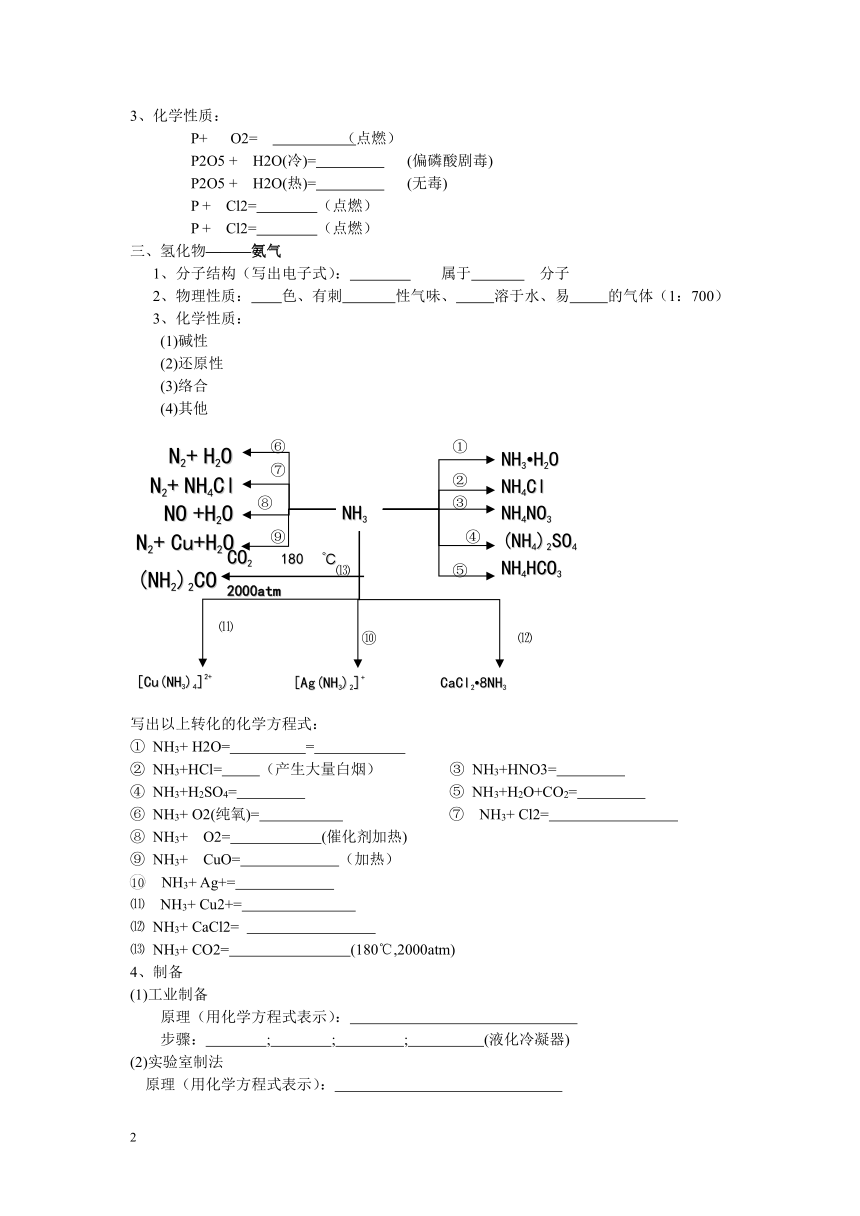
写出以上转化的化学方程式:
① NH3+ H2O= =
② NH3+HCl= (产生大量白烟) ③ NH3+HNO3=
④ NH3+H2SO4= ⑤ NH3+H2O+CO2=
⑥ NH3+ O2(纯氧)= ⑦ NH3+ Cl2=
⑧ NH3+ O2= (催化剂加热)
⑨ NH3+ CuO= (加热)
10 NH3+ Ag+=
⑾ NH3+ Cu2+=
⑿ NH3+ CaCl2=
⒀ NH3+ CO2= (180℃,2000atm)
4、制备
(1)工业制备
原理(用化学方程式表示):
步骤: ; ; ; (液化冷凝器)
(2)实验室制法
原理(用化学方程式表示):
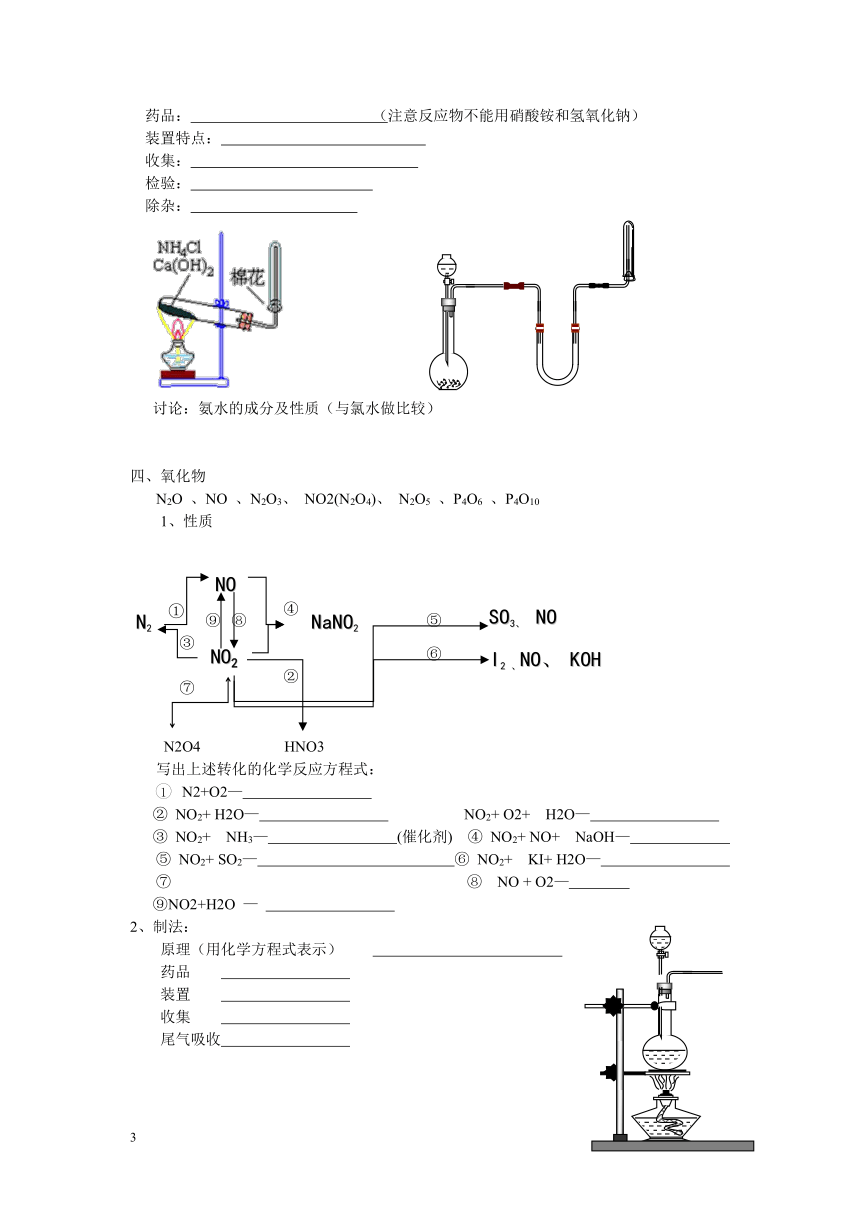
药品: (注意反应物不能用硝酸铵和氢氧化钠)
装置特点:
收集:
检验:
除杂:
讨论:氨水的成分及性质(与氯水做比较)
四、氧化物
N2O 、NO 、N2O3、 NO2(N2O4)、 N2O5 、P4O6 、P4O10
1、性质
N2O4 HNO3
写出上述转化的化学反应方程式:
1 N2+O2—
② NO2+ H2O— NO2+ O2+ H2O—
③ NO2+ NH3— (催化剂) ④ NO2+ NO+ NaOH—
⑤ NO2+ SO2— ⑥ NO2+ KI+ H2O—
⑦ ⑧ NO + O2—
⑨NO2+H2O —
2、制法:
原理(用化学方程式表示)
药品
装置
收集
尾气吸收
五、含氧酸
(—)硝酸
1、结构:
2、物理性质: 色,易 液体, 溶于水
3、化学性质:
不稳定性(光照或加热),如何保存:
酸性
强氧化性(与金、铂不反应)
与有机物反应
写出上述转化的化学反应方程式:
1、 HNO3=
2、C + HNO3(浓)=
3、P+ HNO3 (浓)=
4、S+ HNO3浓)=
5、Cu+ HNO3 (浓)= 、Cu+ HNO3(稀)=
6、 H2S+ HNO3(稀)=
7、 SO2+ H2O+ HNO3 (稀)=
8、 Fe2++ H++ NO3-=
9、 Br-+ NO3-+ H+=
10、 Na2SO3+ HNO3=
11、C6H6+ HNO3→
13、 CH2OH CH2ONO2
| |
CHOH +3HNO3→CHO NO2 +3H2O
| |
CH2OH CH2O NO2
【注意】
①浓硝酸的挥发性和不稳定性 (填是或不是)为同一性质;浓硝酸与浓硫酸的受热分解不同之处是: 是氧化还原反应。
2 过铜分别与浓、稀硝酸和浓、稀硫酸的反应,知其氧化性
铁和铝投入到冷、浓的硝酸或硫酸中, (填能或不能)发生反应。
③硝酸遇还原性物质(如Fe2+、S2-、I-、SO32-等)显 ,遇非还原性物质如CuO可显酸性,如遇FeO、Cu等,既显 又显 。
④NO3-在水溶液中的氧化性与溶液的酸碱性有关,如在 中,其氧化性较强。
4、制备
(1)工业制法
步骤及原理:氨的氧化(氧化炉)
硝酸的生成(吸收塔)
计算关系:NH3——NO——NO2——HNO3
尾气处理:NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
(2)实验室制备
原理:
药品:
装置:固液加热(曲颈甑)
收集:冷凝
(2) 磷酸
物理性质: 色晶体,易吸水, 溶于水,沸点 。
化学性质: 弱酸,非氧化性酸。
具有酸的通性。
H3PO4+NaOH =
H3PO4+2NaOH =
H3PO4+3NaOH =
磷酸的制取:Ca3(PO4)2 + H2SO4(浓)——
六、盐类化合物
(一)铵盐: 特性:可溶于水。
(1)受热易分解 NH4Cl = (Δ)
NH4HCO3 = (Δ)
(2)与碱反应 NH4Cl+NaOH = (稀溶液)
NH4Cl+NaOH = (加热;浓溶液)
(二)硝酸盐:特性:一般易溶于水,受热易分解高温下都是强氧化剂。
受热分解规律:
注意:铵根离子和硝酸根离子的检验
(1)铵根离子的检验:碱—加热—湿润的红色石蕊试纸
(2) 硝酸根离子的检验:浓缩—铜—浓硫酸—微热
(三)磷酸盐
(1)二氢盐都溶于水;一氢盐和正盐除钾钠铵盐外均不溶于水
(2)酸式盐既能与酸又能与碱反应
制过磷酸钙 (又叫普钙) Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4 ) 2 + 2CaSO4
过磷酸钙
制重过磷酸钙(又叫重钙) Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4 ) 2
NaOH与H3PO4反应产物的判断
N=n(NaOH):n(H3PO4) 产 物
七、氧化物的计算
(一)NO2或NO2与N2(非O2)的混合气体溶于水的计算
原理 3 NO2+H2O=2HNO3+NO 差量法的应用
(二)NO与O2混合气与水反应
原理:4NO + 3O2 + 2H2O = 4HNO3 ,余气:NO或O2
规律 V(NO)/V(O2)=4:3时,恰好完全反应。
V(NO)/V(O2)>4:3时,剩余气体为NO。
V(NO)/V(O2)<4:3时,剩余气体为O2。
(三)“NO2+O2+H2O”型
原理 4 NO2+O2+2H2O=4 HNO3 余气:NO或O2
规律 V(NO2)/V(O2)=4:1时,恰好完全反应。
V(NO2)/V(O2)>4:1时,剩余气体为NO。
V(NO2)/V(O2)<4:1时,剩余气体为O2。
(四)“NO+ NO2+O2+H2O”型
4NO + 3O2 + 2H2O = 4HNO3
4 NO2+ O2+2H2O=4 HNO3
规律:O2与NO或NO2或NO、NO2的混合气体中,
若n(N):n(O)=2:5,则全被水吸收;
若n(N):n(O)>2:5,则有NO气体剩余;
若n(N):n(O)<2:5,则有O2气体。
(五)“CO2+NO+ Na2O2”型
原理:2CO2+2Na2O2 = 2 Na2CO3+ O2
2NO+ O2 = 2NO2
CO2+NO+ Na2O2= Na2CO3+NO2
规律 CO2与NO的混合气体通过足量固体Na2O2后:
(1)若V(CO2) =V(NO)时,反应后气体( NO2 )的总体积为原混合气体体积的一半
(2)若V(CO2) > V(NO)时,反应后气体( NO2 . O2)的总体积为原混合气体体积的一半
(3)若V(CO2)(六)“NO+ NO2+NaOH溶液”型
原理 NO+ NO2+2NaOH = 2Na NO2+H2O
2 NO2+2NaOH = NaNO3+NaNO2+H2O
规律 当V(NO2)≥V(NO)时,混合气能被NaOH溶液完全吸收;
当V(NO2)1 在一定温度和压强下,装有NO和NO2混合气的试管倒立于水中,充分反应后,试管内气体体积缩小为原体积的3/5,则原混合气中NO和NO2的体积比为( )。
A. 5:3 B. 2:3 C. 3:2 D. 3:5
2、将40mLNO与___mLO2混合,与水反应无气体剩余;
3、将40mLNO与20mLO2混合,与水反应后余_________ ,气体________mL;
4、将40mLNO与40mLO2混合,与水反应后余________ ,气体_________mL;
5、将40mLNO与___________mLO2混合,与水反应后余气10mL.
6.将40mL NO2和_______mLO2混合,与水反应无气体剩余。
7.将40mL NO2与15mLO2混合,与水反应后余____气体____________mL;
8.将40mL NO2与5mLO2混合,与水反应后余_____气体____________mL;
9.将60mL NO2和_______mLO2混合,与水反应后余气10mL。
10、在标准状况下,将NO2、NO、O2混合后充满容器,倒置于水中,完全溶解,无气体剩余,若产物也不扩散,则所得溶液物质的量浓度的数值范围是( )
A、011、将充有 A mLNO 和 B mL NO2气体的试管倒立于水槽中,然后通入A mLO2,若已
12 根据硝酸尾气处理的反应原理,下列气体中不可能被过量的NaOH溶液吸收的是
A. 1 mol O2和4 mol NO2 B. 1 mol NO和4 mol NO2 ( )。
C. 1 mol O2和4 mol NO D. 4 mol NO和1 mol NO2
13 将40 mL NO和NO2混合气体通入足量NaOH溶液中,完全反应后,溶液中只含有Na NO2和 NaOH,剩余气体为 5 mL,则原混合气体中NO的体积是
A、20 mL B、22.5 mL C、28 mL D、33 mL
习题课学习目标:
1. 巩固氮、磷及其化合物的性质,理解各物质间的相互转化,巩固氮的氧化物溶于水的计算方法.
2.通过习题,培养学生应用知识分析问题、解决问题的能力,对知识的比迁移能力。
3.通过对知识的综合运用,达到思维和能力的整合提升
CaCl2 8NH3
[Ag(NH3)2]+
[Cu(NH3)4]2+
CO2 180℃ 2000atm
(NH2)2CO
N2+ Cu+H2O
NO +H2O
N2+ NH4Cl
N2+ H2O
NH4HCO3
(NH4)2SO4
NH4NO3
NH4Cl
NH3 H2O
NH3
I2 、NO、 KOH
SO3、 NO
NaNO2
N2
NO2
NO
Na2SO4 NO
CH2ONO2
CHONO2
CH2ONO2
C6H5NO2
(I2)Br2 、NO
H2SO4 、NO
S、 H2O、 NO
Cu(NO3)2、 NO2
钝化
H2SO4、 H2O 、NO2
H3PO4、 NO2
CO2、 H2O 、NO2
酸的通性
H20 、NO2、 O2
HNO3
Fe3+ NO
H+
H+
H+
OH-
OH-
OH-
PO43-
H3PO4
HPO42-
H2PO4-
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
⑾
⑿
⒀
③
①
②
④
⑤
⑥
⑦
⑧
⑨
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
⑾
⑿
PAGE
7
学习目标:
1、根据氮族元素在周期表的位置及结构特点,掌握该族元素的非金属性及其重要性质的递变规律,并和相邻的氧族、卤素进行比较。掌握氮气的性质和用途。
2、根据氨分子的结构特点,掌握氨的性质、制法、用途,掌握铵盐的特性和检验方法。
3、比较并掌握氮的两种重要氧化物NO和NO2的性质。
4、掌握硝酸的重要性质和用途,工业上氨的催化氧化法制硝酸的原理,了解硝酸工业尾气的吸收。
5比较磷的两种同素异形体的物理性质,掌握磷的重要的化学性质和用途。
一、氮族元素概述
1. 写出氮族元素的元素名称和元素符号
2. 原子核外电子排布的规律
3. 依据元素周期律预测氮族元素性质走势
4 . 性质递变规律:(从上到下)
a、单质的熔沸点:
b、元素的金属性、非金属性:
c、最高价氧化物的水化物酸性
d、气态氢化物稳定性
e、主要化合价
二、单质(一)氮气
1、分子结构(写电子式):
2、物理性质:
3、化学性质:常温下比较稳定
(1)氧化性:N2+3Mg— (点燃) 生成固体是 色
N2+3H2— 条件是:
(2)还原性:N2+O2— 条件是:
4、制备 工业制法:利用的原理是:
采用的方法是:
(2) 磷(红磷、白磷)1、分子结构:分子晶体
2、物理性质:
白磷 红磷
分子结构 属于 晶体 结构复杂,属于 晶体
颜色 色 状固体 色粉未
密度(g·cm-3) 1.82 2.34
溶解性 溶于水, 溶于CS2 溶于水, 溶于CS2
毒性 毒性 毒性
着火点 ,易自燃 可燃
还原性 易被氧化,发磷光 不易被氧化
保存 少量保存在 贮存在
相互转化 条件下,白磷加热到260℃可转化为红磷,红磷加热到416℃以上(升华)可得到白磷。
3、化学性质:
P+ O2= (点燃)
P2O5 + H2O(冷)= (偏磷酸剧毒)
P2O5 + H2O(热)= (无毒)
P + Cl2= (点燃)
P + Cl2= (点燃)
三、氢化物———氨气
1、分子结构(写出电子式): 属于 分子
2、物理性质: 色、有刺 性气味、 溶于水、易 的气体(1:700)
3、化学性质:
(1)碱性
(2)还原性
(3)络合
(4)其他
写出以上转化的化学方程式:
① NH3+ H2O= =
② NH3+HCl= (产生大量白烟) ③ NH3+HNO3=
④ NH3+H2SO4= ⑤ NH3+H2O+CO2=
⑥ NH3+ O2(纯氧)= ⑦ NH3+ Cl2=
⑧ NH3+ O2= (催化剂加热)
⑨ NH3+ CuO= (加热)
10 NH3+ Ag+=
⑾ NH3+ Cu2+=
⑿ NH3+ CaCl2=
⒀ NH3+ CO2= (180℃,2000atm)
4、制备
(1)工业制备
原理(用化学方程式表示):
步骤: ; ; ; (液化冷凝器)
(2)实验室制法
原理(用化学方程式表示):
药品: (注意反应物不能用硝酸铵和氢氧化钠)
装置特点:
收集:
检验:
除杂:
讨论:氨水的成分及性质(与氯水做比较)
四、氧化物
N2O 、NO 、N2O3、 NO2(N2O4)、 N2O5 、P4O6 、P4O10
1、性质
N2O4 HNO3
写出上述转化的化学反应方程式:
1 N2+O2—
② NO2+ H2O— NO2+ O2+ H2O—
③ NO2+ NH3— (催化剂) ④ NO2+ NO+ NaOH—
⑤ NO2+ SO2— ⑥ NO2+ KI+ H2O—
⑦ ⑧ NO + O2—
⑨NO2+H2O —
2、制法:
原理(用化学方程式表示)
药品
装置
收集
尾气吸收
五、含氧酸
(—)硝酸
1、结构:
2、物理性质: 色,易 液体, 溶于水
3、化学性质:
不稳定性(光照或加热),如何保存:
酸性
强氧化性(与金、铂不反应)
与有机物反应
写出上述转化的化学反应方程式:
1、 HNO3=
2、C + HNO3(浓)=
3、P+ HNO3 (浓)=
4、S+ HNO3浓)=
5、Cu+ HNO3 (浓)= 、Cu+ HNO3(稀)=
6、 H2S+ HNO3(稀)=
7、 SO2+ H2O+ HNO3 (稀)=
8、 Fe2++ H++ NO3-=
9、 Br-+ NO3-+ H+=
10、 Na2SO3+ HNO3=
11、C6H6+ HNO3→
13、 CH2OH CH2ONO2
| |
CHOH +3HNO3→CHO NO2 +3H2O
| |
CH2OH CH2O NO2
【注意】
①浓硝酸的挥发性和不稳定性 (填是或不是)为同一性质;浓硝酸与浓硫酸的受热分解不同之处是: 是氧化还原反应。
2 过铜分别与浓、稀硝酸和浓、稀硫酸的反应,知其氧化性
铁和铝投入到冷、浓的硝酸或硫酸中, (填能或不能)发生反应。
③硝酸遇还原性物质(如Fe2+、S2-、I-、SO32-等)显 ,遇非还原性物质如CuO可显酸性,如遇FeO、Cu等,既显 又显 。
④NO3-在水溶液中的氧化性与溶液的酸碱性有关,如在 中,其氧化性较强。
4、制备
(1)工业制法
步骤及原理:氨的氧化(氧化炉)
硝酸的生成(吸收塔)
计算关系:NH3——NO——NO2——HNO3
尾气处理:NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
(2)实验室制备
原理:
药品:
装置:固液加热(曲颈甑)
收集:冷凝
(2) 磷酸
物理性质: 色晶体,易吸水, 溶于水,沸点 。
化学性质: 弱酸,非氧化性酸。
具有酸的通性。
H3PO4+NaOH =
H3PO4+2NaOH =
H3PO4+3NaOH =
磷酸的制取:Ca3(PO4)2 + H2SO4(浓)——
六、盐类化合物
(一)铵盐: 特性:可溶于水。
(1)受热易分解 NH4Cl = (Δ)
NH4HCO3 = (Δ)
(2)与碱反应 NH4Cl+NaOH = (稀溶液)
NH4Cl+NaOH = (加热;浓溶液)
(二)硝酸盐:特性:一般易溶于水,受热易分解高温下都是强氧化剂。
受热分解规律:
注意:铵根离子和硝酸根离子的检验
(1)铵根离子的检验:碱—加热—湿润的红色石蕊试纸
(2) 硝酸根离子的检验:浓缩—铜—浓硫酸—微热
(三)磷酸盐
(1)二氢盐都溶于水;一氢盐和正盐除钾钠铵盐外均不溶于水
(2)酸式盐既能与酸又能与碱反应
制过磷酸钙 (又叫普钙) Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4 ) 2 + 2CaSO4
过磷酸钙
制重过磷酸钙(又叫重钙) Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4 ) 2
NaOH与H3PO4反应产物的判断
N=n(NaOH):n(H3PO4) 产 物
七、氧化物的计算
(一)NO2或NO2与N2(非O2)的混合气体溶于水的计算
原理 3 NO2+H2O=2HNO3+NO 差量法的应用
(二)NO与O2混合气与水反应
原理:4NO + 3O2 + 2H2O = 4HNO3 ,余气:NO或O2
规律 V(NO)/V(O2)=4:3时,恰好完全反应。
V(NO)/V(O2)>4:3时,剩余气体为NO。
V(NO)/V(O2)<4:3时,剩余气体为O2。
(三)“NO2+O2+H2O”型
原理 4 NO2+O2+2H2O=4 HNO3 余气:NO或O2
规律 V(NO2)/V(O2)=4:1时,恰好完全反应。
V(NO2)/V(O2)>4:1时,剩余气体为NO。
V(NO2)/V(O2)<4:1时,剩余气体为O2。
(四)“NO+ NO2+O2+H2O”型
4NO + 3O2 + 2H2O = 4HNO3
4 NO2+ O2+2H2O=4 HNO3
规律:O2与NO或NO2或NO、NO2的混合气体中,
若n(N):n(O)=2:5,则全被水吸收;
若n(N):n(O)>2:5,则有NO气体剩余;
若n(N):n(O)<2:5,则有O2气体。
(五)“CO2+NO+ Na2O2”型
原理:2CO2+2Na2O2 = 2 Na2CO3+ O2
2NO+ O2 = 2NO2
CO2+NO+ Na2O2= Na2CO3+NO2
规律 CO2与NO的混合气体通过足量固体Na2O2后:
(1)若V(CO2) =V(NO)时,反应后气体( NO2 )的总体积为原混合气体体积的一半
(2)若V(CO2) > V(NO)时,反应后气体( NO2 . O2)的总体积为原混合气体体积的一半
(3)若V(CO2)
原理 NO+ NO2+2NaOH = 2Na NO2+H2O
2 NO2+2NaOH = NaNO3+NaNO2+H2O
规律 当V(NO2)≥V(NO)时,混合气能被NaOH溶液完全吸收;
当V(NO2)
A. 5:3 B. 2:3 C. 3:2 D. 3:5
2、将40mLNO与___mLO2混合,与水反应无气体剩余;
3、将40mLNO与20mLO2混合,与水反应后余_________ ,气体________mL;
4、将40mLNO与40mLO2混合,与水反应后余________ ,气体_________mL;
5、将40mLNO与___________mLO2混合,与水反应后余气10mL.
6.将40mL NO2和_______mLO2混合,与水反应无气体剩余。
7.将40mL NO2与15mLO2混合,与水反应后余____气体____________mL;
8.将40mL NO2与5mLO2混合,与水反应后余_____气体____________mL;
9.将60mL NO2和_______mLO2混合,与水反应后余气10mL。
10、在标准状况下,将NO2、NO、O2混合后充满容器,倒置于水中,完全溶解,无气体剩余,若产物也不扩散,则所得溶液物质的量浓度的数值范围是( )
A、0
12 根据硝酸尾气处理的反应原理,下列气体中不可能被过量的NaOH溶液吸收的是
A. 1 mol O2和4 mol NO2 B. 1 mol NO和4 mol NO2 ( )。
C. 1 mol O2和4 mol NO D. 4 mol NO和1 mol NO2
13 将40 mL NO和NO2混合气体通入足量NaOH溶液中,完全反应后,溶液中只含有Na NO2和 NaOH,剩余气体为 5 mL,则原混合气体中NO的体积是
A、20 mL B、22.5 mL C、28 mL D、33 mL
习题课学习目标:
1. 巩固氮、磷及其化合物的性质,理解各物质间的相互转化,巩固氮的氧化物溶于水的计算方法.
2.通过习题,培养学生应用知识分析问题、解决问题的能力,对知识的比迁移能力。
3.通过对知识的综合运用,达到思维和能力的整合提升
CaCl2 8NH3
[Ag(NH3)2]+
[Cu(NH3)4]2+
CO2 180℃ 2000atm
(NH2)2CO
N2+ Cu+H2O
NO +H2O
N2+ NH4Cl
N2+ H2O
NH4HCO3
(NH4)2SO4
NH4NO3
NH4Cl
NH3 H2O
NH3
I2 、NO、 KOH
SO3、 NO
NaNO2
N2
NO2
NO
Na2SO4 NO
CH2ONO2
CHONO2
CH2ONO2
C6H5NO2
(I2)Br2 、NO
H2SO4 、NO
S、 H2O、 NO
Cu(NO3)2、 NO2
钝化
H2SO4、 H2O 、NO2
H3PO4、 NO2
CO2、 H2O 、NO2
酸的通性
H20 、NO2、 O2
HNO3
Fe3+ NO
H+
H+
H+
OH-
OH-
OH-
PO43-
H3PO4
HPO42-
H2PO4-
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
⑾
⑿
⒀
③
①
②
④
⑤
⑥
⑦
⑧
⑨
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
⑾
⑿
PAGE
7
同课章节目录
