化学计算题[上学期]
图片预览




文档简介
高考化学总复习
化学计算题
一、题型特点
化学计算是从量的方面来反映物质的组成、结构、性质及其变化规律的,是历年高考化学试题的压轴题,它具有情境新颖,信息量大,化学知识丰富,复盖面广,综合性强等特点。它不但能用来考查考生的思维能力和自学能力,还用来考查考生应用各方面知识进行逻辑思维、抽象思维、推理判断和分析综合的能力。因此这类试题区分度较大,易于把考生不同的知识和能力水平区分开来,具有选拔优秀学生的功能,比其它几种题型难度大,要求高。
二、基本概念和基本理论
1、钇(Y)元素是激光和超导的重要材料,我国蕴藏着丰富的含钇矿石(YxFeBe2Si2O10),已知矿石中铁为+2价。现将 4.68g 钇矿石样品与过量NaOH共熔,反应后加适量水溶解过滤,滤渣中有Y(OH)3、Fe2O3、滤液中有Na2SiO3和Na2BeO2等,将滤液配成 1L 溶液,测其pH =13。往此溶液中加入100mL 3.3mol/L盐酸(设混合后溶液体积为二者之和),结果溶液的pH值为1。Be(OH)2类似Al(OH)3具有两性。求Y元素的相对原子质量及x值。
2、某化合物的化学式可表示为CO(NH3)xCly(x、y均为正整数)。为确定x和y的值,取两份质量均为 0.2140g 的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用AgNO3溶液滴定(生成AgCl沉淀),共消耗24.0mL 0.100mol/L的AgNO3溶液。在另一份试样中,加入过量NaOH溶液并加热,用足量盐酸吸收逸出的NH3,吸收NH3共消耗24.0mL 0.200mol/LHCl溶液。试通过计算确定该化合物的化学式。
3、为测定一种复合氧化物型的磁性粉末材料的组成,称取12.52克样品,将其全部溶于过量稀硝酸后,配成100mL溶液,取其一半,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤,烘干后得4.66克固体,在余下的50mL 溶液中加入少许KSCN溶液,显红色;如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤,洗涤,灼烧后得3.20克固体。
(1)计算磁性粉末材料中氧元素的质量百分含量。
(2)确定该材料的化学式。
4、将2.0克某纯净固体A加热到200℃,完全分解后得到两种产物。气态氧化物B和0.90克水蒸气。这两种气体混合物的总体积为1.68L(已折算成标准状况)。试通过计算推断固体A的分子式。
5、物质的量相等的两种价态相同的无水金属化物29.6g,溶于水后再蒸发结晶,可得到两种金属氯化物的六水结晶水合物51.2g 。将这些结晶水合物强热灼烧,又得到氧化物的混合物(金属价态不变)13.1g ,如果将原金属氯化物的混合物溶于水,加过量NaOH溶液,所得沉淀过滤、洗涤、干燥和高温灼烧后(假设操作过程中均无损失),称得固体物质的质量为8.0g。试计算:
(1)两种金属氯化物的物质的量各为多少摩尔?
(2)两种金属元素各是什么元素?它们的化合价为多少?
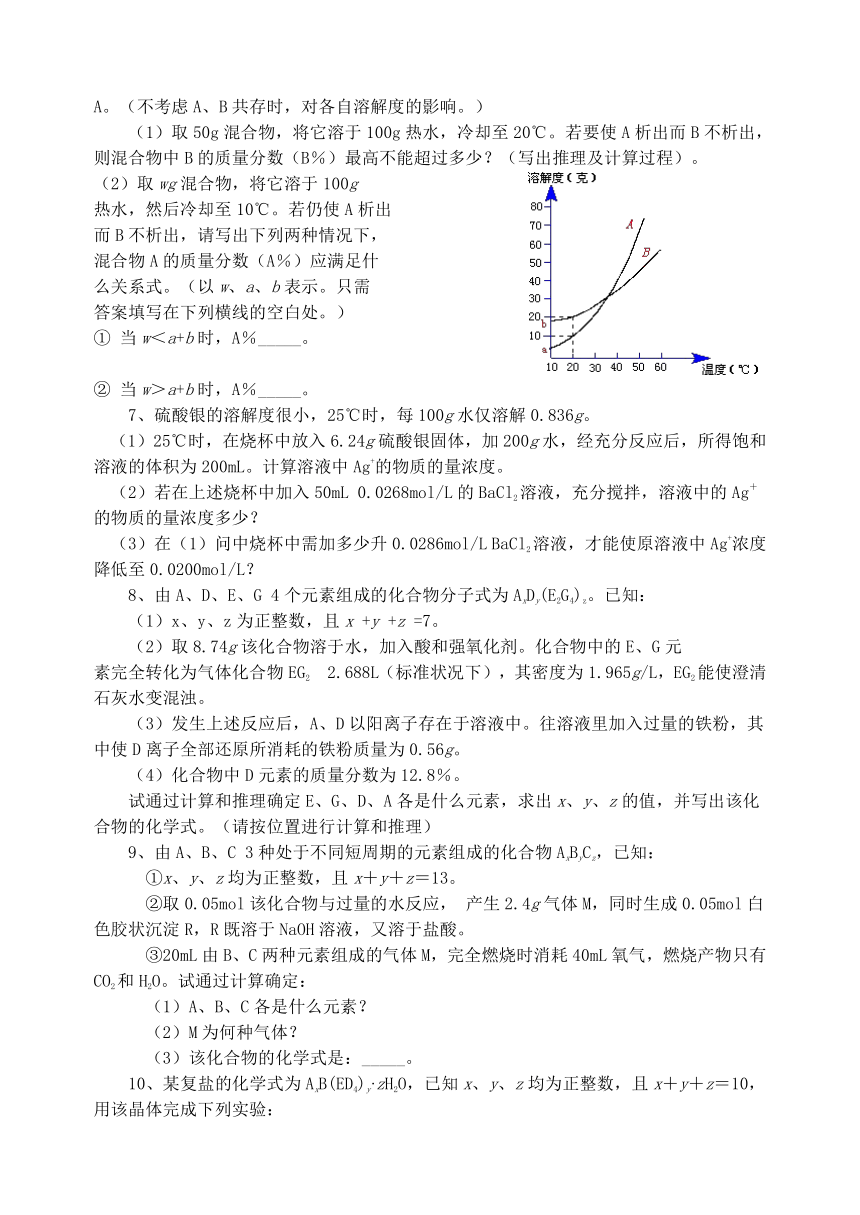
6、A、B两种化合物的溶解度曲线如下右图所示,现要用结晶法从A、B混合物中提取A。(不考虑A、B共存时,对各自溶解度的影响。)
(1)取50g混合物,将它溶于100g热水,冷却至20℃。若要使A析出而B不析出,则混合物中B的质量分数(B%)最高不能超过多少?(写出推理及计算过程)。
(2)取wg混合物,将它溶于100g
热水,然后冷却至10℃。若仍使A析出
而B不析出,请写出下列两种情况下,
混合物A的质量分数(A%)应满足什
么关系式。(以w、a、b表示。只需
答案填写在下列横线的空白处。)
① 当w<a+b时,A%_____。
② 当w>a+b时,A%_____。
7、硫酸银的溶解度很小,25℃时,每100g水仅溶解0.836g。
(1)25℃时,在烧杯中放入6.24g硫酸银固体,加200g水,经充分反应后,所得饱和溶液的体积为200mL。计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50mL 0.0268mol/L的BaCl2溶液,充分搅拌,溶液中的Ag+的物质的量浓度多少?
(3)在(1)问中烧杯中需加多少升0.0286mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200mol/L?
8、由A、D、E、G 4个元素组成的化合物分子式为AxDy(E2G4)z。已知:
(1)x、y、z为正整数,且x +y +z =7。
(2)取8.74g该化合物溶于水,加入酸和强氧化剂。化合物中的E、G元
素完全转化为气体化合物EG2 2.688L(标准状况下),其密度为1.965g/L,EG2能使澄清石灰水变混浊。
(3)发生上述反应后,A、D以阳离子存在于溶液中。往溶液里加入过量的铁粉,其中使D离子全部还原所消耗的铁粉质量为0.56g。
(4)化合物中D元素的质量分数为12.8%。
试通过计算和推理确定E、G、D、A各是什么元素,求出x、y、z的值,并写出该化合物的化学式。(请按位置进行计算和推理)
9、由A、B、C 3种处于不同短周期的元素组成的化合物AxByCz,已知:
①x、y、z均为正整数,且x+y+z=13。
②取0.05mol该化合物与过量的水反应, 产生2.4g气体M,同时生成0.05mol白色胶状沉淀R,R既溶于NaOH溶液,又溶于盐酸。
③20mL由B、C两种元素组成的气体M,完全燃烧时消耗40mL氧气,燃烧产物只有CO2和H2O。试通过计算确定:
(1)A、B、C各是什么元素?
(2)M为何种气体?
(3)该化合物的化学式是:_____。
10、某复盐的化学式为AxB(ED4)y·zH2O,已知x、y、z均为正整数,且x+y+z=10,用该晶体完成下列实验:
①称取该晶体40.20g,在坩锅中加热至质量不再改变,固体质量减少了10.8g。
②将剩余固体溶于水配成200mL溶液,20mL,向其中加入过量的Ba(OH)2溶液,ED4离子和B离子全部沉淀,经过过滤、洗涤、干燥、冷却,称得固体质量为5.24g。
③往上述固体中加入过量盐酸,固体又减少了0.58g。试确定A、B是何种元素及该晶体的化学式。
11、在化工试剂中,要除去某种杂质离子,往往采用在一定条件下使之生成某浅黄色复盐〔分子式MxAy(DE4)z(OH)12〕析出。分子式中OH-为氢氧根,而M、A、D、E代表4种未知元素。已知:
①x+y+z =12(x、y、z均为正整数)。
②取9.7克该化合物溶于含稀硝酸的水中,滴加硝酸钡溶液,使D、E元素完全转化为白色沉淀,过滤干燥后称重为9.32g。
③滤液中A、M以阳离子形式存在,用胶头滴管取滤液2-3滴在白色点滴板(或玻璃片上),再加1-2滴KSCN溶液, 溶液呈红色。
④往滤液中通入足量的H2S气体,使A离子全部还原后,产生黄色沉淀物,干燥后称重为0.96g。
⑤化合物中A元素质量分数为34.64%。试通过计算推理判断 D、E、A、M 各是什么元素?求出x、y、z的数值。
12、某化合物化学式为AmBnCp·qH2O,其中A、B、C代表某种原子或原子团,在水溶液中A、B、C皆为离子。 ①取此化合物55.6g溶于水,通入足量H2S气体,与A离子完全作用生成黑色沉淀,过滤后,在滤液中加入过量的NaOH溶液并加热,得溶液甲,此时B离子转化为一种有刺激味且使石蕊变蓝的气体。
②将气体导出,用1L 0.6mol/L盐酸溶液完全吸收,再用0.4mol/L的NaOH溶液500mL中和过量的酸。③在步骤①中所得甲溶液中加硝酸使之呈酸性,再加过量AgNO3溶液,C转化为白色沉淀,过滤、干燥、称重得114.8g。④m∶n∶p为简单整数比,且m∶n =1∶2。⑤用适当方法除去化合物中的全部结晶水后;其质量减少13%。试回答:
(1)B的离子符号为_____,C是_____。
(2)通过计算确定m、n、p、q的值,并确定A和该化合物的化学式。
13、在20℃时将12.1M(NO3)x·3H2O晶体溶于44.3g水中,或在相同温度下将4.7gM(NO3)x无水盐溶于23.5g水中,均可制得该盐的饱和溶液。上述两部分溶液混合,再加水稀释为0.1mol/L,用惰性电极进行电解,当电极上通过0.15mol电子时,溶液中的Mx+离子恰好全部成单质析出(设无氢气生成)。
试计算:
(1)20℃时M(NO3)x的溶解度。
(2)M(NO3)x·3H2O的摩尔质量及x值。
(3)M的相对原子质量。
14、1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学
家。C60分子是形如球状的多面体(如下图所示),该结构的建立基于
以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
顶点数+面数-棱边数=2
据上所述,可推知C60分子有12个5边形和20个6边形,C60分子所含的双键数为30。
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是_____理由是_____。
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)_____,并简述其理由:_____。
(3)通过计算,确定C60分子所含单键数。
(4)C70分子也制得,它的分子结构模型可以与C60同样考虑而推知。通过计算确定C70分子中5边形和6边形的数目。
15、t℃时,H2(气)+I2(气)2HI(气)的可逆反应达平衡时[H2]为0.5mol/L,[I2]为0.1mol/L,[HI]为1.6mol/L。求HI、H2、I2的起始浓度的取值范围。
16、在一个容积不变的反应容器中,要求通过调节体系的温度使下列反应达到平衡时,保持容器内气体总物质的量为12mol。
A(气)+2B(气)2C(气)
现向反应器中加入 6.5molA、xmolB、2.0molC。
(1)若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应为_____热反应。
(2)欲使起始反应维持向逆反应方向移动。则x的取值范围为____。
(3)在一定温度下的上述平衡系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中气体的总量不要求保持12mol),按下式发生反应:
D(气)+E(气)2F(气)
当反应达到平衡时,D在平衡混合气体中的体积为p%。若向容器投入m mol D、n mol F和一定量的E,在这三种物质新的平衡体系中D的体积分数仍为p%,则所投入E的物质的量是_____mol(假设A、B、C和D、E、F之间不发生反应)。
17、在一定温度下,对于难溶电解质AmBn,在水中可建立如下平衡:
AmBn(固)mAn+nBm-
在一定温度下,当达到溶解平衡时,[An+]m·[Bm-]n为一常数,用Ksp表示,称为该温度下该难溶电解质的溶度积。
在一定温度下,当[An+]m·[Bm-]n=Ksp时,溶液呈现饱和状态,沉淀量既不增加,也不减少;当[An+]m·[Bm-]n>Ksp时,溶液呈现过饱和状态,将析出沉淀;当[An+]m·[Bm-]n<Ksp时,溶液呈不饱和状态,沉淀将溶解。
试根据上述原理,计算:
(1)已知在常温下,FeS的Ksp=6.25×10-18,求此温度下FeS的溶解度(g/100g 水)(设饱和溶液的密度为1g/mL)
(2)又知在常温下H2S饱和溶液,[H+]与[S2-]间存在着以下关系:[H+]2·[S2-]=1.0×10-22。在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中[Fe2+]达到1mol/L,应调节溶液的pH为多少?
18、如图所示,A容器里盛的是10%氢氧化钠溶液200g,B溶液器里的是1mol/L硝酸银溶液600mL,a、b、c、d是4个用铂做的电极。
(1)写出a、b、c、d 4个电极上的反应。
(2)若a电极收集到2.8L(标准状况)气体,
求此时A容器中氢氧化钠溶液的质量分数和d极上析
出的物质的质量?若B中溶液的体积不变,硝酸银
溶液的物质的量浓度的多少?
19、有一硝酸盐晶体 M(NO3)x·nH2O。已知M在晶体中的质量分数为26.45%。0.1mol此晶体配成200mL溶液,现将此溶液放置于电解池中用碳棒作电极进行电解,测得有0.2moL电子通过电极,溶液中金属阳离子全部还原析出,且阴极的质量增加6.4g。此时若电解液的体积不变,密度为1.032g/cm3,求
(1)M的原子量;
(2)晶体的化学式;
(3)反应后溶液的物质的量浓度和质量分数;
(4)电解后溶液的pH值。
20、双指示剂法可用来测定NaOH、NaHCO3、Na2CO3中的一种或两种物质组成的混合物的含量。具体做法是:先向待测液中加入酚酞,用标准盐酸滴定,当NaOH或Na2CO3被转化为NaCl或NaHCO3时,酚酞由红色褪为无色,消耗V1mL盐酸;然后滴加甲基橙,继续用标准盐酸滴定,当NaHCO3转化为NaCl时,溶液由黄色变为橙色,消耗V2mL盐酸。
(1)今用上法进行下表五种试样的测试,请根据盐酸的用量(V1、V2)确定试样②~⑤的成分。
试样 ① ② ③ ④ ⑤
标准盐
酸用量 V1>V2
且V2=0 V1<V2
且V1=0 V1=V2
且V2>0 V1>V2>0 V2>V1>0
试样的成分
(2)若称取1.200克含杂质的试样(杂质不与HCl反应),配制成100.0mL水溶液,取出 20.00mL,用0.1000mol/L标准盐酸滴定,测得V1=35.00mL,V2=5.00mL。求试样的成分及其百分含量。
附答案
1、89,x=2
2、化学式为Co(NH3)6Cl3
3、(1)钡的质量为5.48克,铁为4.48克,氧为20.45%
(2)原子个数比为Ba∶Fe∶O=1∶2∶4,化学式为BaFe2O4(或BaO·Fe2O3)
4、化学式为N2O
5、(1)各为0.1mol
(2)Fe、Al +3价,+3价
6、(1)B%≤40%(或B%<40%)
(2)①当w<a+b时,A%>a / w;
②当w>a+b时,A≥(w-b) / w 或 A%>(w-b) / w
7、(1)[Ag+]=0.0536(mol/L)
(2)[Ag+]=0.0536mol/L
(3)V=0.489(L)
8、E为C,G为O,D为Fe,A为K; x=3,y=1,z=3; K3Fe(C2O4)3。
9、(1)根据性质推知:A为银,B、C各为氢或碳;化合物为AlxCyHz
(2)CH4 (3)AlC3H9 或Al(CH3)3。
10、A为钾,B为镁。
11、D:S,E:O,A:Fe,M:Na
化合物化学式为Na2Fe6(SO4)4(OH)12 或 NaFe3(SO4)2(OH)6。
12、(1)NH4+ Cl-
(2)m=1 n=2 p=4 q=4;A为Cu;Cu(NH4)2Cl2·4H2O。
13、(1)S=4.7/23.5×100=20(g) 242(g/mol)
(2)x=2
(3)64。
14、(1)金刚石 金刚石属原子晶体,而固体C60不是,故金刚石熔点极高。
(2)可能。因为C60分子含30个双键,与极活泼的F发生加成反应,即可生成C60F60
(3)60
(4)5边形数为12,6边形数为25。
15、[HI]起始时可取0~1.8mol/L的任何值;[H2]起始时可取0.4~1.3mol/L的任何值;[I2]可取0~0.9mol/L的任何值,或与[HI]、[H2]相对应的任何值;[H2]也可取与[HI]相对应的任何值。
16、(1)放热 (2)2.5<x<3.5 (3)2m+n/2。
17、(1)在溶液中,[Fe2+]=[S2-] [Fe2+]=[S2-]=
==2.5×10-9(mol/L)
FeS溶解度:2.5×10-9×88×100/1000=2.2×10-8(g)
(2)[Fe2+][S2-]=Kap=6.25×10-18(mol/L)
[H+]2[S2-]=1.0×10-22
[H+]==4×10-3(mol/L)
pH=-lg[H+]=-1g(4×10-3)=3-0.6=2.4
18、(1)a电极(+),4OH--4e2H2O+O2↑,
b电极(-),2H++2eH2↑,
c电极(+),2H2O-4e4H++O2↑,
d电极(-),Ag++eAg
(2)10.23%,54g,0.17 mol/L。
19、(1)64
(2)Cu(NO3)2·3H2O
(3)1mol/L,6.1%
(4)0。
20、(1)①NaOH ②NaHCO3 ③Na2CO3 ④NaOH和Na2CO3
⑤NaHCO3和Na2CO3
(2)NaOH%=50.00%;Na2CO3=22.09%
三、元素化合物
1、将一定量Cl2通入250gKBr溶液中,然后将此溶液蒸干,并将残渣灼烧,冷却后称重为40g,经分析得知其中含有质量分数为25%的化合态溴。
(1)如果Cl2密度为3.17g/L,则通过Cl2的体积是多少升?
(2)最初KBr溶液中溶质的质量分数是多少?
2、某烧瓶中盛有50mL浓度为12mol/L的浓盐酸,向此烧瓶中加入ag(a<13)MnO2共热,反应停止后,将烧瓶内的液体冷却并蒸干,结果得到bg固体,则bg固体中氯元素的质量可能是多少?
3、ag氯气与bg氢气混合点燃爆炸,将生成的气体通入足量硝酸银溶液。
(1)a、b满足什么关系时氯气过量?
(2)当氢气过量时生成的沉淀质量为多少克?
4、氧气和氯气混合气500mL,氢气在其中充分燃烧,用水吸收生成物得到250mL溶液,从中取出25mL,恰好能与20mL 0.125mol/LNaOH溶液反应,则与混合气反应的氢气的体积为_____mL。(气体体积均在标准状况下测得)
5、将一定量的氯气通入140mL氢硫酸溶液中,Cl2和H2S恰好完全反应,有淡黄色沉淀生成,过滤后溶液的pH=1。取5mL滤液与足量AgNO3溶液的反应得amolAgCl沉淀,另取5mL滤液与足量BaCl2溶液反应得bmolBaSO4沉淀,a∶b=12∶1。
(1)写出Cl2与H2S反应的化学方程式(要求写一个总反应) ①_____
(2)参加反应的Cl2在标准状况下的体积为②_____,生成淡黄色沉淀的质量为③_____,原氢硫酸溶液的物质的量浓度为④_____。(假设滤液的体积仍为140mL)
6、不同卤素原子之间可以互相共用电子对形成一系列化合物,这类化合物叫卤素互化物。现将4.66gBrCln溶于水,再通入过量SO2,使其发生反应:
BrCln+(n+1)H2O+ SO2=HBr+nHCl+ H2SO4。
然后将所得溶液调至中性,再加入过量的硝酸银溶液处理,可生成15.46g沉淀。试确定BrCln中的n值。
7、用KClO3加热制取O2中常含有少量的Cl2和O3。为测定Cl2和O3的含量。将KClO3分解得气体V1升通过足量KI溶液。干燥后得气体V2升(均为标准状态)。再用Na2S2O3溶液滴定KI溶液中的I2(反应式为:O3+2KI+H2O==O2+I2+2KOH; I2+2Na2S2O3==2NaI+Na2S4O6)。若V1=1.00L,V2=0.98L,滴定中消耗0.100mol/LNa2S2O30.0267L,试计算气体中Cl2、O3的体积分数。
8、往400mL0.5mol/LNaOH溶液中通入一定量的H2S气体,然后低温蒸发溶液,得白色固体A7.92g。
(1)推测此白色固体A所有可能的组成,并写出其化学式。
(2)通过计算确定A的组成及其质量。
9、写出H2S燃烧反应的化学方程式。1.0LH2S气体和aL空气混合后点燃,若反应前后气体的温度和压强都相同(20℃、101.3千帕),试讨论当a的取值范围不同时,燃烧后气体的总体积V(用含a的表达式表示。假定空气中氮气和氧气的体积比为4:1,其它成分可忽略不计)。
10、将Na2SO3与Na2S的混合物若干克配制成50g溶液,加入50g一定浓度足量的盐酸,放出气体0.448L(标准状况),混合液为96.9g,求混合物中Na2SO3与Na2S的物质的量各为多少?
11、在500mL0.2mol/LNaOH溶液中缓缓通入一定量SO2气体(标准状况),充分反应后,在减压低温条件下蒸发溶液,得到8.76g不含结晶水的白色固体A。
(1)推测A所有可能的组成,并将其化学式填入下表(有几种组成情况就填几格,不必填满)。
编号
A的可能
组成的
化学式
(2)通过计算确定A的组成物质及其质量。
12、在标准状况下,将100mLH2S、O2的混合气体点燃后恢复到原状况,发现混合气体中O2所占的体积V(O2)的变化,反应后所得气体的总体积V总也不同。其关系如图5-6所示,回答下列问题:
(1)写出坐标点B、C两处反应的化学方程式。 B处_____; C处_____。
(2)从图像分析可知:①当V总>40mL时,气体成分为_____;②当V总=40mL时,气体成分为_____;③当V总<40mL时,气体成分为_____。
(3)当V总=25mL时,求原混合气体中H2S和O2各多少毫升?
13、工业上用硫铁矿石燃烧制SO2时,假如硫的损失率为2%,SO2接触氧化制SO3时,SO2的转化率为90%,SO3吸水得硫酸,硫酸的产率为96%,若以100t纯度为75%的硫铁矿石为原料,可得98%的浓H2SO4多少吨?
14、某化合物的化学式为x(NH4)2SO4·FeSO4·yH2O,取这种物质0.01mol(质量为3.92g),溶解于蒸馏水产定容100mL。吸10mL溶液,用0.1mol/LBaCl2溶液滴定,使SO42-刚好完全沉淀时,耗去BaCl2 溶液20mL。求:
(1)该复盐中x、y的值是多少?
(2)另取10mL该复盐溶液,欲使其中Fe2+全部沉淀,而NH4+全部转化为NH3逸出,至少需要消耗0.4mol/L的苛性钠溶液多少mL?
15、加热硝酸银晶体使其完全分解,反应方程式为:
2AgNO32Ag+2NO2↑+2O2↑
生成的气体用排水法收集得A;加热后的残渣中加入浓硝酸完全反应后,生成的气体又用排水法收集得气体B;再把A、B两气体混合,求此混合气体的平均式量。
16、磷和氯气反应,可以生成PClx和PCly,把0.31g磷与氯气反应,由于氯气的量不足,生成PClx和PCly的混合物,其中PClx和PCly的物质的量之比为2:3。若把这些混合物全部溶于水,加入足量的AgNO3溶液,生成6.027gAgCl沉淀,求x和y的值。
17、实验室欲配制5L由NaH2PO4和Na2HPO4组成的混合液,该溶液中要求每升含0.1mol磷原子且NaH2PO4与Na2HPO4物质的量之比为1:4,求:
(1)需浓度为5mol/L的H3PO4多少毫升?
(2)称取NaOH固体多少克?
18、使一定量的磷化氢和氢气的混合气体,依次通过两支加热的硬质玻璃管,第一支玻璃管中装有铜屑,第二支玻璃管中装有氧化铜。第一支玻璃管中由于发生如下反应:2PH3+3CuCu3P2(固)+3H2,玻璃管质量增加4.96g,第二支玻璃管的质量发生反应后减少了5.76g。
(1)计算原混合气体中,磷化氢和氢气的体积比。
(2)在标准状况下,原混合气体的密度是多少?
19、在标准状况下,总体积为10L的NO2、NH3、N2组成的混合气体,通过过量的稀硝酸,结果气体体积缩小为3.28L。溶液增重12.5g。试求:
(1)混合气体中各成分体积分别是多少?
(2)计算混合气体在标准状况下的密度是多少?
20、NH3和Cl2可迅速地进行下列反应:2NH3+3Cl2==N2+6HCl 下图为反应后气体总体积VL随该混合气体中Cl2的体积含量(x%)而变化的图像(每次实验取气体的总量均为18L) 试计算:
(1)当反应结束处于B点时,原混合气体中Cl2的体积分数是多少?
(2)当反应结束处于A点时,所得气体的总体积是多少升?
(3)若反应结束时,气体总体积为6L,则原混合气体Cl2的体积百分含量是多少?(计算结果均保留3位有效数字)
21、在mmLNO和NO2的混合气体中,NO的体积分数为x。现将混合气体与氧气以2:1的体积比再次混合于试管中,然后使其倒立水中,与水充分反应。
(1)若反应后,试管内无剩余气体,则x的值应为多少?
(2)若反应结束后试管内尚有剩余气体,请指出剩余的为何种气体,并用原混合气体中NO的体积分数x表示剩余气体的体积(VmL)。
(3)画出V随x变化的函数图像,并在坐标轴上标出计算所得的有关数据。
22、将amolCO2通入含bmolCa(OH)2的澄清石灰水中,根据a与b的关系讨论生成沉淀的物质的量。
23、通常情况下,CO和O2混合气体mL用火花引燃,体积变为nL(反应前后条件相同)
(1)试确定混合气体中CO和O2的体积(用V(CO)、V(O2))表示。
(2)当反应后的气体密度在相同条件下为H2密度的15倍时,试确定气体的成分和体积。
24、将一小块焦炭和mgO2同时放入装有压力表的密闭容器中,压强为P0,当充分反应后恢复到原温度,压强为P1。
(1)填写下表:
P1与P0的关系 焦炭质量W的取值 发生反应的化学方程式
① P1=P0 w1≤Vg
② P1=2P0 w2≥Vg
③ 2P0>P1>P0 w3=Vg
(2)会不会出现P1>2P0的情况?为什么?
(3)当焦炭质量取mg/2时,P1与P0的的关系式是_____。
25、取Na2CO3和NaHCO3混合物9.5g,先配成稀溶液,然后向该溶液中加入9.6g碱石灰,充分反应后,使Ca2+、HCO3-、CO32-均转为沉淀。再将反应器内水分蒸干,可得20g白色固体。
(1)求原混合物中Na2CO3和NaHCO3各多少克?
(2)求碱石灰中CaO和NaOH各多少克?
26、将一定体积的CO2通入V升NaOH溶液中,恰好完全反应。在反应后溶液中加入足量的石灰水,得A克沉淀。
(1)能否用以上数据确定CO2的体积(标准状况)?如果能确定,请列式表示;如果不能,还需做什么实验,运用实验测得的数据列式表示。
(2)能否确定NaOH溶液的物质的量浓度?如果能确定,请列式表示;如果不能,还需做什么简单的实验,运用实验测得的数据列式表示。
27、取金属钠和钙各一小块,投入足量水中,反应完毕后,共产生H21.568L(标况),再取Na2CO3和NaHCO3的混合物3.8g,溶于适量水中。将以上两溶液混合,恰好使Ca2+、CO32-、HCO3-全部沉淀,反应完毕后,将溶液蒸干得8.8g白色固体,再将这些白色固体洗涤、干燥,剩下白色不溶物4g。求:
(1)钠和钙的质量;
(2)混合物中Na2CO3和NaHCO3的物质的量之比。
28、将粉末状碳酸氢钠和碳酸钠的混合物若干克加热至完全反应,使生成的气体通入20℃、270g饱和石灰水中,完全反应后生成白色沉淀0.4g。向加热后的残留物中加入足量盐酸生成气体0.672L(标准状况)。求原混合物中NaHCO3和Na2CO3的可能的物质的量之比(20℃时Ca(OH)2的溶解度为0.165g)。
29、有30mL可能由一氧化碳、二氧化碳和氧气组成的混合气体,通过足量的过氧化钠充分反应后,气体体积变为25mL。引燃这25mL气体,待恢复到原温度,气体体积变成了20mL。试讨论原混合气体可能由哪些气体组成,各气体体积分别是多少?
30、在一密闭容器中,事先放入1.56gNa2O2,然后通入氧气,再通入C2H6,用电火花引爆,直至反应完全为止,容器内压强近似为零。求:
(1)通入的气体O2和C2H6应有怎样的体积比(相同条件下)?
(2)通入氧气的量不能超过多少克?
31、等量(等质量或等物质的量)的镁、钠和铝,与等量的盐酸反应,产生的H2的量可出现下列四种情况:①Na>Mg=Al. ②Na=Mg=Al. ③Mg=Al>Na④Al>Mg>Na,若盐酸中所含HCl均为1mol时,将满足上述四种情况所需金属的量填入下表:
等量的Na、Mg、Al ① ② ③ ④
物质的量 x(mol)
质量 y(g)
32、将aLCO和CO2的混合气体通过足量的过氧化钠(假设反应完全),收集所得气体并引爆,再将引爆后得到的气体通过足量的浓碱溶液,经干燥收集到气体bL。求原混合气体中CO2和CO的体积(气体体积均在同温、同压下测得)。
33、将一定量的CO2气体通入500mLNaOH溶液中,完全反应后将溶液低温蒸发,得到不含结晶水的固体A。取三份质量不同的该固体分别与50mL相同浓度的盐酸反应,得到气体的体积与固体A的质量关系如下表所示:
组别 1 2 3
盐酸的体积/mL 50 50 50
固体A的质量/g 3.80 6.20 7.20
气体体积/mL 896 1344 1344
(注:气体体积在标准状况下测得)
(1)上表中第几组数据表示所加盐酸有剩余?简述理由。
(2)请经过计算,讨论判断固体A含什么物质?各成分的质量分数各是多少?
34、化学上以12C作为确定原子量的标准。若把12C的原子量定为24,并规定把24g12C所含碳原子数定为阿伏加德罗常数,试用上述新的定义计算下题: 使0.2mol(新定义)金属钠跟过量的水反应。 求:
(1)生成多少L氢气(标准状况)?
(2)反应后溶液(设反应后溶液为100g)中溶质的质量分数?
(3)反应后溶液(设反应后溶液为100mL)的pH值?
35、向200mL稀硫酸中投入一定量的铝,同时加入适量的Na2SO3,收集到17.92L混合气体(标准状况),析出白色沉淀物经分离,沉淀用坩埚加强热得5.1g白色粉末。求:
(1)混合气体各成分的体积比。
(2)混合气体的平均式量。
(3)硫酸的物质的量浓度。
36、将过氧化钠溶于足量水,完全反应后再加入铝粉。反应后溶液中无固体残留,先后共收集到气体1.008L(标准状况)。这些气体置于密闭容器中用电火花引爆恰好完全反应。
(1)写出溶液中反应的化学方程式。
(2)求加入过氧化钠的质量和铝粉的质量。
(3)上述反应后的溶液中需加入1mol/L的盐酸多少毫升理论上才能析出最多的沉淀物?
37、向某MgSO4和Al2(SO4)3各0.5mol的混合溶液中逐滴加入氢氧化钠溶液直至过量。在如下图中用图像表示这一实验的变化过程(纵坐标为生成沉淀的量,横坐标为加入氢氧化钠溶液的量)。
38、向含0.02molAl3+的明矾溶液中,逐滴加入0.1mol/L的Ba(OH)2溶液的体积x(mL)的关系如下图所示。则V1=①______mL,V2=②______mL,m1=③_____g,m2=④_____g。
39、将NaOH、MgCl2、AlCl33种固体混合物放入足量水中,充分反应后得悬浊液。向该悬浊液中逐滴加入5mol/L盐酸,沉淀的物质的量与所加盐酸体积的关系如图所示。则原混合物中含NaOH①_________mol、MgCl2②_________mol、AlCl3③_________mol、D点为④_________mL。
40、某溶液可能含有Fe2+、Mg2+、Cu2+、、Al3+中的数种,当向其中加入一种淡黄色固体并加热时,有刺激性气味的气体放出并生成白色沉淀,加入淡黄色固体的物质的量(横坐标)与生成气体,沉淀(纵坐标)的物质的量之间关系如下图所示。则加入的淡黄色的固体是①________,溶液中含有的离子是②________,各种离子之间的物质的量之比为③________。
41、有一种医用制酸剂,由氢氧化铝、碳酸氢钠和碳酸钙混合而成。现称取这种制酸剂5g,溶解于200mL1mol/L的盐酸中,放出二氧化碳784mL(标准状况)。把二氧化碳完全驱出溶液后,再加入1.2mol/L的氨水150mL(溶液呈碱性),得到氢氧化铝沉淀,过滤并洗涤沉淀,洗液和滤液合并,用0.75mol/L稀盐酸滴定,共用去40mL盐酸恰好中和,问制酸剂三种成分的质量分数是多少?
42、加热硬质玻璃管中的CuO与Fe2O3的混合物,并通过足量CO使之充分反应,将反应后的气体通过盛NaOH溶液的洗气瓶充分吸收。碱液质量增加24.2g。另取一份混合物(质量与硬质玻璃管中的相等),用足量盐酸溶解,再向溶液中加ag(足量)铁粉,使之充分反应。
(1)当a=50g时,同时生成气体8.96L(标准状况)。反应完全后,过滤混合溶液,洗涤、干燥,得沉淀质量比碱液增加的质量少0.20g。求原混合物中CuO与Fe2O3的物质的量之比。
(2)若向滤液中加入一定量NaOH溶液,生成物Fe(OH)3和Fe(OH)2物质的量之比为2:3时,求a值。
43、将铜制印刷线路板浸入120mL氯化铁溶液中,一定时间后取出,发现线路板质量减轻了9.6g。然后向溶液中加入8.4g铁粉,经充分的反应,溶液中还存在4.8g不溶性物质。问溶液中存在哪种金属离子,并求出其离子浓度(设溶液体积不变,且不考虑金属离子水解)。
44、现有FeCl2和CuCl2混合溶液400mL,经测定其中Cl-的浓度为amol/L。向其中投入过量锌粉bg,充分反应后过滤,所得固体残渣经洗涤干燥后,称重为cg。
(1)求混合溶液中的Fe2+、Cu2+的浓度各是多少?
(2)b的取值范围。
(3)c的数值越大,说明混合液中CuCl2的含量_____;c的最大值(用a、b表示)应为_____。
45、今有Fe、Fe2O3、CuO 3种粉末组成的混合物,取一定量跟2mol/L的H2SO4110mL完全反应后得H2896mL(标准状况)。将上述混合物过滤,滤渣经干燥,冷却后称量为1.28g;滤液中的金属离子均为Fe2+,将滤液稀释至200mL,从中取出20mL,向其中加入0.4mol/L的NaOH溶液,边加边振荡,当加至20mol时溶液开始出现沉淀。求
(1)原混合物中CuO的质量。
(2)原混合物中Fe2O3的质量。
(3)稀释的200mL滤液中Fe2+的物质的量浓度。
附答案
1、(1)3.78L (2)22%
2、(1)若a值较小,为(71 / 126)bg (2)若a值较大,71 / (39(b-a))g。
3、(1)a<20 / 71时 (2)287 / 71bg
4、720
5、(1)①3H2S+6Cl2+4H2O==2S↓+12HCl+H2SO4
(2)②134.4mL,③64mg,④0.021mol/L
6、n=3
7、含Cl2为2%;含O3为1%
8、(1)①Na2S,NaOH, ②Na2S, ③Na2S,NaHS, ④NaHS
(2)A的组成为:Na2S 3.12g NaOH 4.8g 或 Na2S 7.53g NaHS 0.39g
9、2H2S+O22S+2H2O;
2H2S+3O22SO2+2H2O
若a≤2.5L,则V=1+a-3a/5=1+2a / 5L,
若a≥2.5L,则V=1+a-1.5=(a-0.5)L。
10、若放出SO2,Na2S为0.038mol,Na2SO3为0.039mol;
若放出H2S,Na2S为0.07mol,Na2SO3为0.025mol。
11、(1)
① ② ③ ④
NaOH
Na2SO3 Na2SO3 Na2SO3
NaHSO3 NaHSO3
(2)A是由2.52gNa2SO3与6.24gNaHSO3组成的混合物。
12、(1)略
(2)①H2S或SO2,②H2S或SO2,③H2S或SO2
(3)75mL、25mL、或50mL、50mL。
13、105.84吨。
14、(1)x=1,y=6 (2)10mL。
15、43.2。
16、x=3 y=5
17、(1)100mL (2)36g。
18、(1)4∶3 (2)0.91g/L。
19、(1)VNO2=6.72L,VNH3=2.24L,VN2=1.04L
(2)1.68g/L。
20、(1)60.0% (2)1.64L (3)20.0%或33.3%
21、(1)设m mL气体混合物的平均化学工为NOa,则2NOa+O2+H2O=2HNO3,根据氧原子守恒:2a+2+1=2×3
a=1.5
1 0.5 1.5 ∴x=0.5 2 0.5
(2)0 0.5≤x<1 V=m(2x-1)/3(mL),剩余气体为NO
22、CO2与Ca(OH)2的反应方程式为:
Ca(OH)2+CO2==CaCO3↓+H2O ①
CaCO3+H2O+CO2==Ca(HCO3)2 ②
②或为:Ca(OH)2+2CO2==Ca(HCO3)2 ③
(1)当a≤b时,生成沉淀a mol。
(2)当b (3)当a≥2b时,无沉淀生成。
23、(1)当VCO/VCO2≥2,VO2=m-n(L),VCO=nL;
当VCO/VCO2<2,VO2=2n-m(L),VCO=2(m-n)L;
(2)生成物为CO和CO2,VCO=7n/8,VCO2=1/8n。
24、(1)①3m/8 C+O2=CO2
②3m/4 2C+O2=2CO (或C+CO2=2CO)
③3m/8×P1/P0 C+O2=CO2和2C+O2=2CO
(2)不会;因为1体积O2完全反应后,最多生成2体积的气体(CO)
(3)P1=4 P/ 3
25、(1)Na2CO3为5.3g,NaHCO3为4.2g
(2)CaO为5.6g,NaOH为4.0g。
26、(1)能。因为CO2~Na2CO3~CaCO3,CO2~NaHCO3~CaCO3,
nCO2=nCaCO3=A/100mol; VCO2=A/100×22.4L
(2)不能。另取VLNaOH溶液,仍通入22.4A/100LCO2(标况), 反应完全后,加入足量的CaCl2溶液,得沉淀Bg。
讨论:①若B=A,则[NaOH]=A / (50V) (mol·L-1);
②若B=0,则[NaOH]=A / (100V)(mol·L-1);
③若B<A,则[NaOH]=(A+B) / (100V) (mol·L-1)。
27、(1)Na的质量为1.38g,Ca的质量为1.6g
(2)nNa2CO3∶nNaHCO3=0.02∶(0.04-0.02)=1∶1
28、nNaHCO3/nNa2CO3为4 / 13 或 8 / 11。
29、①CO20mL,CO210mL, 或 ②CO10mL,CO210mL,O210mL。
30、(1)2.5≥VO2/VC2H6≥1 (2)0.8g。
31、
x>1 x=1 1 / 2<x<1 0<x<1/2
y>23 y=23 12<y<23 0<y<12
32、若CO2过量,原混合气中CO为(a-2b)L / 2,CO2为(a+2b)L / 2;
若CO过量,原混合气中CO为(a+b)L / 2,CO2为(a-b)L / 2。
33、(1)第一组;1~3各组所用盐酸量相同,而第1组生成的气体比
2、3组少,所以第1组盐酸过量
(2)A中含有Na2CO3,NaHCO3各0.02mol,wNa2CO3=55.8%,
wNaHCO3=44.2%。
34、(1)4.48L (2)16% (3)14.9%
35、(1)VH2∶VSO2=3∶13 (2)52.38 (3)3.25mol/L。
36、(1)2Na2O2+2H2O==4NaOH+O2↑,
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
(2)Na2O2 2.34g,Al 0.54g
(3)60 mL
37、
38、①300 ②400 ③8.55g ④9.32g。
39、①0.65 ②0.1 ③0.1 ④130。
40、①Na2O2 ②NH4+、Mg2+、Al3+ ③3∶1∶1。
41、Al(OH)3=36.4%, NaHCO3=33.6%, CaCO3=30%。
42、(1)5∶2 (2)2.8
43、溶液中存在Cu2+和Fe2+,[Cu2+]=0.625mol/L,Fe2+=5mol/L。
44、(1)[Fe2+]=(56-5c-a) / 16 (mol/L)
[Cu2+]=(9a-5b+5c) / 16 (mol/L)
(2)b>13a
(3)越大,趋近 b-0.2a。
45、(1)wCuO=1.6g (2)6.4g (3)0.9mol/L
四、有机化合物
1、由一种气态单烯烃A和一种气态烷烃B组成的混合气体,对H2的相对密度为12。将1体积该混合气体与4体积氧气混合,于密闭容器中用电火花引燃,使两种烃都充分氧化。如果反应前后温度均为150℃,测得容器内的压强由反应前的101kPa增加至燃烧后的105.04kPa,求A、B各是什么烃?其体积分数各是多少。
2、在温度为150℃条件下,向密闭容器中充入1mol丙烯和甲烷的混合气体,再充入适量的氧气,完全燃烧后再恢复到150℃,欲使丙烯和甲烷的混合气体对氢气的密度≥15.8,且反应后气体分子增加的总的物质的量≥0.4mol,问丙烯和甲烷的物质的量之比应满足什么条件?
3、在常压、150℃时,某气态烃与过量氧气的混合气体aL,点燃后并恢复至原来的条件,体积仍为aL;然后将燃烧产物通过浓硫酸,体积减少bL;再通过NaOH,体积又减少bL,最后剩有少量尾气。求该烃的分子式。
4、将丁烷在催化剂存在时进行裂解,设丁烷裂解后生成分子量更小的烷和烯。将裂化后的气体通过足量的溴水完全反应后,再将剩余气体冷却,在标况下测得剩余气体的密度是1.125g/L,求丁烷裂化后生成的混合物的成分的体积分数。
5、有A、B、两份混合气体,A是烷烃R足量氧气的混合气体,B是烷烃R与炔烃Q及足量氧气的混合气体。在标准状况下,各取A、B2.24L引燃。A充分燃烧后气体总体积仍为2.24L;B充分燃烧后气体总体积为2.38L,(燃烧后的产物均为气态,其体积已换算为标准状况)求:
①烷烃R和炔烃Q的分子式。
②2.24LB中,烷炔R所允许的最大体积。
6、某烷烃和烯烃混合气2.24L(标准状况),点火使其完全燃烧,将燃烧产物通过浓硫酸后,使硫酸质量增加4.05g;再通过碱石灰,使碱石灰质量增加6.60g。另取等量混合气,通入过量溴水中,溴水质量增加1.05g。
(1)通过计算,分析判断混合气由哪两种烃组成?
(2)计算两烃的物质的量之比。
7、在常温常压下,将丙炔和氧气的混合气aL点燃,反应后生成二氧化碳和水,恢复为原状态时,混和气体积变为bL。试讨论在原混合气中的丙炔和氧气各为多少?
8、已知某不饱和烃含碳元素85.71%(质量分数),1mol该烃充分燃烧后生成的CO2全部被4mol/L的NaOH溶液1.50L所吸收。根据所得溶液中溶质的组成,推断相应不饱和烃的分子式,并填写下表(有几种情况填几种,不必填满)。
溶质 相应的烃分子式
1
2
3
4
5
9、饱和烃A和不饱和烃B在常温下均为气态,且烃A中含的碳原子数多于烃B。 (1)将A和B按一定比例混合,1L混合气体在氧气中完全燃烧,生成3.2L(同温同压)的CO2。试通过计算和分析,推断该混合气体的可能组成及A、B的体积比。
(2)1mol该混合气体恰好使0.4mol溴(四氯化碳溶液)完全反应,由此可得该混合气的确定组成。
10、有1,3-丁二烯和氢气的混合气体5L,在催化剂存在下,经充分反应得到的气体产物体积为VL(所有气体体积均在同温同压下测定)。
(1)若H2体积为1L,计算反应后气体产物的体积V。
(2)若H2在混合气体中的体积比值为x,计算x为不同值时反应后的体积V(以x表示),并画出V随x变化的曲线。
(3)在上述混合气体中若混有丙炔,总体积仍为5L,其中氢气和丙炔在混合气中的体积比分别为x和y。
①画出当y=0.2时,V随x变化的曲线。②画出当x=0.15时,V随y变化的曲线。
11、某饱和一元酸A和由饱和一元羧酸跟饱和一元醇形成的某酯B所组成的混合物,质量一共是9.00g,物质的量一共是0.15mol;把该混合物跟过量碳酸氢钠反应,在27℃、101kPa下产生二氧化碳的体积为1.23L。试通过计算和分析回答该混合物的可能组成。
12、饱和一元脂肪酸和一元脂肪醇形成的酯A和B的混合物,含碳质量分数为48.64%,试计算:
(1)此混合酯含氢的质量分数?
(2)将等物质的量相混合的A、B混合酯1mol完全燃烧,并消耗O23.5mol,则A和B的分子式可能有几种组合?
(3)若A和B互为同分异构体,则分子式为_____,写出酯的同分异构体的结构简式_____。
13、饱和一元醛和酮混合物5.8g,在气体时是同条件H2密度的29倍,等量的混合物溶于水后,与足量的银氨溶液反应,可析出8.64g 银,求此混合物由哪种醛和酮混合而成。
14、取一定量某液态饱和烃衍生物A,在1.01×105Pa170℃使其完全气化后,以1∶4体积比跟氧气混合后点燃,恰好完全反应,生成等体积的CO2和H2O(气),恢复到1.01×105Pa和170℃时,测得气体密度比反应前减少1/6,求A的分子式和结构简式。
15、有机物A是烃的含氧衍生物,在同温同压下,A蒸气的质量是同体积乙醇蒸气的2倍。1.38gA完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量会增加3.06g;若将燃烧产物通过浓H2SO4,浓H2SO4的质量会增加1.08g;取4.6gA与足量Na反应,生成的气体在标准状况下的体积为1.68L;A不与纯碱反应。通过计算试确定A的结构简式。
16、某种含有结晶水的羧酸A,在适宜的条件下可以完全分解为CO2、CO和H2O。取样品6.30g加热完分解得CO2:2.20g,CO:1.40g,水:2.70g。若中和0.2520g羧酸A需消耗20mL、0.2mol/L的NaOH溶液;若使0.005mol羧酸A完全转化为酯,需要0.460g乙醇,求羧酸A的分子式和无水物的结构式。
17、某液态有机物0.1mol与0.3mol氧气混合,于密闭容器中用电火花点火,燃烧完毕,将燃烧产物通入过量澄清石灰水中,可生成白色沉淀20.0g,溶液质量减少5.8g,剩余气继续通过灼热氧化铜,可使氧化铜质量减少1.6g,又知该有机物跟金属钠发生置换反应,还能发生银镜反应。通过计算写出该有机物的分子式,确定有机物的结构简式。
18、某饱和一元脂肪酸钠盐的结晶水合物10.88g,加热失去全部结晶水后,固
体物质的质量为6.56g。若把10.88g该结晶水合物跟50mL 1mol/L的NaOH溶液20.0mL恰好中和,求此脂肪酸钠结晶水合物的分子式。
19、乳酸是一种无色粘稠状物质,易溶于水。可由葡萄糖发酵制取,在酸牛奶中也可以找到乳酸,为研究乳酸分子的组成和结构,进行下述实验。
(1)称取纯净的乳酸9g,加热升温气化;所占有的体积在标况下为2.24L。
(2)将上述乳酸蒸气与足量的氧气混合后点燃,燃烧产物只有CO2和水。
(3)将燃烧产物通过碱石灰后,碱石灰增重14.2g,通过CuSO4白色粉末时,粉末不显蓝色,再通过足量的石灰水后有10g白色沉淀生成。
(4)将(3)中增重的碱石灰与过量的盐酸作用,产生气体4.48L(标准状况)
(5)乳酸在浓H2SO4催化下能与乙醇发生酯化反应,也能与乙酸发生酯化反应,而且乳酸分子中有-CH3。通过计算推出乳酸的分子式和结构简式。
20、测定污水的生物需氧量(BOD)的步骤是:取一定体积的污水与体积一定且含量一定的NaCl标准溶液混合,在20℃下的密闭保存5天后测定混合体系消耗掉的O2量,即一定体积污水中的BOD。
已知20℃常压下O2在纯水中的溶解度为0.0092 g/L;鱼在含氧量<0.04g/L的水中不能生存。经测定,某污水中含0.0010%的有机 物(以C6H10O5表示,摩尔质量162g/mol),试通过计算来回答鱼类在这种水里能否生存?
附答案
1、A:C4H8占20% B:CH4占80%
2、3/2≤nC3H6/nCH4≤4/1
3、C2H4。
4、CH4:17.14%、 C3H6:17.14%
或 C2H4:32.86%、 C2H6:32.86%
5、①R:CH4 Q:C4H6 ②0.14L
6、(1)CH4和丙烯 (2)n甲烷∶n丙烯=3∶1
7、(1)C3H4过量时,VO2=2(a-b),VC3H4=2b-a
(2)若恰好反应,VO2=2(a-b),VC3H4=(a-b) / 2
(3)当O2过量时,VO2=(a+b) / 2,VC3H4=(a-b) / 2。
8、
溶质 相应烃的分子式
1 Na2CO3 C3H6
2 NaHCO3 C6H12
3 Na2CO3和NaHCO3 C4H8或C5H10
4 Na2CO3、NaOH C2H4
9、(1)混合气体可能组合如下:
A的分子式 B的分子式 VA∶VB
C4H10 C3H6 1∶4
C4H10 C3H4 1∶4
C4H10 C2H4 3∶2
C4H10 C2H2 3∶2
(2)C4H10和C2H4,体积比为3∶2
10、(1)4L
(2)当x≤2 / 3时,V=5(1-x)L(氢气不足或适量);
x>2 / 3时,V=5(2x-1)L(氢气过量)
(3)如图
11.CH3COOH、
12、(1)8.11%
(2)一种:C3H6O2
(3)分子式:C3H6O2 结构简式:HCOOCH2CH3,CH3COOCH3
13、丙醛和丙酮
14、分子式:C3H6O 结构简式:CH3CH2CHO、CH3COCH3
15、
16、C2H6O6(C2H2O4·2H2O)、
17、C3H6O2,
18、CH3COONa·3H2O
19、分子式:C3H6O3 结构简式CH3-CH(OH)-COOH
20、1L水中的有机物的质量为:0.010(g),BOD的含量为0.012g/L>0.0092g/L,故鱼类不能生存。
五、综合计算
1、将一定量KClO3加热使其部分分解,然后向反应后的混合物中加入足量浓H2SO4,并加热发生如下反应:
KClO3+5KCl+3H2SO43Cl2↑+3K2SO4+3H2O
假设原KClO3为mmol,第一步分解反应的分解率为a,两步反应中生成的O2和Cl2的总物质的量为nmol。
(1)计算当氯元素全部转化为氯气时的a、n值。
(2)讨论当a在不同取值范围内的n值,并与(1)所算得的n值比较,确定该反应中n的最大值。
2、已知(SCN)2是一种与卤素单质化学性质相似的化合物,称拟卤素,其离子(SCN-)与X-的化学性质相似,称为拟卤离子。根据这一点,可以设计如下的实验来确定NaBr和NaCl混合物样品的组成。称取样品0.3672g,溶于水加入 0.2000mol/L AgNO3溶液 30.00mL(过量),再加入少量的含有Fe3+的溶液作指示剂,然后用 0.1000mol/L 的NH4SCN滴定溶液中过量的Ag+,到达滴定中点时用去NH4SCN溶液20.00mL。试回答以下问题:
(1)写出滴定过程中直到滴定终点的各步反应的离子方程式。
(2)计算样品中NaCl和NaBr的物质的量之比。
3、将amolH2S和1molO2置于一个容积可变的容器内进行反应,维持容器内气体的压强不变(101kPa)在120℃下测得反应前后容器内气体的密度分别为d1和d2。若a的取值不同,则H2S的氧化产物可能有如下三种情况:
(1)全部是SO2时,此时a的取值范围是_____。
(2)全部是S时,此时a的取值范围是_____,并且d1_____d2(填小于、大于或等于)。
(3)部分是SO2,部分是S,此时a的取值范围是_____,反应所生成的SO2的物质的量为_____mol,容器内气体的物质的量之和为_____mol。(以含a的代数式表示)
4、接触法制硫酸排放的尾气中,含少量二氧化硫。为防止污染大气,在排放前设法进行综合利用。
(1)某硫酸厂每天排放的1万米3尾气中含0.2%(体积分数) 的SO2,问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得多少千克石膏(CaSO4·2H2O)。
(2)如果将一定体积的尾气通入100mL2mol/L的氢氧化钠溶液使其完全反应,经测定所得溶液含16.7g溶质,试分析该溶液的成分,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠,调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量的最佳比值,从而提高亚硫酸氢钠的产量,现设nSO2、nNaOH、nNaHSO3分别表示SO2、NaOH、NaHSO3的物质的量,且nSO2/nNaOH=x,试写出x在不同取值范围时,nNaHSO3的值或nNaHSO3 与nSO2、nNaOH间的关系式。
x nNaHSO3
5、已知NH3和Cl2可快速反应。
2NH3+3Cl2N2+6HCl
图5-12为反应后总体积(VL)随原混合
气体中Cl2的体积分数(x %)而变化的曲
线。试计算:
(1)当反应结束时处于A、B两点时,原
混合物中Cl2的体积分数各是多少?
(2)当反应结束时处于A、B两点,混合
气体的总体积各是多少升?
(3)若反应结束时气体总体积为11L,则原混合物中Cl2的体积分数。
6、取0.45molNaOH、0.35molNa2CO3和0.20molNaHCO3溶于足量水中,然后在混合溶液中逐滴加入盐酸,反应明显分为三个阶段进行,若加入的HCl为nmol,溶液中NaCl、Na2CO3和NaHCO3分别为xmol、ymol、zmol。试分别计算n值增大过程中,不同反应阶段的n值取值范围所对应的x、y、z的值。将所得结果填入下表:(提示:Na2CO3与HCl的反过程为:
①Na2CO3+HCl==NaHCO3+NaCl
②NaHCO3+HCl==H2O+CO2↑+NaCl )
加入HCl(nmol) NaCl(xmol) Na2CO3(ymol) NaHCO3(zmol)
①
②
③
7、有一Na2O2的NaHCO3的均匀混合物粉末,将其分成两等份。其中一份加入100mL盐酸使其充分反应后,溶液呈中性,放出气体2.24L(标准状况);将上述气体通入另一份混合物中充分反应后,气体体积变为2.016L(标准状况)。求原混合物中Na2O2和NaHCO3的物质的量之比及加入盐酸的浓度各是多少?
8、用氨氧化法可制得50%HNO3,加脱水剂可进一步制得90%HNO3。某工厂同时生产50%HNO3和90%HNO3,两种产品质量比m 1/m 2=x(其中m 1、m 2分别为50%HNO3和90%HNO3质量)。若以17吨液氨为原料生产硝酸,请回答下列问题:
(1)导出理论上需水量(y吨)与质量比x的关系式(假定NH3的转化率为100%)是_____。
(2)根据导出的关系式求出只生产50%的HNO3所需的水量是_____;只生产90%的HNO3所需的水量是_____。
(3)质量比为_____时,进出水量保持平衡,此时两种产品的总质量为_____吨。
9、把1mol由氨气和氧气组成的混合气体通入密闭容器中,在催化剂存在下加热使之充分反应,然后恢复到常温常压。若混合气体中氧气有xmol,最后在反应器中产生的硝酸为ymol。
(1)写出氨的催化氧化及NO形成HNO3的化学方程式①_____;②_____。
(2)试确定x在不同的取值范围内y值表达式
x取值范围 y值表达式
①
②
③
(3)请在图5-13坐标上画出y=f(x)关系曲线。
10、在一支10mL试管中充满NO2
和O2,将其倒立于盛有足量水的水
槽中,若中y(mL)表示完全反应后试
管内剩余气体的体积,x(mL)表示原
混合气体中NO2的体积。
(1)填表
x的取值范围 y=f(x)
①当O2过量
②当NO2过量
(2)在坐标中绘出y=f(x)的曲线。
11、已知高温下能发生如下反应:Si+CSiC。现有石英砂和炭粉的混合物amol,在高温电炉中隔绝空气充分反应,经反应完全后,冷却得到残留固体。
(1)写出可能发生反应的化学方程式: ①_____;②_____。
(2)若石英砂与混合物的物质的量之比为x(0<x<1),试讨论x的取值范围;残留固体的成分和物质的量,并将结果填入下表:
x值 残留固体的化学式 残留固体的物质的量(mol)
①
②
③
④
⑤
12、今有碱金属的两种碳酸盐和碱土金属(第ⅡA族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标准状况),另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g。
(1)取过滤后滤液的1/10体积,向其中缓缓滴加浓
度为0.2500mol/L盐酸,并同时记录放出的CO2体积(标准
状况)和消耗盐酸的体积,得到如图5-14所示的曲线,
试计算确定为两种碳酸盐的化学式。
(2)将滤出的不溶性盐(1.420g)投入到浓度
为2.500mol/L盐酸中,当完全反应时,耗去盐酸16.00mL,试计算确定原不溶性碳酸盐的化学式。
13、在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4固体混合物,加热充分反为_____L。
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g,充分反应后,生成气体的体积(标准状况)为_____L。
14、使含有amolAl3+的A溶液中的铝元素和含有bmolAlO2-的B溶液中的铝元素全部转化为Al(OH)3沉淀,通过计算有几种途径。要求:
(1)不准另加固体和液体试剂。
(2)要答出每种途径所需试剂和物质的量。
15、在含amol[KAl(SO4)2]的溶液中逐滴加入Ba(OH)2溶液。
(1)写出反应的化学方程式。
(2)若已加入的Ba(OH)2溶液中含bmol溶质,试讨论:当a和b的比值为何值时,产生沉淀的成分及其物质的量各是多少?将计算结果填入下表:
a与b之比 产生的沉淀
分子式 物质的量/mol
16、把表面被氧化的A、B两个铝条分别放入甲、乙两种不同的溶液里。①把含有10.2g氧化铝的铝条放入1L1.5mol/L热的NaOH溶液中(甲),过一段时间取出A铝条,甲溶液增重12.6g。②把一定量的B铅条放入1L0.9mol/L的硫酸溶液中(乙),过一段时间取出B铝条,其质量减少了25.8g,溶液乙的质量增加了25.2g。设:反应后甲、乙两溶液体积仍各为1L。求:
(1)反应后甲溶液中的溶质是什么?其物质的量浓度是多少?
(2)反应后乙溶液中的溶质是什么?其物质的量浓度是多少?
(3)反应后的两种溶液相互混合时,若要滴加的量最小,而产生沉淀量最多,应如何操作?产生沉淀的最大质量是多少克?
17、有一铝粉和Fe3O4组成的铝热剂,在隔绝空气的条件下灼烧,使之充分反应。将所得混合物研细,并分成两等份,分别投入过量NaOH溶液和盐酸中。充分反应后,前者消耗m molNaOH,放出气体0.336L;后者消耗HCln mol,放出气体VL。若将等质量的这种铝热剂中的铝粉与足量稀H2SO4作用,可得气体3.36L(气体体积均在标准状况下测定)。求:
(1)该铝热剂中Al、Fe3O4的质量分数各为多少?
(2)m、n、V的值。
18、我国规定饮用水的硬度不能超过25度。硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其质量折算成CaO的质量。通常把1L水中含有10mgCaO称为1度。水中的Ca2+和Mg2+可用一定浓度的 Y 溶液进行滴定, Y 跟Ca2+和Mg2+都以物质的量完全反应。
(1)现取某地区的地下水样25.0mL,用0.01mol/L Y 溶液测定,完全反应时消耗 Y 溶液15.0mL。试计算该地下水的硬度,并判断是否符合饮用水的标准。
(2)如果每次分析时,取的水样都是25.0mL,为了便于计算,要求每消耗0.50mL Y 溶液即相当于水的硬度1度。则 Y 溶液的物质的量浓度应是多少?
19、在已平衡的托盘天平左右托盘上各放一只等质量的烧杯,并分别往烧杯中注入5mol/L盐酸60毫升。向左盘烧杯中放入a克CaCO3粉末,往右盘烧杯中加入x克A物质粉末,充分反应后天平仍保持平衡。
(1)若A为NaHCO3
①当a≤15时,x的值为_____;(用含a的代数式表示,以下同)
②当18.6≥a>15时,x的值为_____;
③当a>18.6时,x的值为_____。
(2)若A为KHCO3,且两只烧杯中均无固态物质存在,则x的取值必须满足的条件是_____。
20、具有线型结构的某二元化合物A中,氧的质量百分含量为47.0%,P2O5存在下加热,可从含氧为61.5%的某种酸W的一个分子中分解出2个水分子得到A,试通过计算推出A的化学式,W的结构简式,并写出W分解的化学方程式。
附答案:
1、(1)a=5 / 6, n=1.75m
(2)a>5 / 6时,n>1.75m;当a<5 / 6时,n<1.75m;a=5 / 6时,n=1.75m为最大值。
2、(1)Ag++SCN-=AgSCN↓
Fe3++SCN-=[Fe(SCN)]2+,
nNaBr∶nNaCl=0.003∶0.001=3∶1。
3、(1)a≤2 / 3
(2)a≥2,大于
(3)2 / 3<a<2,1-a / 2,1+a / 2。
4、(1)153.6kg
(2)该溶液成分为Na2SO3和NaHCO3,NaHSO3为0.1mol,Na2SO3为0.05mol。
(3)
nNaHSO3
x≤1 / 2 0
1 / 2<x<1 nNaHSO3=2nSO3-nNaOH
x≥1 nNaHSO3=nNaOH
5、(1)A点时VCl2=27.27%,B点时,VCl2=60%
(2)A点 2.45L,B点37.8L (3)17.8%或35.2%。
6、
HCl(n mol) NaCl(xmol) Na2CO3(ymol) NaHCO3(zmol)
① 0<n≤0.25 n 0.55 0
② 0.25<n≤0.8 n 0.8-n n-0.25
③ 0.8<n≤1.35 n 0 1.35-n
7、(1)Na2O2足量与放出的2.24L气体反应后,2.016L气体为O2时,n Na2O2∶n NaHCO3=8∶1,cHCl=3.4mol/L。
(2)2.24L气体通入混合物,Na2O2不足时,2.016L气体为CO2和O2混合物。n Na2O2∶n NaHCO3=2∶9,cHCl=1.3mol/L。
8、(1)y=(225x-99)/(5x+9)
(2)45吨(补充),11吨(脱水)
(3)x=11 / 25,81吨
9、(1)4NH3+5O24NO+6H2O……①
1-x x
4NO+3O2+2H2O4HNO3……②
(2)①0<x≤5 / 9,y=0,
②5 / 9<x≤2 / 3,y=3x-5 / 3,
③2 / 3<x<1,y=1-x
(3)见图10。
10、(1)0≤x≤8 y=10-5x / 4
(2)8<x≤10 y=5x / 3-40 / 3 见图11。
11、(1)①SiO2+2CSi+2CO↑ ②SiO2+3CSiC+2CO↑
(2)①x>1 / 3,按①式完全反应,n SO2=a / 2(3x-1), nSi=a / 2(1-x)。
②x=1 / 3,按①式完全反应,nSi=a / 3
③1 / 4<x<1 / 3,按①、②式反应,nSi=(4x-1)a nSiC=(1-3x)a
④x=1 / 4,按②式完全反应,nSiC=a / 4
⑤x<1 / 4,按②式反应,nC=(1-4x)a,nSiC=ax
12、(1)K2CO3、KHCO3
(2)Mg2(OH)CO3。
13、(1)5mol/L
(2)15.68L
(3)16.8L。
14、(1)分别向A中通入3a molNH3,向B中通入b / 2 molCO2。
(2)A与B混合。①若A、B恰好反应,不另加试剂。
②若a>b / 3时,Al3+剩余(a-b)/ 3(mol),加氨气3a-b(mol)。
③当a<b / 3时,AlO2-剩余b-3a(mol),通CO2(b-3a) / 2(mol) (提示:通CO2使AlO2-沉淀完全的反应为: 2AlO2-+CO2+3H2O2Al(OH)3↓+CO32-)
15、(1)2KAl(SO4)2+3Ba(OH)22Al(OH)3↓+3BaSO4↓+K2SO4
〔Ba(OH)2不足〕
KAl(SO4)2+2Ba(OH)22BaSO4↓+KAlO2+2H2O
〔Ba(OH)2足量〕
(2)
a与b之比 产生的沉淀
分子式 物质的量/mol
a / b≥2 / 3 Al(OH)3 2b / 3
BaSO4 b
1 / 2<a / b
<2 / 3 Al(OH)3 4a-4b
BaSO4 b
a / b≤1 / 2 BaSO4 2a
16、(1)NaAlO2 0.3mol/L, NaOH 1.2mol/L
(2)Al2(SO4)3 0.3mol/L
(3)将乙溶液滴加到甲溶液中,62.4g。
〔提示:(3)若将反应后的甲、乙溶液全部混合,乙溶液过量。〕
17、(1)wAl=28.0% wFe3O4=72.0%
(2)n=0.24mol, m=0.05mol, V=1.344L。
18、(1)33.6度,不符合
(2)0.00892mol/L。
19、(1)①x=1.176a ②x=2.1a-13.86 ③x=a+6.6
(2)x=a≤15
20、A的化学式为C3O2;结构简式:HOOC-CH2-COOH 分解的化学方程式为:
HOOC-CH2-COOHC3O2+2H2O
化学计算题
一、题型特点
化学计算是从量的方面来反映物质的组成、结构、性质及其变化规律的,是历年高考化学试题的压轴题,它具有情境新颖,信息量大,化学知识丰富,复盖面广,综合性强等特点。它不但能用来考查考生的思维能力和自学能力,还用来考查考生应用各方面知识进行逻辑思维、抽象思维、推理判断和分析综合的能力。因此这类试题区分度较大,易于把考生不同的知识和能力水平区分开来,具有选拔优秀学生的功能,比其它几种题型难度大,要求高。
二、基本概念和基本理论
1、钇(Y)元素是激光和超导的重要材料,我国蕴藏着丰富的含钇矿石(YxFeBe2Si2O10),已知矿石中铁为+2价。现将 4.68g 钇矿石样品与过量NaOH共熔,反应后加适量水溶解过滤,滤渣中有Y(OH)3、Fe2O3、滤液中有Na2SiO3和Na2BeO2等,将滤液配成 1L 溶液,测其pH =13。往此溶液中加入100mL 3.3mol/L盐酸(设混合后溶液体积为二者之和),结果溶液的pH值为1。Be(OH)2类似Al(OH)3具有两性。求Y元素的相对原子质量及x值。
2、某化合物的化学式可表示为CO(NH3)xCly(x、y均为正整数)。为确定x和y的值,取两份质量均为 0.2140g 的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用AgNO3溶液滴定(生成AgCl沉淀),共消耗24.0mL 0.100mol/L的AgNO3溶液。在另一份试样中,加入过量NaOH溶液并加热,用足量盐酸吸收逸出的NH3,吸收NH3共消耗24.0mL 0.200mol/LHCl溶液。试通过计算确定该化合物的化学式。
3、为测定一种复合氧化物型的磁性粉末材料的组成,称取12.52克样品,将其全部溶于过量稀硝酸后,配成100mL溶液,取其一半,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤,烘干后得4.66克固体,在余下的50mL 溶液中加入少许KSCN溶液,显红色;如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤,洗涤,灼烧后得3.20克固体。
(1)计算磁性粉末材料中氧元素的质量百分含量。
(2)确定该材料的化学式。
4、将2.0克某纯净固体A加热到200℃,完全分解后得到两种产物。气态氧化物B和0.90克水蒸气。这两种气体混合物的总体积为1.68L(已折算成标准状况)。试通过计算推断固体A的分子式。
5、物质的量相等的两种价态相同的无水金属化物29.6g,溶于水后再蒸发结晶,可得到两种金属氯化物的六水结晶水合物51.2g 。将这些结晶水合物强热灼烧,又得到氧化物的混合物(金属价态不变)13.1g ,如果将原金属氯化物的混合物溶于水,加过量NaOH溶液,所得沉淀过滤、洗涤、干燥和高温灼烧后(假设操作过程中均无损失),称得固体物质的质量为8.0g。试计算:
(1)两种金属氯化物的物质的量各为多少摩尔?
(2)两种金属元素各是什么元素?它们的化合价为多少?
6、A、B两种化合物的溶解度曲线如下右图所示,现要用结晶法从A、B混合物中提取A。(不考虑A、B共存时,对各自溶解度的影响。)
(1)取50g混合物,将它溶于100g热水,冷却至20℃。若要使A析出而B不析出,则混合物中B的质量分数(B%)最高不能超过多少?(写出推理及计算过程)。
(2)取wg混合物,将它溶于100g
热水,然后冷却至10℃。若仍使A析出
而B不析出,请写出下列两种情况下,
混合物A的质量分数(A%)应满足什
么关系式。(以w、a、b表示。只需
答案填写在下列横线的空白处。)
① 当w<a+b时,A%_____。
② 当w>a+b时,A%_____。
7、硫酸银的溶解度很小,25℃时,每100g水仅溶解0.836g。
(1)25℃时,在烧杯中放入6.24g硫酸银固体,加200g水,经充分反应后,所得饱和溶液的体积为200mL。计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50mL 0.0268mol/L的BaCl2溶液,充分搅拌,溶液中的Ag+的物质的量浓度多少?
(3)在(1)问中烧杯中需加多少升0.0286mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200mol/L?
8、由A、D、E、G 4个元素组成的化合物分子式为AxDy(E2G4)z。已知:
(1)x、y、z为正整数,且x +y +z =7。
(2)取8.74g该化合物溶于水,加入酸和强氧化剂。化合物中的E、G元
素完全转化为气体化合物EG2 2.688L(标准状况下),其密度为1.965g/L,EG2能使澄清石灰水变混浊。
(3)发生上述反应后,A、D以阳离子存在于溶液中。往溶液里加入过量的铁粉,其中使D离子全部还原所消耗的铁粉质量为0.56g。
(4)化合物中D元素的质量分数为12.8%。
试通过计算和推理确定E、G、D、A各是什么元素,求出x、y、z的值,并写出该化合物的化学式。(请按位置进行计算和推理)
9、由A、B、C 3种处于不同短周期的元素组成的化合物AxByCz,已知:
①x、y、z均为正整数,且x+y+z=13。
②取0.05mol该化合物与过量的水反应, 产生2.4g气体M,同时生成0.05mol白色胶状沉淀R,R既溶于NaOH溶液,又溶于盐酸。
③20mL由B、C两种元素组成的气体M,完全燃烧时消耗40mL氧气,燃烧产物只有CO2和H2O。试通过计算确定:
(1)A、B、C各是什么元素?
(2)M为何种气体?
(3)该化合物的化学式是:_____。
10、某复盐的化学式为AxB(ED4)y·zH2O,已知x、y、z均为正整数,且x+y+z=10,用该晶体完成下列实验:
①称取该晶体40.20g,在坩锅中加热至质量不再改变,固体质量减少了10.8g。
②将剩余固体溶于水配成200mL溶液,20mL,向其中加入过量的Ba(OH)2溶液,ED4离子和B离子全部沉淀,经过过滤、洗涤、干燥、冷却,称得固体质量为5.24g。
③往上述固体中加入过量盐酸,固体又减少了0.58g。试确定A、B是何种元素及该晶体的化学式。
11、在化工试剂中,要除去某种杂质离子,往往采用在一定条件下使之生成某浅黄色复盐〔分子式MxAy(DE4)z(OH)12〕析出。分子式中OH-为氢氧根,而M、A、D、E代表4种未知元素。已知:
①x+y+z =12(x、y、z均为正整数)。
②取9.7克该化合物溶于含稀硝酸的水中,滴加硝酸钡溶液,使D、E元素完全转化为白色沉淀,过滤干燥后称重为9.32g。
③滤液中A、M以阳离子形式存在,用胶头滴管取滤液2-3滴在白色点滴板(或玻璃片上),再加1-2滴KSCN溶液, 溶液呈红色。
④往滤液中通入足量的H2S气体,使A离子全部还原后,产生黄色沉淀物,干燥后称重为0.96g。
⑤化合物中A元素质量分数为34.64%。试通过计算推理判断 D、E、A、M 各是什么元素?求出x、y、z的数值。
12、某化合物化学式为AmBnCp·qH2O,其中A、B、C代表某种原子或原子团,在水溶液中A、B、C皆为离子。 ①取此化合物55.6g溶于水,通入足量H2S气体,与A离子完全作用生成黑色沉淀,过滤后,在滤液中加入过量的NaOH溶液并加热,得溶液甲,此时B离子转化为一种有刺激味且使石蕊变蓝的气体。
②将气体导出,用1L 0.6mol/L盐酸溶液完全吸收,再用0.4mol/L的NaOH溶液500mL中和过量的酸。③在步骤①中所得甲溶液中加硝酸使之呈酸性,再加过量AgNO3溶液,C转化为白色沉淀,过滤、干燥、称重得114.8g。④m∶n∶p为简单整数比,且m∶n =1∶2。⑤用适当方法除去化合物中的全部结晶水后;其质量减少13%。试回答:
(1)B的离子符号为_____,C是_____。
(2)通过计算确定m、n、p、q的值,并确定A和该化合物的化学式。
13、在20℃时将12.1M(NO3)x·3H2O晶体溶于44.3g水中,或在相同温度下将4.7gM(NO3)x无水盐溶于23.5g水中,均可制得该盐的饱和溶液。上述两部分溶液混合,再加水稀释为0.1mol/L,用惰性电极进行电解,当电极上通过0.15mol电子时,溶液中的Mx+离子恰好全部成单质析出(设无氢气生成)。
试计算:
(1)20℃时M(NO3)x的溶解度。
(2)M(NO3)x·3H2O的摩尔质量及x值。
(3)M的相对原子质量。
14、1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学
家。C60分子是形如球状的多面体(如下图所示),该结构的建立基于
以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
顶点数+面数-棱边数=2
据上所述,可推知C60分子有12个5边形和20个6边形,C60分子所含的双键数为30。
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是_____理由是_____。
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)_____,并简述其理由:_____。
(3)通过计算,确定C60分子所含单键数。
(4)C70分子也制得,它的分子结构模型可以与C60同样考虑而推知。通过计算确定C70分子中5边形和6边形的数目。
15、t℃时,H2(气)+I2(气)2HI(气)的可逆反应达平衡时[H2]为0.5mol/L,[I2]为0.1mol/L,[HI]为1.6mol/L。求HI、H2、I2的起始浓度的取值范围。
16、在一个容积不变的反应容器中,要求通过调节体系的温度使下列反应达到平衡时,保持容器内气体总物质的量为12mol。
A(气)+2B(气)2C(气)
现向反应器中加入 6.5molA、xmolB、2.0molC。
(1)若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应为_____热反应。
(2)欲使起始反应维持向逆反应方向移动。则x的取值范围为____。
(3)在一定温度下的上述平衡系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中气体的总量不要求保持12mol),按下式发生反应:
D(气)+E(气)2F(气)
当反应达到平衡时,D在平衡混合气体中的体积为p%。若向容器投入m mol D、n mol F和一定量的E,在这三种物质新的平衡体系中D的体积分数仍为p%,则所投入E的物质的量是_____mol(假设A、B、C和D、E、F之间不发生反应)。
17、在一定温度下,对于难溶电解质AmBn,在水中可建立如下平衡:
AmBn(固)mAn+nBm-
在一定温度下,当达到溶解平衡时,[An+]m·[Bm-]n为一常数,用Ksp表示,称为该温度下该难溶电解质的溶度积。
在一定温度下,当[An+]m·[Bm-]n=Ksp时,溶液呈现饱和状态,沉淀量既不增加,也不减少;当[An+]m·[Bm-]n>Ksp时,溶液呈现过饱和状态,将析出沉淀;当[An+]m·[Bm-]n<Ksp时,溶液呈不饱和状态,沉淀将溶解。
试根据上述原理,计算:
(1)已知在常温下,FeS的Ksp=6.25×10-18,求此温度下FeS的溶解度(g/100g 水)(设饱和溶液的密度为1g/mL)
(2)又知在常温下H2S饱和溶液,[H+]与[S2-]间存在着以下关系:[H+]2·[S2-]=1.0×10-22。在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中[Fe2+]达到1mol/L,应调节溶液的pH为多少?
18、如图所示,A容器里盛的是10%氢氧化钠溶液200g,B溶液器里的是1mol/L硝酸银溶液600mL,a、b、c、d是4个用铂做的电极。
(1)写出a、b、c、d 4个电极上的反应。
(2)若a电极收集到2.8L(标准状况)气体,
求此时A容器中氢氧化钠溶液的质量分数和d极上析
出的物质的质量?若B中溶液的体积不变,硝酸银
溶液的物质的量浓度的多少?
19、有一硝酸盐晶体 M(NO3)x·nH2O。已知M在晶体中的质量分数为26.45%。0.1mol此晶体配成200mL溶液,现将此溶液放置于电解池中用碳棒作电极进行电解,测得有0.2moL电子通过电极,溶液中金属阳离子全部还原析出,且阴极的质量增加6.4g。此时若电解液的体积不变,密度为1.032g/cm3,求
(1)M的原子量;
(2)晶体的化学式;
(3)反应后溶液的物质的量浓度和质量分数;
(4)电解后溶液的pH值。
20、双指示剂法可用来测定NaOH、NaHCO3、Na2CO3中的一种或两种物质组成的混合物的含量。具体做法是:先向待测液中加入酚酞,用标准盐酸滴定,当NaOH或Na2CO3被转化为NaCl或NaHCO3时,酚酞由红色褪为无色,消耗V1mL盐酸;然后滴加甲基橙,继续用标准盐酸滴定,当NaHCO3转化为NaCl时,溶液由黄色变为橙色,消耗V2mL盐酸。
(1)今用上法进行下表五种试样的测试,请根据盐酸的用量(V1、V2)确定试样②~⑤的成分。
试样 ① ② ③ ④ ⑤
标准盐
酸用量 V1>V2
且V2=0 V1<V2
且V1=0 V1=V2
且V2>0 V1>V2>0 V2>V1>0
试样的成分
(2)若称取1.200克含杂质的试样(杂质不与HCl反应),配制成100.0mL水溶液,取出 20.00mL,用0.1000mol/L标准盐酸滴定,测得V1=35.00mL,V2=5.00mL。求试样的成分及其百分含量。
附答案
1、89,x=2
2、化学式为Co(NH3)6Cl3
3、(1)钡的质量为5.48克,铁为4.48克,氧为20.45%
(2)原子个数比为Ba∶Fe∶O=1∶2∶4,化学式为BaFe2O4(或BaO·Fe2O3)
4、化学式为N2O
5、(1)各为0.1mol
(2)Fe、Al +3价,+3价
6、(1)B%≤40%(或B%<40%)
(2)①当w<a+b时,A%>a / w;
②当w>a+b时,A≥(w-b) / w 或 A%>(w-b) / w
7、(1)[Ag+]=0.0536(mol/L)
(2)[Ag+]=0.0536mol/L
(3)V=0.489(L)
8、E为C,G为O,D为Fe,A为K; x=3,y=1,z=3; K3Fe(C2O4)3。
9、(1)根据性质推知:A为银,B、C各为氢或碳;化合物为AlxCyHz
(2)CH4 (3)AlC3H9 或Al(CH3)3。
10、A为钾,B为镁。
11、D:S,E:O,A:Fe,M:Na
化合物化学式为Na2Fe6(SO4)4(OH)12 或 NaFe3(SO4)2(OH)6。
12、(1)NH4+ Cl-
(2)m=1 n=2 p=4 q=4;A为Cu;Cu(NH4)2Cl2·4H2O。
13、(1)S=4.7/23.5×100=20(g) 242(g/mol)
(2)x=2
(3)64。
14、(1)金刚石 金刚石属原子晶体,而固体C60不是,故金刚石熔点极高。
(2)可能。因为C60分子含30个双键,与极活泼的F发生加成反应,即可生成C60F60
(3)60
(4)5边形数为12,6边形数为25。
15、[HI]起始时可取0~1.8mol/L的任何值;[H2]起始时可取0.4~1.3mol/L的任何值;[I2]可取0~0.9mol/L的任何值,或与[HI]、[H2]相对应的任何值;[H2]也可取与[HI]相对应的任何值。
16、(1)放热 (2)2.5<x<3.5 (3)2m+n/2。
17、(1)在溶液中,[Fe2+]=[S2-] [Fe2+]=[S2-]=
==2.5×10-9(mol/L)
FeS溶解度:2.5×10-9×88×100/1000=2.2×10-8(g)
(2)[Fe2+][S2-]=Kap=6.25×10-18(mol/L)
[H+]2[S2-]=1.0×10-22
[H+]==4×10-3(mol/L)
pH=-lg[H+]=-1g(4×10-3)=3-0.6=2.4
18、(1)a电极(+),4OH--4e2H2O+O2↑,
b电极(-),2H++2eH2↑,
c电极(+),2H2O-4e4H++O2↑,
d电极(-),Ag++eAg
(2)10.23%,54g,0.17 mol/L。
19、(1)64
(2)Cu(NO3)2·3H2O
(3)1mol/L,6.1%
(4)0。
20、(1)①NaOH ②NaHCO3 ③Na2CO3 ④NaOH和Na2CO3
⑤NaHCO3和Na2CO3
(2)NaOH%=50.00%;Na2CO3=22.09%
三、元素化合物
1、将一定量Cl2通入250gKBr溶液中,然后将此溶液蒸干,并将残渣灼烧,冷却后称重为40g,经分析得知其中含有质量分数为25%的化合态溴。
(1)如果Cl2密度为3.17g/L,则通过Cl2的体积是多少升?
(2)最初KBr溶液中溶质的质量分数是多少?
2、某烧瓶中盛有50mL浓度为12mol/L的浓盐酸,向此烧瓶中加入ag(a<13)MnO2共热,反应停止后,将烧瓶内的液体冷却并蒸干,结果得到bg固体,则bg固体中氯元素的质量可能是多少?
3、ag氯气与bg氢气混合点燃爆炸,将生成的气体通入足量硝酸银溶液。
(1)a、b满足什么关系时氯气过量?
(2)当氢气过量时生成的沉淀质量为多少克?
4、氧气和氯气混合气500mL,氢气在其中充分燃烧,用水吸收生成物得到250mL溶液,从中取出25mL,恰好能与20mL 0.125mol/LNaOH溶液反应,则与混合气反应的氢气的体积为_____mL。(气体体积均在标准状况下测得)
5、将一定量的氯气通入140mL氢硫酸溶液中,Cl2和H2S恰好完全反应,有淡黄色沉淀生成,过滤后溶液的pH=1。取5mL滤液与足量AgNO3溶液的反应得amolAgCl沉淀,另取5mL滤液与足量BaCl2溶液反应得bmolBaSO4沉淀,a∶b=12∶1。
(1)写出Cl2与H2S反应的化学方程式(要求写一个总反应) ①_____
(2)参加反应的Cl2在标准状况下的体积为②_____,生成淡黄色沉淀的质量为③_____,原氢硫酸溶液的物质的量浓度为④_____。(假设滤液的体积仍为140mL)
6、不同卤素原子之间可以互相共用电子对形成一系列化合物,这类化合物叫卤素互化物。现将4.66gBrCln溶于水,再通入过量SO2,使其发生反应:
BrCln+(n+1)H2O+ SO2=HBr+nHCl+ H2SO4。
然后将所得溶液调至中性,再加入过量的硝酸银溶液处理,可生成15.46g沉淀。试确定BrCln中的n值。
7、用KClO3加热制取O2中常含有少量的Cl2和O3。为测定Cl2和O3的含量。将KClO3分解得气体V1升通过足量KI溶液。干燥后得气体V2升(均为标准状态)。再用Na2S2O3溶液滴定KI溶液中的I2(反应式为:O3+2KI+H2O==O2+I2+2KOH; I2+2Na2S2O3==2NaI+Na2S4O6)。若V1=1.00L,V2=0.98L,滴定中消耗0.100mol/LNa2S2O30.0267L,试计算气体中Cl2、O3的体积分数。
8、往400mL0.5mol/LNaOH溶液中通入一定量的H2S气体,然后低温蒸发溶液,得白色固体A7.92g。
(1)推测此白色固体A所有可能的组成,并写出其化学式。
(2)通过计算确定A的组成及其质量。
9、写出H2S燃烧反应的化学方程式。1.0LH2S气体和aL空气混合后点燃,若反应前后气体的温度和压强都相同(20℃、101.3千帕),试讨论当a的取值范围不同时,燃烧后气体的总体积V(用含a的表达式表示。假定空气中氮气和氧气的体积比为4:1,其它成分可忽略不计)。
10、将Na2SO3与Na2S的混合物若干克配制成50g溶液,加入50g一定浓度足量的盐酸,放出气体0.448L(标准状况),混合液为96.9g,求混合物中Na2SO3与Na2S的物质的量各为多少?
11、在500mL0.2mol/LNaOH溶液中缓缓通入一定量SO2气体(标准状况),充分反应后,在减压低温条件下蒸发溶液,得到8.76g不含结晶水的白色固体A。
(1)推测A所有可能的组成,并将其化学式填入下表(有几种组成情况就填几格,不必填满)。
编号
A的可能
组成的
化学式
(2)通过计算确定A的组成物质及其质量。
12、在标准状况下,将100mLH2S、O2的混合气体点燃后恢复到原状况,发现混合气体中O2所占的体积V(O2)的变化,反应后所得气体的总体积V总也不同。其关系如图5-6所示,回答下列问题:
(1)写出坐标点B、C两处反应的化学方程式。 B处_____; C处_____。
(2)从图像分析可知:①当V总>40mL时,气体成分为_____;②当V总=40mL时,气体成分为_____;③当V总<40mL时,气体成分为_____。
(3)当V总=25mL时,求原混合气体中H2S和O2各多少毫升?
13、工业上用硫铁矿石燃烧制SO2时,假如硫的损失率为2%,SO2接触氧化制SO3时,SO2的转化率为90%,SO3吸水得硫酸,硫酸的产率为96%,若以100t纯度为75%的硫铁矿石为原料,可得98%的浓H2SO4多少吨?
14、某化合物的化学式为x(NH4)2SO4·FeSO4·yH2O,取这种物质0.01mol(质量为3.92g),溶解于蒸馏水产定容100mL。吸10mL溶液,用0.1mol/LBaCl2溶液滴定,使SO42-刚好完全沉淀时,耗去BaCl2 溶液20mL。求:
(1)该复盐中x、y的值是多少?
(2)另取10mL该复盐溶液,欲使其中Fe2+全部沉淀,而NH4+全部转化为NH3逸出,至少需要消耗0.4mol/L的苛性钠溶液多少mL?
15、加热硝酸银晶体使其完全分解,反应方程式为:
2AgNO32Ag+2NO2↑+2O2↑
生成的气体用排水法收集得A;加热后的残渣中加入浓硝酸完全反应后,生成的气体又用排水法收集得气体B;再把A、B两气体混合,求此混合气体的平均式量。
16、磷和氯气反应,可以生成PClx和PCly,把0.31g磷与氯气反应,由于氯气的量不足,生成PClx和PCly的混合物,其中PClx和PCly的物质的量之比为2:3。若把这些混合物全部溶于水,加入足量的AgNO3溶液,生成6.027gAgCl沉淀,求x和y的值。
17、实验室欲配制5L由NaH2PO4和Na2HPO4组成的混合液,该溶液中要求每升含0.1mol磷原子且NaH2PO4与Na2HPO4物质的量之比为1:4,求:
(1)需浓度为5mol/L的H3PO4多少毫升?
(2)称取NaOH固体多少克?
18、使一定量的磷化氢和氢气的混合气体,依次通过两支加热的硬质玻璃管,第一支玻璃管中装有铜屑,第二支玻璃管中装有氧化铜。第一支玻璃管中由于发生如下反应:2PH3+3CuCu3P2(固)+3H2,玻璃管质量增加4.96g,第二支玻璃管的质量发生反应后减少了5.76g。
(1)计算原混合气体中,磷化氢和氢气的体积比。
(2)在标准状况下,原混合气体的密度是多少?
19、在标准状况下,总体积为10L的NO2、NH3、N2组成的混合气体,通过过量的稀硝酸,结果气体体积缩小为3.28L。溶液增重12.5g。试求:
(1)混合气体中各成分体积分别是多少?
(2)计算混合气体在标准状况下的密度是多少?
20、NH3和Cl2可迅速地进行下列反应:2NH3+3Cl2==N2+6HCl 下图为反应后气体总体积VL随该混合气体中Cl2的体积含量(x%)而变化的图像(每次实验取气体的总量均为18L) 试计算:
(1)当反应结束处于B点时,原混合气体中Cl2的体积分数是多少?
(2)当反应结束处于A点时,所得气体的总体积是多少升?
(3)若反应结束时,气体总体积为6L,则原混合气体Cl2的体积百分含量是多少?(计算结果均保留3位有效数字)
21、在mmLNO和NO2的混合气体中,NO的体积分数为x。现将混合气体与氧气以2:1的体积比再次混合于试管中,然后使其倒立水中,与水充分反应。
(1)若反应后,试管内无剩余气体,则x的值应为多少?
(2)若反应结束后试管内尚有剩余气体,请指出剩余的为何种气体,并用原混合气体中NO的体积分数x表示剩余气体的体积(VmL)。
(3)画出V随x变化的函数图像,并在坐标轴上标出计算所得的有关数据。
22、将amolCO2通入含bmolCa(OH)2的澄清石灰水中,根据a与b的关系讨论生成沉淀的物质的量。
23、通常情况下,CO和O2混合气体mL用火花引燃,体积变为nL(反应前后条件相同)
(1)试确定混合气体中CO和O2的体积(用V(CO)、V(O2))表示。
(2)当反应后的气体密度在相同条件下为H2密度的15倍时,试确定气体的成分和体积。
24、将一小块焦炭和mgO2同时放入装有压力表的密闭容器中,压强为P0,当充分反应后恢复到原温度,压强为P1。
(1)填写下表:
P1与P0的关系 焦炭质量W的取值 发生反应的化学方程式
① P1=P0 w1≤Vg
② P1=2P0 w2≥Vg
③ 2P0>P1>P0 w3=Vg
(2)会不会出现P1>2P0的情况?为什么?
(3)当焦炭质量取mg/2时,P1与P0的的关系式是_____。
25、取Na2CO3和NaHCO3混合物9.5g,先配成稀溶液,然后向该溶液中加入9.6g碱石灰,充分反应后,使Ca2+、HCO3-、CO32-均转为沉淀。再将反应器内水分蒸干,可得20g白色固体。
(1)求原混合物中Na2CO3和NaHCO3各多少克?
(2)求碱石灰中CaO和NaOH各多少克?
26、将一定体积的CO2通入V升NaOH溶液中,恰好完全反应。在反应后溶液中加入足量的石灰水,得A克沉淀。
(1)能否用以上数据确定CO2的体积(标准状况)?如果能确定,请列式表示;如果不能,还需做什么实验,运用实验测得的数据列式表示。
(2)能否确定NaOH溶液的物质的量浓度?如果能确定,请列式表示;如果不能,还需做什么简单的实验,运用实验测得的数据列式表示。
27、取金属钠和钙各一小块,投入足量水中,反应完毕后,共产生H21.568L(标况),再取Na2CO3和NaHCO3的混合物3.8g,溶于适量水中。将以上两溶液混合,恰好使Ca2+、CO32-、HCO3-全部沉淀,反应完毕后,将溶液蒸干得8.8g白色固体,再将这些白色固体洗涤、干燥,剩下白色不溶物4g。求:
(1)钠和钙的质量;
(2)混合物中Na2CO3和NaHCO3的物质的量之比。
28、将粉末状碳酸氢钠和碳酸钠的混合物若干克加热至完全反应,使生成的气体通入20℃、270g饱和石灰水中,完全反应后生成白色沉淀0.4g。向加热后的残留物中加入足量盐酸生成气体0.672L(标准状况)。求原混合物中NaHCO3和Na2CO3的可能的物质的量之比(20℃时Ca(OH)2的溶解度为0.165g)。
29、有30mL可能由一氧化碳、二氧化碳和氧气组成的混合气体,通过足量的过氧化钠充分反应后,气体体积变为25mL。引燃这25mL气体,待恢复到原温度,气体体积变成了20mL。试讨论原混合气体可能由哪些气体组成,各气体体积分别是多少?
30、在一密闭容器中,事先放入1.56gNa2O2,然后通入氧气,再通入C2H6,用电火花引爆,直至反应完全为止,容器内压强近似为零。求:
(1)通入的气体O2和C2H6应有怎样的体积比(相同条件下)?
(2)通入氧气的量不能超过多少克?
31、等量(等质量或等物质的量)的镁、钠和铝,与等量的盐酸反应,产生的H2的量可出现下列四种情况:①Na>Mg=Al. ②Na=Mg=Al. ③Mg=Al>Na④Al>Mg>Na,若盐酸中所含HCl均为1mol时,将满足上述四种情况所需金属的量填入下表:
等量的Na、Mg、Al ① ② ③ ④
物质的量 x(mol)
质量 y(g)
32、将aLCO和CO2的混合气体通过足量的过氧化钠(假设反应完全),收集所得气体并引爆,再将引爆后得到的气体通过足量的浓碱溶液,经干燥收集到气体bL。求原混合气体中CO2和CO的体积(气体体积均在同温、同压下测得)。
33、将一定量的CO2气体通入500mLNaOH溶液中,完全反应后将溶液低温蒸发,得到不含结晶水的固体A。取三份质量不同的该固体分别与50mL相同浓度的盐酸反应,得到气体的体积与固体A的质量关系如下表所示:
组别 1 2 3
盐酸的体积/mL 50 50 50
固体A的质量/g 3.80 6.20 7.20
气体体积/mL 896 1344 1344
(注:气体体积在标准状况下测得)
(1)上表中第几组数据表示所加盐酸有剩余?简述理由。
(2)请经过计算,讨论判断固体A含什么物质?各成分的质量分数各是多少?
34、化学上以12C作为确定原子量的标准。若把12C的原子量定为24,并规定把24g12C所含碳原子数定为阿伏加德罗常数,试用上述新的定义计算下题: 使0.2mol(新定义)金属钠跟过量的水反应。 求:
(1)生成多少L氢气(标准状况)?
(2)反应后溶液(设反应后溶液为100g)中溶质的质量分数?
(3)反应后溶液(设反应后溶液为100mL)的pH值?
35、向200mL稀硫酸中投入一定量的铝,同时加入适量的Na2SO3,收集到17.92L混合气体(标准状况),析出白色沉淀物经分离,沉淀用坩埚加强热得5.1g白色粉末。求:
(1)混合气体各成分的体积比。
(2)混合气体的平均式量。
(3)硫酸的物质的量浓度。
36、将过氧化钠溶于足量水,完全反应后再加入铝粉。反应后溶液中无固体残留,先后共收集到气体1.008L(标准状况)。这些气体置于密闭容器中用电火花引爆恰好完全反应。
(1)写出溶液中反应的化学方程式。
(2)求加入过氧化钠的质量和铝粉的质量。
(3)上述反应后的溶液中需加入1mol/L的盐酸多少毫升理论上才能析出最多的沉淀物?
37、向某MgSO4和Al2(SO4)3各0.5mol的混合溶液中逐滴加入氢氧化钠溶液直至过量。在如下图中用图像表示这一实验的变化过程(纵坐标为生成沉淀的量,横坐标为加入氢氧化钠溶液的量)。
38、向含0.02molAl3+的明矾溶液中,逐滴加入0.1mol/L的Ba(OH)2溶液的体积x(mL)的关系如下图所示。则V1=①______mL,V2=②______mL,m1=③_____g,m2=④_____g。
39、将NaOH、MgCl2、AlCl33种固体混合物放入足量水中,充分反应后得悬浊液。向该悬浊液中逐滴加入5mol/L盐酸,沉淀的物质的量与所加盐酸体积的关系如图所示。则原混合物中含NaOH①_________mol、MgCl2②_________mol、AlCl3③_________mol、D点为④_________mL。
40、某溶液可能含有Fe2+、Mg2+、Cu2+、、Al3+中的数种,当向其中加入一种淡黄色固体并加热时,有刺激性气味的气体放出并生成白色沉淀,加入淡黄色固体的物质的量(横坐标)与生成气体,沉淀(纵坐标)的物质的量之间关系如下图所示。则加入的淡黄色的固体是①________,溶液中含有的离子是②________,各种离子之间的物质的量之比为③________。
41、有一种医用制酸剂,由氢氧化铝、碳酸氢钠和碳酸钙混合而成。现称取这种制酸剂5g,溶解于200mL1mol/L的盐酸中,放出二氧化碳784mL(标准状况)。把二氧化碳完全驱出溶液后,再加入1.2mol/L的氨水150mL(溶液呈碱性),得到氢氧化铝沉淀,过滤并洗涤沉淀,洗液和滤液合并,用0.75mol/L稀盐酸滴定,共用去40mL盐酸恰好中和,问制酸剂三种成分的质量分数是多少?
42、加热硬质玻璃管中的CuO与Fe2O3的混合物,并通过足量CO使之充分反应,将反应后的气体通过盛NaOH溶液的洗气瓶充分吸收。碱液质量增加24.2g。另取一份混合物(质量与硬质玻璃管中的相等),用足量盐酸溶解,再向溶液中加ag(足量)铁粉,使之充分反应。
(1)当a=50g时,同时生成气体8.96L(标准状况)。反应完全后,过滤混合溶液,洗涤、干燥,得沉淀质量比碱液增加的质量少0.20g。求原混合物中CuO与Fe2O3的物质的量之比。
(2)若向滤液中加入一定量NaOH溶液,生成物Fe(OH)3和Fe(OH)2物质的量之比为2:3时,求a值。
43、将铜制印刷线路板浸入120mL氯化铁溶液中,一定时间后取出,发现线路板质量减轻了9.6g。然后向溶液中加入8.4g铁粉,经充分的反应,溶液中还存在4.8g不溶性物质。问溶液中存在哪种金属离子,并求出其离子浓度(设溶液体积不变,且不考虑金属离子水解)。
44、现有FeCl2和CuCl2混合溶液400mL,经测定其中Cl-的浓度为amol/L。向其中投入过量锌粉bg,充分反应后过滤,所得固体残渣经洗涤干燥后,称重为cg。
(1)求混合溶液中的Fe2+、Cu2+的浓度各是多少?
(2)b的取值范围。
(3)c的数值越大,说明混合液中CuCl2的含量_____;c的最大值(用a、b表示)应为_____。
45、今有Fe、Fe2O3、CuO 3种粉末组成的混合物,取一定量跟2mol/L的H2SO4110mL完全反应后得H2896mL(标准状况)。将上述混合物过滤,滤渣经干燥,冷却后称量为1.28g;滤液中的金属离子均为Fe2+,将滤液稀释至200mL,从中取出20mL,向其中加入0.4mol/L的NaOH溶液,边加边振荡,当加至20mol时溶液开始出现沉淀。求
(1)原混合物中CuO的质量。
(2)原混合物中Fe2O3的质量。
(3)稀释的200mL滤液中Fe2+的物质的量浓度。
附答案
1、(1)3.78L (2)22%
2、(1)若a值较小,为(71 / 126)bg (2)若a值较大,71 / (39(b-a))g。
3、(1)a<20 / 71时 (2)287 / 71bg
4、720
5、(1)①3H2S+6Cl2+4H2O==2S↓+12HCl+H2SO4
(2)②134.4mL,③64mg,④0.021mol/L
6、n=3
7、含Cl2为2%;含O3为1%
8、(1)①Na2S,NaOH, ②Na2S, ③Na2S,NaHS, ④NaHS
(2)A的组成为:Na2S 3.12g NaOH 4.8g 或 Na2S 7.53g NaHS 0.39g
9、2H2S+O22S+2H2O;
2H2S+3O22SO2+2H2O
若a≤2.5L,则V=1+a-3a/5=1+2a / 5L,
若a≥2.5L,则V=1+a-1.5=(a-0.5)L。
10、若放出SO2,Na2S为0.038mol,Na2SO3为0.039mol;
若放出H2S,Na2S为0.07mol,Na2SO3为0.025mol。
11、(1)
① ② ③ ④
NaOH
Na2SO3 Na2SO3 Na2SO3
NaHSO3 NaHSO3
(2)A是由2.52gNa2SO3与6.24gNaHSO3组成的混合物。
12、(1)略
(2)①H2S或SO2,②H2S或SO2,③H2S或SO2
(3)75mL、25mL、或50mL、50mL。
13、105.84吨。
14、(1)x=1,y=6 (2)10mL。
15、43.2。
16、x=3 y=5
17、(1)100mL (2)36g。
18、(1)4∶3 (2)0.91g/L。
19、(1)VNO2=6.72L,VNH3=2.24L,VN2=1.04L
(2)1.68g/L。
20、(1)60.0% (2)1.64L (3)20.0%或33.3%
21、(1)设m mL气体混合物的平均化学工为NOa,则2NOa+O2+H2O=2HNO3,根据氧原子守恒:2a+2+1=2×3
a=1.5
1 0.5 1.5 ∴x=0.5 2 0.5
(2)0
22、CO2与Ca(OH)2的反应方程式为:
Ca(OH)2+CO2==CaCO3↓+H2O ①
CaCO3+H2O+CO2==Ca(HCO3)2 ②
②或为:Ca(OH)2+2CO2==Ca(HCO3)2 ③
(1)当a≤b时,生成沉淀a mol。
(2)当b
23、(1)当VCO/VCO2≥2,VO2=m-n(L),VCO=nL;
当VCO/VCO2<2,VO2=2n-m(L),VCO=2(m-n)L;
(2)生成物为CO和CO2,VCO=7n/8,VCO2=1/8n。
24、(1)①3m/8 C+O2=CO2
②3m/4 2C+O2=2CO (或C+CO2=2CO)
③3m/8×P1/P0 C+O2=CO2和2C+O2=2CO
(2)不会;因为1体积O2完全反应后,最多生成2体积的气体(CO)
(3)P1=4 P/ 3
25、(1)Na2CO3为5.3g,NaHCO3为4.2g
(2)CaO为5.6g,NaOH为4.0g。
26、(1)能。因为CO2~Na2CO3~CaCO3,CO2~NaHCO3~CaCO3,
nCO2=nCaCO3=A/100mol; VCO2=A/100×22.4L
(2)不能。另取VLNaOH溶液,仍通入22.4A/100LCO2(标况), 反应完全后,加入足量的CaCl2溶液,得沉淀Bg。
讨论:①若B=A,则[NaOH]=A / (50V) (mol·L-1);
②若B=0,则[NaOH]=A / (100V)(mol·L-1);
③若B<A,则[NaOH]=(A+B) / (100V) (mol·L-1)。
27、(1)Na的质量为1.38g,Ca的质量为1.6g
(2)nNa2CO3∶nNaHCO3=0.02∶(0.04-0.02)=1∶1
28、nNaHCO3/nNa2CO3为4 / 13 或 8 / 11。
29、①CO20mL,CO210mL, 或 ②CO10mL,CO210mL,O210mL。
30、(1)2.5≥VO2/VC2H6≥1 (2)0.8g。
31、
x>1 x=1 1 / 2<x<1 0<x<1/2
y>23 y=23 12<y<23 0<y<12
32、若CO2过量,原混合气中CO为(a-2b)L / 2,CO2为(a+2b)L / 2;
若CO过量,原混合气中CO为(a+b)L / 2,CO2为(a-b)L / 2。
33、(1)第一组;1~3各组所用盐酸量相同,而第1组生成的气体比
2、3组少,所以第1组盐酸过量
(2)A中含有Na2CO3,NaHCO3各0.02mol,wNa2CO3=55.8%,
wNaHCO3=44.2%。
34、(1)4.48L (2)16% (3)14.9%
35、(1)VH2∶VSO2=3∶13 (2)52.38 (3)3.25mol/L。
36、(1)2Na2O2+2H2O==4NaOH+O2↑,
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
(2)Na2O2 2.34g,Al 0.54g
(3)60 mL
37、
38、①300 ②400 ③8.55g ④9.32g。
39、①0.65 ②0.1 ③0.1 ④130。
40、①Na2O2 ②NH4+、Mg2+、Al3+ ③3∶1∶1。
41、Al(OH)3=36.4%, NaHCO3=33.6%, CaCO3=30%。
42、(1)5∶2 (2)2.8
43、溶液中存在Cu2+和Fe2+,[Cu2+]=0.625mol/L,Fe2+=5mol/L。
44、(1)[Fe2+]=(56-5c-a) / 16 (mol/L)
[Cu2+]=(9a-5b+5c) / 16 (mol/L)
(2)b>13a
(3)越大,趋近 b-0.2a。
45、(1)wCuO=1.6g (2)6.4g (3)0.9mol/L
四、有机化合物
1、由一种气态单烯烃A和一种气态烷烃B组成的混合气体,对H2的相对密度为12。将1体积该混合气体与4体积氧气混合,于密闭容器中用电火花引燃,使两种烃都充分氧化。如果反应前后温度均为150℃,测得容器内的压强由反应前的101kPa增加至燃烧后的105.04kPa,求A、B各是什么烃?其体积分数各是多少。
2、在温度为150℃条件下,向密闭容器中充入1mol丙烯和甲烷的混合气体,再充入适量的氧气,完全燃烧后再恢复到150℃,欲使丙烯和甲烷的混合气体对氢气的密度≥15.8,且反应后气体分子增加的总的物质的量≥0.4mol,问丙烯和甲烷的物质的量之比应满足什么条件?
3、在常压、150℃时,某气态烃与过量氧气的混合气体aL,点燃后并恢复至原来的条件,体积仍为aL;然后将燃烧产物通过浓硫酸,体积减少bL;再通过NaOH,体积又减少bL,最后剩有少量尾气。求该烃的分子式。
4、将丁烷在催化剂存在时进行裂解,设丁烷裂解后生成分子量更小的烷和烯。将裂化后的气体通过足量的溴水完全反应后,再将剩余气体冷却,在标况下测得剩余气体的密度是1.125g/L,求丁烷裂化后生成的混合物的成分的体积分数。
5、有A、B、两份混合气体,A是烷烃R足量氧气的混合气体,B是烷烃R与炔烃Q及足量氧气的混合气体。在标准状况下,各取A、B2.24L引燃。A充分燃烧后气体总体积仍为2.24L;B充分燃烧后气体总体积为2.38L,(燃烧后的产物均为气态,其体积已换算为标准状况)求:
①烷烃R和炔烃Q的分子式。
②2.24LB中,烷炔R所允许的最大体积。
6、某烷烃和烯烃混合气2.24L(标准状况),点火使其完全燃烧,将燃烧产物通过浓硫酸后,使硫酸质量增加4.05g;再通过碱石灰,使碱石灰质量增加6.60g。另取等量混合气,通入过量溴水中,溴水质量增加1.05g。
(1)通过计算,分析判断混合气由哪两种烃组成?
(2)计算两烃的物质的量之比。
7、在常温常压下,将丙炔和氧气的混合气aL点燃,反应后生成二氧化碳和水,恢复为原状态时,混和气体积变为bL。试讨论在原混合气中的丙炔和氧气各为多少?
8、已知某不饱和烃含碳元素85.71%(质量分数),1mol该烃充分燃烧后生成的CO2全部被4mol/L的NaOH溶液1.50L所吸收。根据所得溶液中溶质的组成,推断相应不饱和烃的分子式,并填写下表(有几种情况填几种,不必填满)。
溶质 相应的烃分子式
1
2
3
4
5
9、饱和烃A和不饱和烃B在常温下均为气态,且烃A中含的碳原子数多于烃B。 (1)将A和B按一定比例混合,1L混合气体在氧气中完全燃烧,生成3.2L(同温同压)的CO2。试通过计算和分析,推断该混合气体的可能组成及A、B的体积比。
(2)1mol该混合气体恰好使0.4mol溴(四氯化碳溶液)完全反应,由此可得该混合气的确定组成。
10、有1,3-丁二烯和氢气的混合气体5L,在催化剂存在下,经充分反应得到的气体产物体积为VL(所有气体体积均在同温同压下测定)。
(1)若H2体积为1L,计算反应后气体产物的体积V。
(2)若H2在混合气体中的体积比值为x,计算x为不同值时反应后的体积V(以x表示),并画出V随x变化的曲线。
(3)在上述混合气体中若混有丙炔,总体积仍为5L,其中氢气和丙炔在混合气中的体积比分别为x和y。
①画出当y=0.2时,V随x变化的曲线。②画出当x=0.15时,V随y变化的曲线。
11、某饱和一元酸A和由饱和一元羧酸跟饱和一元醇形成的某酯B所组成的混合物,质量一共是9.00g,物质的量一共是0.15mol;把该混合物跟过量碳酸氢钠反应,在27℃、101kPa下产生二氧化碳的体积为1.23L。试通过计算和分析回答该混合物的可能组成。
12、饱和一元脂肪酸和一元脂肪醇形成的酯A和B的混合物,含碳质量分数为48.64%,试计算:
(1)此混合酯含氢的质量分数?
(2)将等物质的量相混合的A、B混合酯1mol完全燃烧,并消耗O23.5mol,则A和B的分子式可能有几种组合?
(3)若A和B互为同分异构体,则分子式为_____,写出酯的同分异构体的结构简式_____。
13、饱和一元醛和酮混合物5.8g,在气体时是同条件H2密度的29倍,等量的混合物溶于水后,与足量的银氨溶液反应,可析出8.64g 银,求此混合物由哪种醛和酮混合而成。
14、取一定量某液态饱和烃衍生物A,在1.01×105Pa170℃使其完全气化后,以1∶4体积比跟氧气混合后点燃,恰好完全反应,生成等体积的CO2和H2O(气),恢复到1.01×105Pa和170℃时,测得气体密度比反应前减少1/6,求A的分子式和结构简式。
15、有机物A是烃的含氧衍生物,在同温同压下,A蒸气的质量是同体积乙醇蒸气的2倍。1.38gA完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量会增加3.06g;若将燃烧产物通过浓H2SO4,浓H2SO4的质量会增加1.08g;取4.6gA与足量Na反应,生成的气体在标准状况下的体积为1.68L;A不与纯碱反应。通过计算试确定A的结构简式。
16、某种含有结晶水的羧酸A,在适宜的条件下可以完全分解为CO2、CO和H2O。取样品6.30g加热完分解得CO2:2.20g,CO:1.40g,水:2.70g。若中和0.2520g羧酸A需消耗20mL、0.2mol/L的NaOH溶液;若使0.005mol羧酸A完全转化为酯,需要0.460g乙醇,求羧酸A的分子式和无水物的结构式。
17、某液态有机物0.1mol与0.3mol氧气混合,于密闭容器中用电火花点火,燃烧完毕,将燃烧产物通入过量澄清石灰水中,可生成白色沉淀20.0g,溶液质量减少5.8g,剩余气继续通过灼热氧化铜,可使氧化铜质量减少1.6g,又知该有机物跟金属钠发生置换反应,还能发生银镜反应。通过计算写出该有机物的分子式,确定有机物的结构简式。
18、某饱和一元脂肪酸钠盐的结晶水合物10.88g,加热失去全部结晶水后,固
体物质的质量为6.56g。若把10.88g该结晶水合物跟50mL 1mol/L的NaOH溶液20.0mL恰好中和,求此脂肪酸钠结晶水合物的分子式。
19、乳酸是一种无色粘稠状物质,易溶于水。可由葡萄糖发酵制取,在酸牛奶中也可以找到乳酸,为研究乳酸分子的组成和结构,进行下述实验。
(1)称取纯净的乳酸9g,加热升温气化;所占有的体积在标况下为2.24L。
(2)将上述乳酸蒸气与足量的氧气混合后点燃,燃烧产物只有CO2和水。
(3)将燃烧产物通过碱石灰后,碱石灰增重14.2g,通过CuSO4白色粉末时,粉末不显蓝色,再通过足量的石灰水后有10g白色沉淀生成。
(4)将(3)中增重的碱石灰与过量的盐酸作用,产生气体4.48L(标准状况)
(5)乳酸在浓H2SO4催化下能与乙醇发生酯化反应,也能与乙酸发生酯化反应,而且乳酸分子中有-CH3。通过计算推出乳酸的分子式和结构简式。
20、测定污水的生物需氧量(BOD)的步骤是:取一定体积的污水与体积一定且含量一定的NaCl标准溶液混合,在20℃下的密闭保存5天后测定混合体系消耗掉的O2量,即一定体积污水中的BOD。
已知20℃常压下O2在纯水中的溶解度为0.0092 g/L;鱼在含氧量<0.04g/L的水中不能生存。经测定,某污水中含0.0010%的有机 物(以C6H10O5表示,摩尔质量162g/mol),试通过计算来回答鱼类在这种水里能否生存?
附答案
1、A:C4H8占20% B:CH4占80%
2、3/2≤nC3H6/nCH4≤4/1
3、C2H4。
4、CH4:17.14%、 C3H6:17.14%
或 C2H4:32.86%、 C2H6:32.86%
5、①R:CH4 Q:C4H6 ②0.14L
6、(1)CH4和丙烯 (2)n甲烷∶n丙烯=3∶1
7、(1)C3H4过量时,VO2=2(a-b),VC3H4=2b-a
(2)若恰好反应,VO2=2(a-b),VC3H4=(a-b) / 2
(3)当O2过量时,VO2=(a+b) / 2,VC3H4=(a-b) / 2。
8、
溶质 相应烃的分子式
1 Na2CO3 C3H6
2 NaHCO3 C6H12
3 Na2CO3和NaHCO3 C4H8或C5H10
4 Na2CO3、NaOH C2H4
9、(1)混合气体可能组合如下:
A的分子式 B的分子式 VA∶VB
C4H10 C3H6 1∶4
C4H10 C3H4 1∶4
C4H10 C2H4 3∶2
C4H10 C2H2 3∶2
(2)C4H10和C2H4,体积比为3∶2
10、(1)4L
(2)当x≤2 / 3时,V=5(1-x)L(氢气不足或适量);
x>2 / 3时,V=5(2x-1)L(氢气过量)
(3)如图
11.CH3COOH、
12、(1)8.11%
(2)一种:C3H6O2
(3)分子式:C3H6O2 结构简式:HCOOCH2CH3,CH3COOCH3
13、丙醛和丙酮
14、分子式:C3H6O 结构简式:CH3CH2CHO、CH3COCH3
15、
16、C2H6O6(C2H2O4·2H2O)、
17、C3H6O2,
18、CH3COONa·3H2O
19、分子式:C3H6O3 结构简式CH3-CH(OH)-COOH
20、1L水中的有机物的质量为:0.010(g),BOD的含量为0.012g/L>0.0092g/L,故鱼类不能生存。
五、综合计算
1、将一定量KClO3加热使其部分分解,然后向反应后的混合物中加入足量浓H2SO4,并加热发生如下反应:
KClO3+5KCl+3H2SO43Cl2↑+3K2SO4+3H2O
假设原KClO3为mmol,第一步分解反应的分解率为a,两步反应中生成的O2和Cl2的总物质的量为nmol。
(1)计算当氯元素全部转化为氯气时的a、n值。
(2)讨论当a在不同取值范围内的n值,并与(1)所算得的n值比较,确定该反应中n的最大值。
2、已知(SCN)2是一种与卤素单质化学性质相似的化合物,称拟卤素,其离子(SCN-)与X-的化学性质相似,称为拟卤离子。根据这一点,可以设计如下的实验来确定NaBr和NaCl混合物样品的组成。称取样品0.3672g,溶于水加入 0.2000mol/L AgNO3溶液 30.00mL(过量),再加入少量的含有Fe3+的溶液作指示剂,然后用 0.1000mol/L 的NH4SCN滴定溶液中过量的Ag+,到达滴定中点时用去NH4SCN溶液20.00mL。试回答以下问题:
(1)写出滴定过程中直到滴定终点的各步反应的离子方程式。
(2)计算样品中NaCl和NaBr的物质的量之比。
3、将amolH2S和1molO2置于一个容积可变的容器内进行反应,维持容器内气体的压强不变(101kPa)在120℃下测得反应前后容器内气体的密度分别为d1和d2。若a的取值不同,则H2S的氧化产物可能有如下三种情况:
(1)全部是SO2时,此时a的取值范围是_____。
(2)全部是S时,此时a的取值范围是_____,并且d1_____d2(填小于、大于或等于)。
(3)部分是SO2,部分是S,此时a的取值范围是_____,反应所生成的SO2的物质的量为_____mol,容器内气体的物质的量之和为_____mol。(以含a的代数式表示)
4、接触法制硫酸排放的尾气中,含少量二氧化硫。为防止污染大气,在排放前设法进行综合利用。
(1)某硫酸厂每天排放的1万米3尾气中含0.2%(体积分数) 的SO2,问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得多少千克石膏(CaSO4·2H2O)。
(2)如果将一定体积的尾气通入100mL2mol/L的氢氧化钠溶液使其完全反应,经测定所得溶液含16.7g溶质,试分析该溶液的成分,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠,调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量的最佳比值,从而提高亚硫酸氢钠的产量,现设nSO2、nNaOH、nNaHSO3分别表示SO2、NaOH、NaHSO3的物质的量,且nSO2/nNaOH=x,试写出x在不同取值范围时,nNaHSO3的值或nNaHSO3 与nSO2、nNaOH间的关系式。
x nNaHSO3
5、已知NH3和Cl2可快速反应。
2NH3+3Cl2N2+6HCl
图5-12为反应后总体积(VL)随原混合
气体中Cl2的体积分数(x %)而变化的曲
线。试计算:
(1)当反应结束时处于A、B两点时,原
混合物中Cl2的体积分数各是多少?
(2)当反应结束时处于A、B两点,混合
气体的总体积各是多少升?
(3)若反应结束时气体总体积为11L,则原混合物中Cl2的体积分数。
6、取0.45molNaOH、0.35molNa2CO3和0.20molNaHCO3溶于足量水中,然后在混合溶液中逐滴加入盐酸,反应明显分为三个阶段进行,若加入的HCl为nmol,溶液中NaCl、Na2CO3和NaHCO3分别为xmol、ymol、zmol。试分别计算n值增大过程中,不同反应阶段的n值取值范围所对应的x、y、z的值。将所得结果填入下表:(提示:Na2CO3与HCl的反过程为:
①Na2CO3+HCl==NaHCO3+NaCl
②NaHCO3+HCl==H2O+CO2↑+NaCl )
加入HCl(nmol) NaCl(xmol) Na2CO3(ymol) NaHCO3(zmol)
①
②
③
7、有一Na2O2的NaHCO3的均匀混合物粉末,将其分成两等份。其中一份加入100mL盐酸使其充分反应后,溶液呈中性,放出气体2.24L(标准状况);将上述气体通入另一份混合物中充分反应后,气体体积变为2.016L(标准状况)。求原混合物中Na2O2和NaHCO3的物质的量之比及加入盐酸的浓度各是多少?
8、用氨氧化法可制得50%HNO3,加脱水剂可进一步制得90%HNO3。某工厂同时生产50%HNO3和90%HNO3,两种产品质量比m 1/m 2=x(其中m 1、m 2分别为50%HNO3和90%HNO3质量)。若以17吨液氨为原料生产硝酸,请回答下列问题:
(1)导出理论上需水量(y吨)与质量比x的关系式(假定NH3的转化率为100%)是_____。
(2)根据导出的关系式求出只生产50%的HNO3所需的水量是_____;只生产90%的HNO3所需的水量是_____。
(3)质量比为_____时,进出水量保持平衡,此时两种产品的总质量为_____吨。
9、把1mol由氨气和氧气组成的混合气体通入密闭容器中,在催化剂存在下加热使之充分反应,然后恢复到常温常压。若混合气体中氧气有xmol,最后在反应器中产生的硝酸为ymol。
(1)写出氨的催化氧化及NO形成HNO3的化学方程式①_____;②_____。
(2)试确定x在不同的取值范围内y值表达式
x取值范围 y值表达式
①
②
③
(3)请在图5-13坐标上画出y=f(x)关系曲线。
10、在一支10mL试管中充满NO2
和O2,将其倒立于盛有足量水的水
槽中,若中y(mL)表示完全反应后试
管内剩余气体的体积,x(mL)表示原
混合气体中NO2的体积。
(1)填表
x的取值范围 y=f(x)
①当O2过量
②当NO2过量
(2)在坐标中绘出y=f(x)的曲线。
11、已知高温下能发生如下反应:Si+CSiC。现有石英砂和炭粉的混合物amol,在高温电炉中隔绝空气充分反应,经反应完全后,冷却得到残留固体。
(1)写出可能发生反应的化学方程式: ①_____;②_____。
(2)若石英砂与混合物的物质的量之比为x(0<x<1),试讨论x的取值范围;残留固体的成分和物质的量,并将结果填入下表:
x值 残留固体的化学式 残留固体的物质的量(mol)
①
②
③
④
⑤
12、今有碱金属的两种碳酸盐和碱土金属(第ⅡA族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标准状况),另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g。
(1)取过滤后滤液的1/10体积,向其中缓缓滴加浓
度为0.2500mol/L盐酸,并同时记录放出的CO2体积(标准
状况)和消耗盐酸的体积,得到如图5-14所示的曲线,
试计算确定为两种碳酸盐的化学式。
(2)将滤出的不溶性盐(1.420g)投入到浓度
为2.500mol/L盐酸中,当完全反应时,耗去盐酸16.00mL,试计算确定原不溶性碳酸盐的化学式。
13、在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4固体混合物,加热充分反为_____L。
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g,充分反应后,生成气体的体积(标准状况)为_____L。
14、使含有amolAl3+的A溶液中的铝元素和含有bmolAlO2-的B溶液中的铝元素全部转化为Al(OH)3沉淀,通过计算有几种途径。要求:
(1)不准另加固体和液体试剂。
(2)要答出每种途径所需试剂和物质的量。
15、在含amol[KAl(SO4)2]的溶液中逐滴加入Ba(OH)2溶液。
(1)写出反应的化学方程式。
(2)若已加入的Ba(OH)2溶液中含bmol溶质,试讨论:当a和b的比值为何值时,产生沉淀的成分及其物质的量各是多少?将计算结果填入下表:
a与b之比 产生的沉淀
分子式 物质的量/mol
16、把表面被氧化的A、B两个铝条分别放入甲、乙两种不同的溶液里。①把含有10.2g氧化铝的铝条放入1L1.5mol/L热的NaOH溶液中(甲),过一段时间取出A铝条,甲溶液增重12.6g。②把一定量的B铅条放入1L0.9mol/L的硫酸溶液中(乙),过一段时间取出B铝条,其质量减少了25.8g,溶液乙的质量增加了25.2g。设:反应后甲、乙两溶液体积仍各为1L。求:
(1)反应后甲溶液中的溶质是什么?其物质的量浓度是多少?
(2)反应后乙溶液中的溶质是什么?其物质的量浓度是多少?
(3)反应后的两种溶液相互混合时,若要滴加的量最小,而产生沉淀量最多,应如何操作?产生沉淀的最大质量是多少克?
17、有一铝粉和Fe3O4组成的铝热剂,在隔绝空气的条件下灼烧,使之充分反应。将所得混合物研细,并分成两等份,分别投入过量NaOH溶液和盐酸中。充分反应后,前者消耗m molNaOH,放出气体0.336L;后者消耗HCln mol,放出气体VL。若将等质量的这种铝热剂中的铝粉与足量稀H2SO4作用,可得气体3.36L(气体体积均在标准状况下测定)。求:
(1)该铝热剂中Al、Fe3O4的质量分数各为多少?
(2)m、n、V的值。
18、我国规定饮用水的硬度不能超过25度。硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其质量折算成CaO的质量。通常把1L水中含有10mgCaO称为1度。水中的Ca2+和Mg2+可用一定浓度的 Y 溶液进行滴定, Y 跟Ca2+和Mg2+都以物质的量完全反应。
(1)现取某地区的地下水样25.0mL,用0.01mol/L Y 溶液测定,完全反应时消耗 Y 溶液15.0mL。试计算该地下水的硬度,并判断是否符合饮用水的标准。
(2)如果每次分析时,取的水样都是25.0mL,为了便于计算,要求每消耗0.50mL Y 溶液即相当于水的硬度1度。则 Y 溶液的物质的量浓度应是多少?
19、在已平衡的托盘天平左右托盘上各放一只等质量的烧杯,并分别往烧杯中注入5mol/L盐酸60毫升。向左盘烧杯中放入a克CaCO3粉末,往右盘烧杯中加入x克A物质粉末,充分反应后天平仍保持平衡。
(1)若A为NaHCO3
①当a≤15时,x的值为_____;(用含a的代数式表示,以下同)
②当18.6≥a>15时,x的值为_____;
③当a>18.6时,x的值为_____。
(2)若A为KHCO3,且两只烧杯中均无固态物质存在,则x的取值必须满足的条件是_____。
20、具有线型结构的某二元化合物A中,氧的质量百分含量为47.0%,P2O5存在下加热,可从含氧为61.5%的某种酸W的一个分子中分解出2个水分子得到A,试通过计算推出A的化学式,W的结构简式,并写出W分解的化学方程式。
附答案:
1、(1)a=5 / 6, n=1.75m
(2)a>5 / 6时,n>1.75m;当a<5 / 6时,n<1.75m;a=5 / 6时,n=1.75m为最大值。
2、(1)Ag++SCN-=AgSCN↓
Fe3++SCN-=[Fe(SCN)]2+,
nNaBr∶nNaCl=0.003∶0.001=3∶1。
3、(1)a≤2 / 3
(2)a≥2,大于
(3)2 / 3<a<2,1-a / 2,1+a / 2。
4、(1)153.6kg
(2)该溶液成分为Na2SO3和NaHCO3,NaHSO3为0.1mol,Na2SO3为0.05mol。
(3)
nNaHSO3
x≤1 / 2 0
1 / 2<x<1 nNaHSO3=2nSO3-nNaOH
x≥1 nNaHSO3=nNaOH
5、(1)A点时VCl2=27.27%,B点时,VCl2=60%
(2)A点 2.45L,B点37.8L (3)17.8%或35.2%。
6、
HCl(n mol) NaCl(xmol) Na2CO3(ymol) NaHCO3(zmol)
① 0<n≤0.25 n 0.55 0
② 0.25<n≤0.8 n 0.8-n n-0.25
③ 0.8<n≤1.35 n 0 1.35-n
7、(1)Na2O2足量与放出的2.24L气体反应后,2.016L气体为O2时,n Na2O2∶n NaHCO3=8∶1,cHCl=3.4mol/L。
(2)2.24L气体通入混合物,Na2O2不足时,2.016L气体为CO2和O2混合物。n Na2O2∶n NaHCO3=2∶9,cHCl=1.3mol/L。
8、(1)y=(225x-99)/(5x+9)
(2)45吨(补充),11吨(脱水)
(3)x=11 / 25,81吨
9、(1)4NH3+5O24NO+6H2O……①
1-x x
4NO+3O2+2H2O4HNO3……②
(2)①0<x≤5 / 9,y=0,
②5 / 9<x≤2 / 3,y=3x-5 / 3,
③2 / 3<x<1,y=1-x
(3)见图10。
10、(1)0≤x≤8 y=10-5x / 4
(2)8<x≤10 y=5x / 3-40 / 3 见图11。
11、(1)①SiO2+2CSi+2CO↑ ②SiO2+3CSiC+2CO↑
(2)①x>1 / 3,按①式完全反应,n SO2=a / 2(3x-1), nSi=a / 2(1-x)。
②x=1 / 3,按①式完全反应,nSi=a / 3
③1 / 4<x<1 / 3,按①、②式反应,nSi=(4x-1)a nSiC=(1-3x)a
④x=1 / 4,按②式完全反应,nSiC=a / 4
⑤x<1 / 4,按②式反应,nC=(1-4x)a,nSiC=ax
12、(1)K2CO3、KHCO3
(2)Mg2(OH)CO3。
13、(1)5mol/L
(2)15.68L
(3)16.8L。
14、(1)分别向A中通入3a molNH3,向B中通入b / 2 molCO2。
(2)A与B混合。①若A、B恰好反应,不另加试剂。
②若a>b / 3时,Al3+剩余(a-b)/ 3(mol),加氨气3a-b(mol)。
③当a<b / 3时,AlO2-剩余b-3a(mol),通CO2(b-3a) / 2(mol) (提示:通CO2使AlO2-沉淀完全的反应为: 2AlO2-+CO2+3H2O2Al(OH)3↓+CO32-)
15、(1)2KAl(SO4)2+3Ba(OH)22Al(OH)3↓+3BaSO4↓+K2SO4
〔Ba(OH)2不足〕
KAl(SO4)2+2Ba(OH)22BaSO4↓+KAlO2+2H2O
〔Ba(OH)2足量〕
(2)
a与b之比 产生的沉淀
分子式 物质的量/mol
a / b≥2 / 3 Al(OH)3 2b / 3
BaSO4 b
1 / 2<a / b
<2 / 3 Al(OH)3 4a-4b
BaSO4 b
a / b≤1 / 2 BaSO4 2a
16、(1)NaAlO2 0.3mol/L, NaOH 1.2mol/L
(2)Al2(SO4)3 0.3mol/L
(3)将乙溶液滴加到甲溶液中,62.4g。
〔提示:(3)若将反应后的甲、乙溶液全部混合,乙溶液过量。〕
17、(1)wAl=28.0% wFe3O4=72.0%
(2)n=0.24mol, m=0.05mol, V=1.344L。
18、(1)33.6度,不符合
(2)0.00892mol/L。
19、(1)①x=1.176a ②x=2.1a-13.86 ③x=a+6.6
(2)x=a≤15
20、A的化学式为C3O2;结构简式:HOOC-CH2-COOH 分解的化学方程式为:
HOOC-CH2-COOHC3O2+2H2O
同课章节目录
