广东 化学图形题及其解题策略[下学期]
文档属性
| 名称 | 广东 化学图形题及其解题策略[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 495.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-04-10 08:22:00 | ||
图片预览

文档简介
化学图形题及其解题策略
一.概述
化学图形题是一种利用数学中的二维图象解决化学问题的题型。它考查范围广,中学化学中的所有内容,如元素化合物、化学基本概念和理论、化学实验、化学计算等均可以此方式进行考查。随着高考改革的不断深入及对学生综合能力要求的不断提高,这种以数学方法解决化学问题的题目不断增多。
这类题型的特点是:图象是题目的主要组成部分,把所要考查的知识寓于坐标曲线上,简明、直观、形象。解答图象题必须抓住有关概念和有关物质的性质、反应规律及图象特点。析图的关键在于对“数” “形” “义” “性”的综合思考,其重点是弄清“起点” “交点” “转折点(拐点)”“终点” 及各条线段的化学含义。
二.题型分类
从是否主要从量的角度考查可将图象题分为:侧重定性考查和侧重定量考查两类。侧重定性考查的题目其考查重点是:化学反应(过程)的特点(规律)、化学反应的先后顺序等。
例1.(04广东)下图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( C )
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
例2.(03上海)下列实验过程中产生的现象与对应的图形相符合的是 D
A.NaHSO3粉末加入HNO3溶液中 B.H2S气体通入氯水中
C.NaOH溶液滴入Ba(HCO3)2溶液中 D.CO2气体通入澄清石灰水中
例3. (02上海)将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(v)的关系正确的是( D )
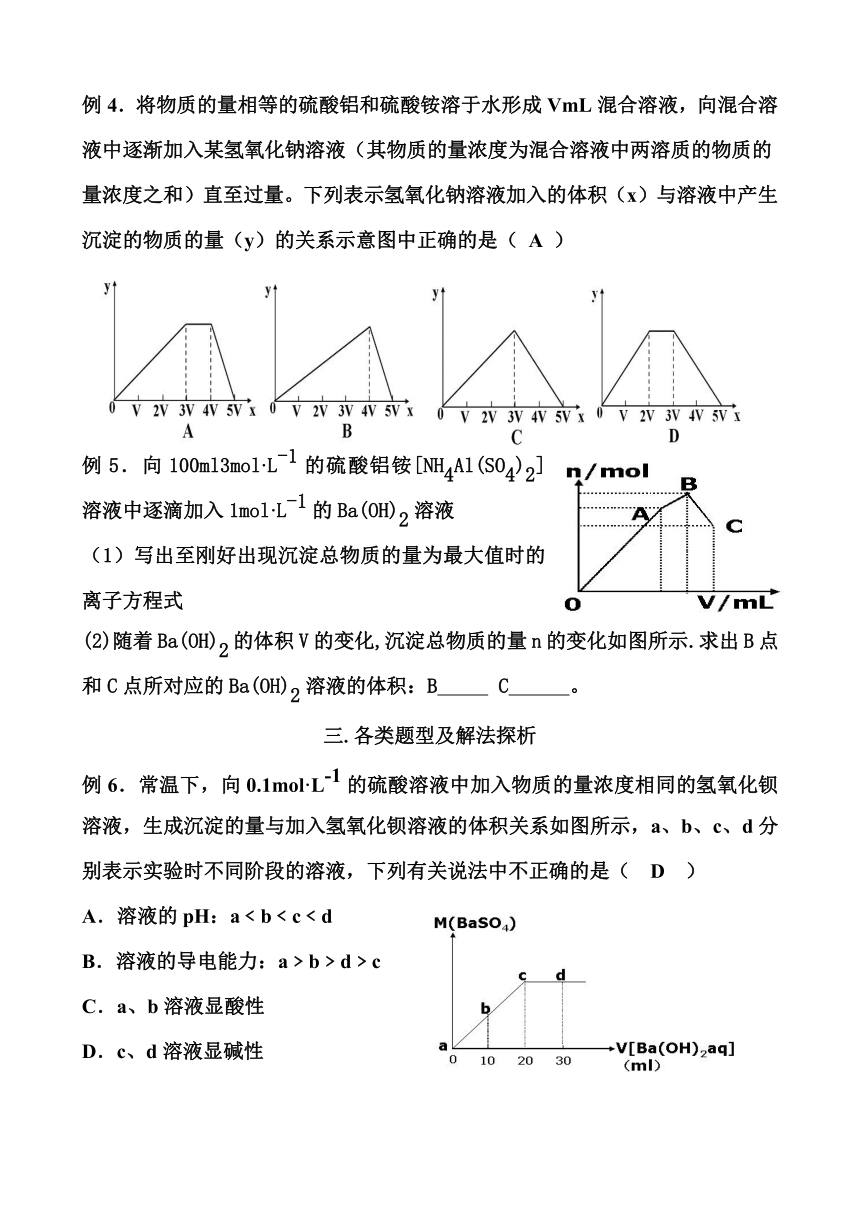
例4.将物质的量相等的硫酸铝和硫酸铵溶于水形成VmL混合溶液,向混合溶液中逐渐加入某氢氧化钠溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和)直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中产生沉淀的物质的量(y)的关系示意图中正确的是( A )
例5.向100ml3mol·L-1的硫酸铝铵[NH4Al(SO4)2]溶液中逐滴加入1mol·L-1的Ba(OH)2溶液
(1)写出至刚好出现沉淀总物质的量为最大值时的离子方程式
(2)随着Ba(OH)2的体积V的变化,沉淀总物质的量n的变化如图所示.求出B点和C点所对应的Ba(OH)2溶液的体积:B C 。
三.各类题型及解法探析
例6.常温下,向0.1mol·L-1的硫酸溶液中加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是( D )
A.溶液的pH:a﹤b﹤c﹤d
B.溶液的导电能力:a﹥b﹥d﹥c
C.a、b溶液显酸性
D.c、d溶液显碱性
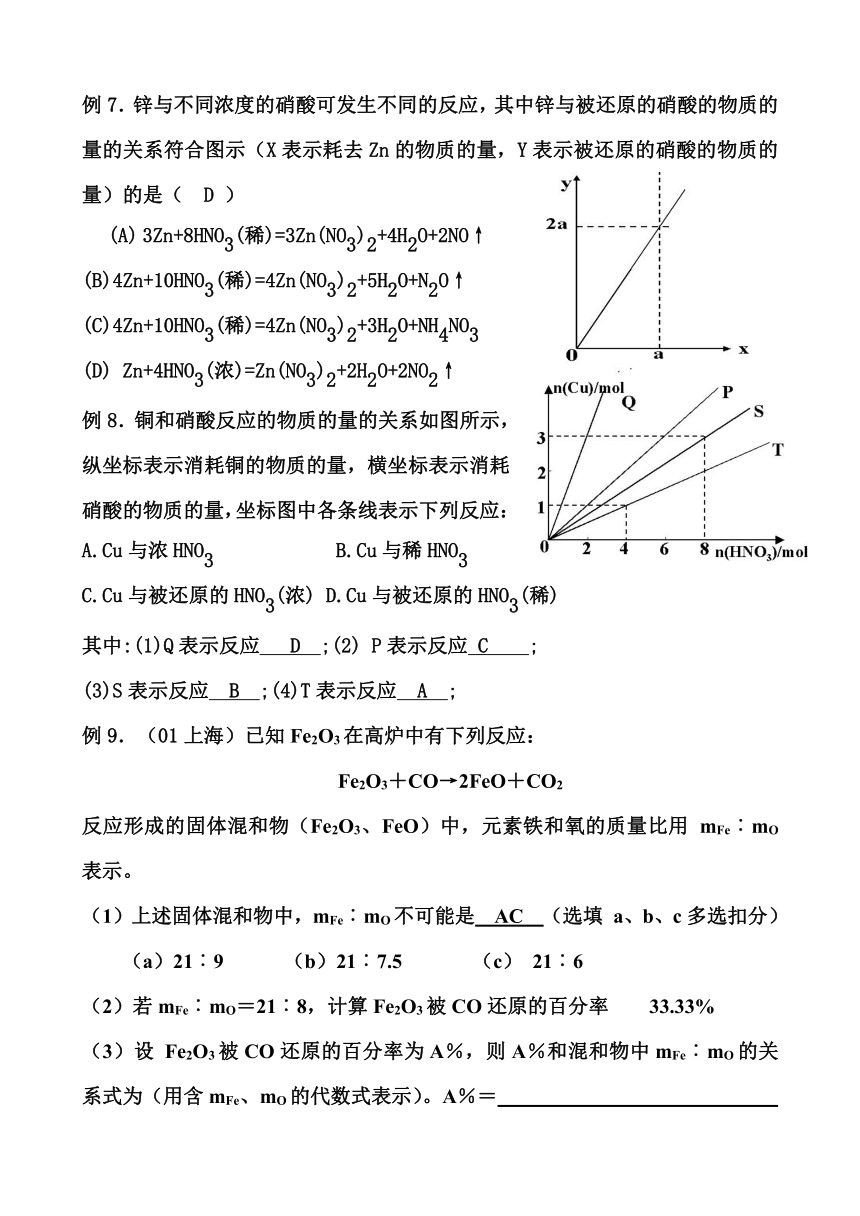
例7.锌与不同浓度的硝酸可发生不同的反应,其中锌与被还原的硝酸的物质的量的关系符合图示(X表示耗去Zn的物质的量,Y表示被还原的硝酸的物质的量)的是( D )
(A) 3Zn+8HNO3(稀)=3Zn(NO3)2+4H2O+2NO↑
(B)4Zn+10HNO3(稀)=4Zn(NO3)2+5H2O+N2O↑
(C)4Zn+10HNO3(稀)=4Zn(NO3)2+3H2O+NH4NO3
(D) Zn+4HNO3(浓)=Zn(NO3)2+2H2O+2NO2↑
例8.铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列反应:
A.Cu与浓HNO3 B.Cu与稀HNO3
C.Cu与被还原的HNO3(浓) D.Cu与被还原的HNO3(稀)
其中:(1)Q表示反应 D ;(2) P表示反应 C ;
(3)S表示反应 B ;(4)T表示反应 A ;
例9.(01上海)已知Fe2O3在高炉中有下列反应:
Fe2O3+CO→2FeO+CO2
反应形成的固体混和物(Fe2O3、FeO)中,元素铁和氧的质量比用 mFe︰mO表示。
(1)上述固体混和物中,mFe︰mO不可能是 AC (选填 a、b、c多选扣分)
(a)21︰9 (b)21︰7.5 (c) 21︰6
(2)若mFe︰mO=21︰8,计算Fe2O3被CO还原的百分率 33.33%
(3)设 Fe2O3被CO还原的百分率为A%,则A%和混和物中mFe︰mO的关系式为(用含mFe、mO的代数式表示)。A%=
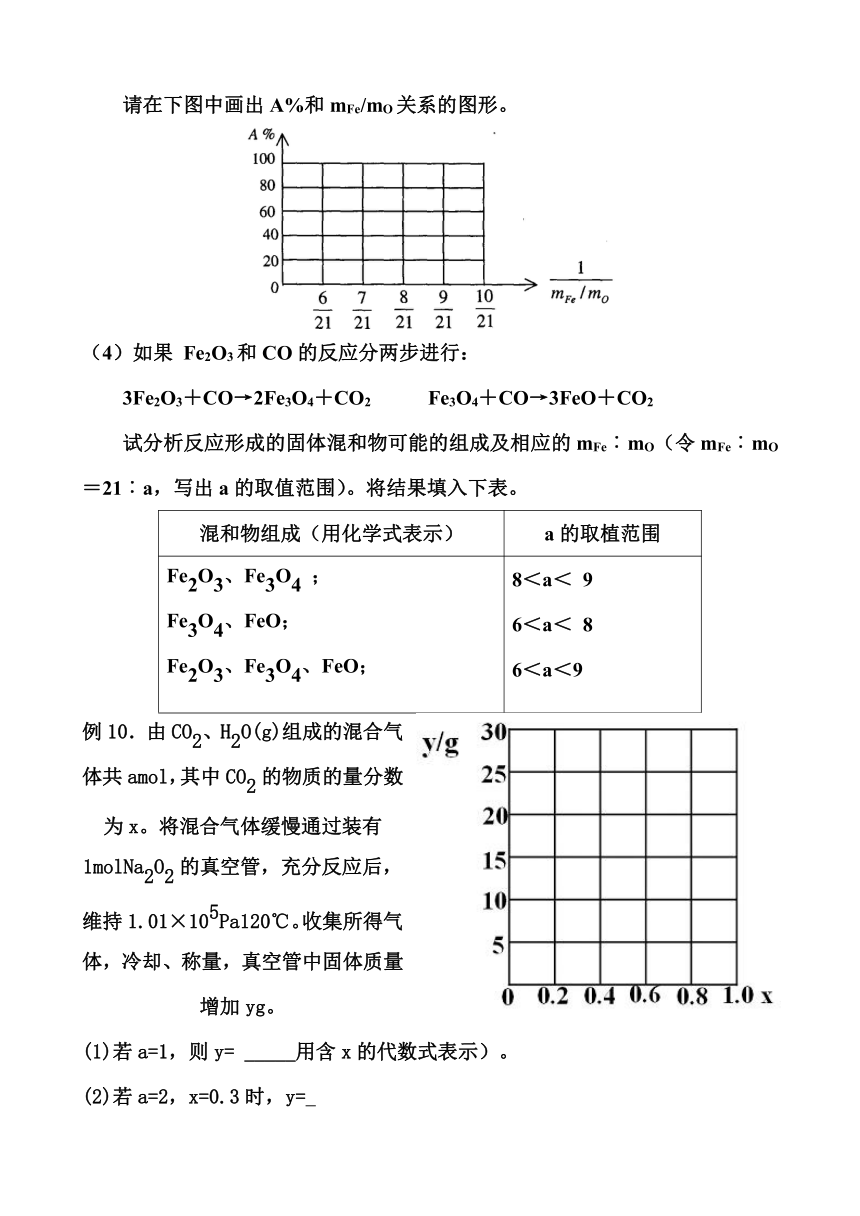
请在下图中画出A%和mFe/mO关系的图形。
(4)如果 Fe2O3和CO的反应分两步进行:
3Fe2O3+CO→2Fe3O4+CO2 Fe3O4+CO→3FeO+CO2
试分析反应形成的固体混和物可能的组成及相应的mFe︰mO(令mFe︰mO=21︰a,写出a的取值范围)。将结果填入下表。
混和物组成(用化学式表示) a的取植范围
Fe2O3、Fe3O4 ;Fe3O4、FeO;Fe2O3、Fe3O4、FeO; 8<a< 96<a< 86<a<9
例10.由CO2、H2O(g)组成的混合气体共amol,其中CO2的物质的量分数为x。将混合气体缓慢通过装有1molNa2O2的真空管,充分反应后,维持1.01×105Pa120℃。收集所得气体,冷却、称量,真空管中固体质量增加yg。
(1)若a=1,则y= _____用含x的代数式表示)。
(2)若a=2,x=0.3时,y=
(3)若a=2,试讨论:x取值不同时,反应后所得气体的成份及y的表达式。
(4)若a=1.25,试作图表示y与x的关系。
【练习】
1.将0.03molCl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程中,溶液的[H+]与Cl2用量的关系示意图是(溶液的体积示为不变)A
2. 向含3mol Ca(OH)2的石灰水中逐滴加入H3PO4溶液至不再发生反应为止,所得盐的物质的量(纵坐标y)与加入H3PO4物质的量(横坐标x)的关系图是D
3. 向1.0mol/L的甲溶液中逐滴加入1.0mol/L的乙溶液,产生Al(OH)3沉淀的质量(用y轴表示)与所加入乙溶液的体积(用x轴表示)的关系如下图所示.符合图中关系的是下列各组溶液中的D
(A) (B) (C) (D)
甲 AlCl3 NaOH NaAlO2 HCl
乙 NaOH AlCl3 HCl NaAlO2
4、某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如右图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为D
A、1:1:1 B、1:3:1 C、3:3:8 D、1:1:4
5、向10 mL 1 mol/L的Ba(OH)2溶液中逐滴加入x mL 1 mol/L的H3PO4溶液时,产生沉淀的物质的量与滴入H3PO4的体积之间的曲线如图所示。试分析:
(1)O~A段沉淀物的化学式为 。
(2)A~B段反应的化学方程式为 。
(3)x2=_________mL,x1=_________mL。
答案:(1)Ba3(PO4)2 (2)Ba3(PO4)2+H3PO4=3BaHPO4 (3)10
6、在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为D
A、6:1 B、3:1 C、2:1 D、1:2
7、某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图所示。请填写下列空白:
⑴在该溶液中含有的离子是 ,它们的物质的量浓度之比为 。
⑵所加的淡黄色固体是 (化学式)。
[答案:]⑴NH4+、Al3+、Mg2+,n(Mg2+):n(Al3+):n(NH4+)=1:1:3。 ⑵Na2O2。
8、将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160mL时,则金属粉末中n(Mg)= mol,V2= mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是: 。
[答案:]⑴0.06 mol,440 mL。 ⑵400 mL。 ⑶≤a<1。
9、将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300 mL 2 mol/L盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。已知:
①加入固体A的质量m≤3.2 g时,收集到的气体为H2;
②当m>3.2 g时,收集到的气体为H2和H2S的混合气体。
⑴3.2 g固体A中所含的物质有 。
⑵3.2 g固体A中各物质的物质的量分别为
,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为 (忽略溶液体积的变化)。
⑶当固体A全部溶于上述盐酸,且A的质量m>3.2 g时,收集到的气体体积(标准状况下)
V= mL(用含m的代数式表示)。
(1)Fe、FeS (2)n(Fe)=0.01 mol n(FeS)=0.03 mol c(H2S)=0.1 mol·L—1
(3)(24≥m>3.2)
10.某气态不饱和链烃CnHm在一定条件下与H2加成为CnHm+x,取CnHm与H2的混合气体共60ml进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积也不同,反应前混合气中H2所占的体积W(ml)和反应后气体总体积V(ml)的关系如图(同温同压),由此可知x的数值是 A
A.4 B.3
C.2 D.1
一.概述
化学图形题是一种利用数学中的二维图象解决化学问题的题型。它考查范围广,中学化学中的所有内容,如元素化合物、化学基本概念和理论、化学实验、化学计算等均可以此方式进行考查。随着高考改革的不断深入及对学生综合能力要求的不断提高,这种以数学方法解决化学问题的题目不断增多。
这类题型的特点是:图象是题目的主要组成部分,把所要考查的知识寓于坐标曲线上,简明、直观、形象。解答图象题必须抓住有关概念和有关物质的性质、反应规律及图象特点。析图的关键在于对“数” “形” “义” “性”的综合思考,其重点是弄清“起点” “交点” “转折点(拐点)”“终点” 及各条线段的化学含义。
二.题型分类
从是否主要从量的角度考查可将图象题分为:侧重定性考查和侧重定量考查两类。侧重定性考查的题目其考查重点是:化学反应(过程)的特点(规律)、化学反应的先后顺序等。
例1.(04广东)下图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( C )
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
例2.(03上海)下列实验过程中产生的现象与对应的图形相符合的是 D
A.NaHSO3粉末加入HNO3溶液中 B.H2S气体通入氯水中
C.NaOH溶液滴入Ba(HCO3)2溶液中 D.CO2气体通入澄清石灰水中
例3. (02上海)将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(v)的关系正确的是( D )
例4.将物质的量相等的硫酸铝和硫酸铵溶于水形成VmL混合溶液,向混合溶液中逐渐加入某氢氧化钠溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和)直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中产生沉淀的物质的量(y)的关系示意图中正确的是( A )
例5.向100ml3mol·L-1的硫酸铝铵[NH4Al(SO4)2]溶液中逐滴加入1mol·L-1的Ba(OH)2溶液
(1)写出至刚好出现沉淀总物质的量为最大值时的离子方程式
(2)随着Ba(OH)2的体积V的变化,沉淀总物质的量n的变化如图所示.求出B点和C点所对应的Ba(OH)2溶液的体积:B C 。
三.各类题型及解法探析
例6.常温下,向0.1mol·L-1的硫酸溶液中加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是( D )
A.溶液的pH:a﹤b﹤c﹤d
B.溶液的导电能力:a﹥b﹥d﹥c
C.a、b溶液显酸性
D.c、d溶液显碱性
例7.锌与不同浓度的硝酸可发生不同的反应,其中锌与被还原的硝酸的物质的量的关系符合图示(X表示耗去Zn的物质的量,Y表示被还原的硝酸的物质的量)的是( D )
(A) 3Zn+8HNO3(稀)=3Zn(NO3)2+4H2O+2NO↑
(B)4Zn+10HNO3(稀)=4Zn(NO3)2+5H2O+N2O↑
(C)4Zn+10HNO3(稀)=4Zn(NO3)2+3H2O+NH4NO3
(D) Zn+4HNO3(浓)=Zn(NO3)2+2H2O+2NO2↑
例8.铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列反应:
A.Cu与浓HNO3 B.Cu与稀HNO3
C.Cu与被还原的HNO3(浓) D.Cu与被还原的HNO3(稀)
其中:(1)Q表示反应 D ;(2) P表示反应 C ;
(3)S表示反应 B ;(4)T表示反应 A ;
例9.(01上海)已知Fe2O3在高炉中有下列反应:
Fe2O3+CO→2FeO+CO2
反应形成的固体混和物(Fe2O3、FeO)中,元素铁和氧的质量比用 mFe︰mO表示。
(1)上述固体混和物中,mFe︰mO不可能是 AC (选填 a、b、c多选扣分)
(a)21︰9 (b)21︰7.5 (c) 21︰6
(2)若mFe︰mO=21︰8,计算Fe2O3被CO还原的百分率 33.33%
(3)设 Fe2O3被CO还原的百分率为A%,则A%和混和物中mFe︰mO的关系式为(用含mFe、mO的代数式表示)。A%=
请在下图中画出A%和mFe/mO关系的图形。
(4)如果 Fe2O3和CO的反应分两步进行:
3Fe2O3+CO→2Fe3O4+CO2 Fe3O4+CO→3FeO+CO2
试分析反应形成的固体混和物可能的组成及相应的mFe︰mO(令mFe︰mO=21︰a,写出a的取值范围)。将结果填入下表。
混和物组成(用化学式表示) a的取植范围
Fe2O3、Fe3O4 ;Fe3O4、FeO;Fe2O3、Fe3O4、FeO; 8<a< 96<a< 86<a<9
例10.由CO2、H2O(g)组成的混合气体共amol,其中CO2的物质的量分数为x。将混合气体缓慢通过装有1molNa2O2的真空管,充分反应后,维持1.01×105Pa120℃。收集所得气体,冷却、称量,真空管中固体质量增加yg。
(1)若a=1,则y= _____用含x的代数式表示)。
(2)若a=2,x=0.3时,y=
(3)若a=2,试讨论:x取值不同时,反应后所得气体的成份及y的表达式。
(4)若a=1.25,试作图表示y与x的关系。
【练习】
1.将0.03molCl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程中,溶液的[H+]与Cl2用量的关系示意图是(溶液的体积示为不变)A
2. 向含3mol Ca(OH)2的石灰水中逐滴加入H3PO4溶液至不再发生反应为止,所得盐的物质的量(纵坐标y)与加入H3PO4物质的量(横坐标x)的关系图是D
3. 向1.0mol/L的甲溶液中逐滴加入1.0mol/L的乙溶液,产生Al(OH)3沉淀的质量(用y轴表示)与所加入乙溶液的体积(用x轴表示)的关系如下图所示.符合图中关系的是下列各组溶液中的D
(A) (B) (C) (D)
甲 AlCl3 NaOH NaAlO2 HCl
乙 NaOH AlCl3 HCl NaAlO2
4、某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如右图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为D
A、1:1:1 B、1:3:1 C、3:3:8 D、1:1:4
5、向10 mL 1 mol/L的Ba(OH)2溶液中逐滴加入x mL 1 mol/L的H3PO4溶液时,产生沉淀的物质的量与滴入H3PO4的体积之间的曲线如图所示。试分析:
(1)O~A段沉淀物的化学式为 。
(2)A~B段反应的化学方程式为 。
(3)x2=_________mL,x1=_________mL。
答案:(1)Ba3(PO4)2 (2)Ba3(PO4)2+H3PO4=3BaHPO4 (3)10
6、在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为D
A、6:1 B、3:1 C、2:1 D、1:2
7、某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图所示。请填写下列空白:
⑴在该溶液中含有的离子是 ,它们的物质的量浓度之比为 。
⑵所加的淡黄色固体是 (化学式)。
[答案:]⑴NH4+、Al3+、Mg2+,n(Mg2+):n(Al3+):n(NH4+)=1:1:3。 ⑵Na2O2。
8、将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160mL时,则金属粉末中n(Mg)= mol,V2= mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是: 。
[答案:]⑴0.06 mol,440 mL。 ⑵400 mL。 ⑶≤a<1。
9、将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300 mL 2 mol/L盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。已知:
①加入固体A的质量m≤3.2 g时,收集到的气体为H2;
②当m>3.2 g时,收集到的气体为H2和H2S的混合气体。
⑴3.2 g固体A中所含的物质有 。
⑵3.2 g固体A中各物质的物质的量分别为
,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为 (忽略溶液体积的变化)。
⑶当固体A全部溶于上述盐酸,且A的质量m>3.2 g时,收集到的气体体积(标准状况下)
V= mL(用含m的代数式表示)。
(1)Fe、FeS (2)n(Fe)=0.01 mol n(FeS)=0.03 mol c(H2S)=0.1 mol·L—1
(3)(24≥m>3.2)
10.某气态不饱和链烃CnHm在一定条件下与H2加成为CnHm+x,取CnHm与H2的混合气体共60ml进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积也不同,反应前混合气中H2所占的体积W(ml)和反应后气体总体积V(ml)的关系如图(同温同压),由此可知x的数值是 A
A.4 B.3
C.2 D.1
同课章节目录
